Дистрофия мочевого пузыря лечение

Под понятием «нейрогенный мочевой пузырь» подразумевают дисфункцию мочевого пузыря, появляющуюся по причине приобретенных или врожденных пороков нервной системы. Различают два типа этого заболевания: гипорефлекторный и гиперрефлекторный, каждый из них определяется по состоянию детрузора. Нейрогенный мочевой пузырь, симптомы которого доставляют больным много неудобств, диагностируется путем целого перечня медицинских исследований. Прежде всего, назначается полный спектр неврологических и урологических обследований. Лечение нейрогенного мочевого пузыря проходит путем медикаментозной и немедикаментозной терапии, иногда прибегают к катетеризации мочевого пузыря, в некоторых случаях требуется хирургическое вмешательство.
Такая дисфункция встречается довольно часто, она проявляется в отсутствии возможности осуществления произвольно-рефлекторного накопления, а также выделения мочи, спровоцированных функциональными, а также органическими поражениями нервных путей, центров, отвечающих за контроль этих процессов.
Нейрогенный мочевой пузырь, причины возникновения заболевания которого не всегда ясны, характеризуется расстройствами, заставляющими человека отказываться от многих проявлений социальной активности и радостей жизни, нарушающими его взаимоотношения с социумом.
Часто на фоне этого синдрома наблюдаются также синдром венозного застоя в тазовой части, миофасциальный синдром. Нередко вместе с ним появляются различные изменения мочевыделительной системы дистрофического или воспалительного характера. К примеру, пиелонефрит, уретерогидронефроз, пузырно-мочеточниковый рефлюкс, провоцирующие тяжелые заболевания, такие как хроническая почечная недостаточность, артериальная гипертензия, нефросклероз.

Причины возникновения синдрома нейрогенного мочевого пузыря
Причиной нейрогенного мочевого пузыря нередко является сбой, случившийся на одном из множества уровней регуляции мочеиспускательного процесса. Среди взрослого населения оба варианта этого синдрома нередко возникают в результате травм спинного, головного мозга, вызванных инсультом, оперативным вмешательством, сдавливанием, переломом позвоночника. Также его причиной могут стать заболевания нервной системы, в основном, воспалительно-дегенеративного характера, опухоли, к примеру, туберкулома, полинейропатия поствакцинального, диабетического или токсического происхождения, холестеатома, рассеянный энцефаломиелит и энцефалит, полирадикулоневрит.
Нейрогенный мочевой пузырь распространен среди детей. Синдром может быть последствием родовой травмы или врожденных нарушений в мочевыделительных органах, врожденных проблемах с ЦНС. После перенесенных заболеваний неврологического характера, а также цистита может снизиться эластичность мочевого пузыря, уменьшиться его вместительность, что провоцирует недержание мочи при синдроме нейрогенного мочевого пузыря.
Симптоматика нейрогенного мочевого пузыря
Распространенным симптомом гиперрефлексии детрузора, появляющейся при повреждениях, локализующихся выше центра мочеиспускания, считается более частое мочеиспускание, чем обычно. Также возникает странгурия (учащенное, затрудненное мочеиспускание, при котором возникают болевые ощущения), императивное недержание мочи. В проявлении признаков нейрогенного мочевого пузыря нет налаженной системы. Этот факт особенно сказывается на социальной активности пациентов, которые испытывают неловкость при их возникновении и страх, что симптомы проявятся в самый неподходящий момент.
Такие симптомы являются проявлением потери или уменьшения произвольного контроля над мочеиспусканием, а также угасания адаптационной функции детрузора. В результате в мочевом пузыре не может накопиться необходимый объем мочи, при этом самостоятельный мочеиспускательный акт сохраняется.
Если поражение приходится на область над крестцом, возникает гиперрефлексия детрузора, а иногда и императивное недержание мочи (например, при церебральных нарушениях). Особенность спинальных повреждений заключается еще и в том, что страдают ретикулоспинальные пути, которые играют роль в синергетической интеграции активности детрузора, а также уретрального сфинктера. Поэтому появляется непроизвольное сокращение детрузора и сокращение сфинктера уретры. При этом мочеиспускание задерживается, повышается давление внутри пузыря.
При таких поражениях спинного мозга возникает частое мочеиспускание, также бывает императивное мочеиспускание, а иногда и императивное недержание мочи, при этом зачастую наблюдается странгурия. Также популярным симптомом становится прерывистое мочеиспускание, проходящее с промежутками. При прерывании струи возникает боль в промежности и нижней части живота. В такой ситуации мочевой пузырь опорожняется не полностью, а остаточная моча может привести к различным воспалениям в мочевом пузыре и мочевых путях. В случае с такими поражениями поперечнополосатый сфинктер расслабляется не на 100%, может возникнуть его паралич, что приведет к сфинктерному недержанию мочи.
Если поражение возникает непосредственно в районе крестца, развивается угасание рефлекторного сокращения, детрузора, также способность к сокращению теряет поперечнополосатый уретральный сфинктер. В таких ситуациях у человека могут исчезнуть позывы к мочеиспусканию. Если при отсутствии позыва пациент не проводит регулярное принудительное опорожнение пузыря, он переполняется, возникает недержание мочи. Также как вариант может наблюдаться затруднение процесса мочеиспускания, оно может проходить в виде тонкой струи, при этом пузырь полностью не опустошается. В случаях крестцовых поражений нейрогенный мочевой пузырь, лечение которого не провели вовремя, может стать причиной различных заболеваний и нарушений, таких как пузырно-мочеточниковый рефлюкс, хроническая почечная недостаточность, пиелонефрит и др.
Серьезные нарушения возникают при любой денервации мочевого пузыря. Заболевание часто сочетается с циститом, который становится причиной склерозирования мочевого пузыря и его микроциста (сморщивания). В случае возникновения такого осложнения зачастую приходится прибегать к увеличению размера мочевого пузыря оперативным путем.
Обнаружили симптомы данного заболевания?
Звоните
Наши специалисты проконсультируют Вас!
Диагностика нейрогенного мочевого пузыря
Нейрогенный мочевой пузырь, симптомы которого очень разнообразные и сложные, плохо поддается диагностике. В этом случае для проведения правильного лечения нужно не только поставить диагноз, но и уточнить патогенез заболевания, уточнить, какие именно изменения в каких органах и системах произошли.
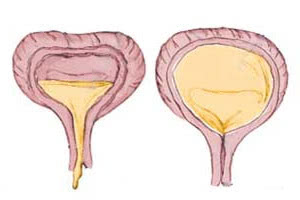
В первую очередь, специалист внимательно анализирует анамнез пациента. Это помогает узнать о характере расстройств мочеиспускания, определить, есть ли еще какие-либо симптомы: общее недомогание, чувство жажды, нарушения зрения, а также расстройство кишечника. Также необходимо прояснить информацию о том, какова динамика мочеиспускательных расстройств. Постановку диагноза упростят данные о заболеваниях нервной системы, в частности тех, которые сопровождаются параличом нижней части туловища, наличии травм головы, позвоночника, спинномозговых грыж.
На приеме врач осматривает пациента, оценивая его внешний вид. К примеру, иногда проявляется неуверенность в походке, человек переваливается с боку на бок (ее называют «утиной»). Также специалист проводит исследование рефлексов и чувствительности. Визуальный осмотр и пальпирование дают возможность выявить наличие свищей крестцового канала, спинномозговых грыж, недоразвитие копчика или крестца и прочие дефекты. Проблемы с процессами мочеиспускания и дефекации могут выдать запах, пятно на белье, гипертрофия крайней плоти. Также важно оценить состояние мочевого пузыря (растянутость), проверить болезненность почек, определить наличие или отсутствие атонии сфинктера.
Среди лабораторных исследований обязательным считается общий анализ мочи, анализ по Нечипоренко, проба по Зимницкому. Также назначают общий анализ крови (он помогает выявить анемию), различные биохимические исследования крови, дающие возможность выявить сбои в электролитном обмене, встречающиеся при хронической почечной недостаточности, проводят клиренсовые пробы.
Важным аспектом в диагностике синдрома являются рентгенологические исследования:
- Обзорная рентгенография (позволяет оценить величину контуров почек и мочевого пузыря, выявить расщепление спинномозгового канала в пояснично-крестцовом отделе, недоразвитие копчика, крестца, подтвердить наличие или отсутствие спинномозговых грыж и различных деформаций).
- Микционная и обычная уретроцистография (позволяет определить смещение мочевого пузыря, сужение или расширение уретры, ложные дивертикулы, пузырно-мочеточниково-лоханочные рефлюксы и др. нарушения).
- Экскреторная урография (дает возможность заметить изменение размера чашечно-лоханочной системы, оценить деятельность почек).
- Восходящая пиелография (к ней прибегают редко).
- Радиоизотопная ренография (оценка состояния и функционирования почек).
Также проводят ультразвуковое сканирование, различные уродинамические исследования (цистометрия, урофлоуметрия, сфинктерометрия, профилометрия).
Нейрогенный мочевой пузырь, причины которого, несмотря на проведенные исследования, остались неизвестными, называют идиопатическим.
Лечение нейрогенного мочевого пузыря
После постановки диагноза «нейрогенный мочевой пузырь» невролог и уролог проводят лечение одновременно. Терапия зависит от уровня нарушений, наличия осложнений, фоновых заболеваний, а также продолжительности дисфункции и результатов предыдущего лечения.
Заболевание предусматривает медикаментозную, немедикаментозную терапию, хирургическое вмешательство. Начинается лечение с самых щадящих методов.
Если говорить о типах дисфункции, то гиперактивный вариант лечится лучше. Обычно помогают лекарственные препараты, снимающие напряжение мышц мочевого пузыря, улучшающие местное кровообращение. Чаще всего назначают трициклические антидепрессанты (например, мелипрамин), различные альфа-адреноблокаторы, нифедипин в качестве антагониста кальция и антихолинергические препараты («Пропантелин», «Бускопан», «Оксибутинин»).
К немедикаментозным способам лечения относят ЛФК для тренировки тазовых мышц, стабилизацию питьевого режима и распорядка дня, физиотерапию, психотерапевтические методы.
Гипоактивный тип дисфункции сопряжен с риском возникновения различных инфекций. При его лечении требуется регулярно принудительно опорожнять мочевой пузырь, иногда прибегают к катетеризации. Среди лекарственных препаратов эффективны различные холиномиметики, улучшающие моторику мочевого пузыря, уменьшая объем остаточной мочи. Бывают необходимы альфа-симпатомиметики, альфа-адреноблокаторы. Обязательным является прием антибактериальных препаратов.
При гипотонии нейрогенного мочевого пузыря нередко приходится применять хирургическое вмешательство. К примеру, проводят трансуретральную воронкообразную резекцию шейки мочевого пузыря, которая даст возможность избавляться от содержимого мочевого пузыря, нажимая на него. В случае гиперактивного нейрогенного мочевого пузыря осуществляют надрез наружного сфинктера, благодаря этому уменьшается напор, а со временем корректируется функция детрузора.
При этом синдроме также хирургическим методом увеличивают мочевой пузырь, применяя пластику тканей, устраняют пузырно-мочеточниковый рефлюкс, устанавливают цистостомический дренаж, обеспечивающий опорожнение мочевого пузыря.
Для профилактики возникновения синдрома специалисты рекомендуют следить за частотой мочеиспусканий, частотой позывов, интенсивностью струи при мочеиспускании. При малейших нарушениях, а также появлении ощущения, что мочевой пузырь опустошается не полностью, необходимо записаться на прием к урологу и невропатологу. Такие мероприятия помогут выявить развитие синдрома на ранней стадии, избежать оперативного вмешательства.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
Источник
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.

Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения – основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря – это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры – это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций – у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Proe Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры – центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи – с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи – с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата – ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением – расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5-2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора – к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3-8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва
Источник
