Затрудненное мочеиспускание при лучевой терапии
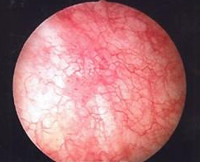
Лучевой цистит – это реакция тканей мочевого пузыря на ионизирующее облучение, проводимое в рамках лечения злокачественных опухолей малого таза. Симптомы зависят от полученной лучевой нагрузки, варьируются от незначительного дискомфорта при мочеиспускании, частых позывов и микрогематурии до выраженных болей, появления рецидивирующего кровотечения, угрожающего жизни. Диагноз подтверждают с помощью общего анализа мочи, цистоскопии. Лечение пострадиационного цистита определяется степенью выраженности поражения, может быть консервативным или оперативным с выполнением цистэктомии, решением вопроса с отведением мочи.
Общие сведения
Лучевой цистит регистрируют у 5-21% пациентов как осложнение лучевой терапии. Наиболее часто симптомы появляются после лечения рака мочевого пузыря (18%), простаты (14%), шейки матки (5%). Патология развивается в среднем через 32 недели после лечения, у мужчин чаще, чем у женщин (2,8:1). Конформная лучевая терапия, брахитерапия сопряжены с меньшей вероятностью возникновения пострадиационного цистита по сравнению с обычной. Но даже при таком лечении случайное облучение близлежащих тканей неизбежно из-за проникновения новообразования в окружающие органы или из-за близости рака к соседним структурам таза.

Лучевой цистит
Причины
Во время лучевой терапии происходит передача энергии ионизирующего излучения молекулам опухолевых клеток и тканям соседних органов, в частности – мочевому пузырю, прямой кишке. В результате альтерации нарушается трофика, кровоснабжение, позднее развиваются фиброзно-склерозирующие изменения. Пострадиационный цистит вызывает прохождение лучевой терапии по поводу опухолей:
- предстательной железы;
- влагалища, матки, ее шейки, яичников;
- мочевого пузыря;
- толстой, прямой кишки.
Определенное значение имеют локализация новообразования, стадия болезни, ежедневная и суммарная доза облучения (количество сеансов), тип лучевой терапии. К способствующим циститу факторам относятся:
- общее снижение иммунной реактивности организма на фоне злокачественного новообразования;
- выполненное оперативное вмешательство, например, трансуретральная резекция (ТУР) простаты или стенки пузыря с опухолью;
- одновременное прохождение химиотерапии;
- урологические заболевания: сопутствующий воспалительный процесс, цистолитиаз, дивертикулы;
- патологии, предрасполагающие к плохому заживлению, локальной ишемии: СПИД, сахарный диабет, болезни сосудов;
- ожирение (ИМТ >30 кг/м2);
- проведение гормонального лечения по поводу рака простаты;
- хроническая никотиновая интоксикация (≥1 пачки в день).
Патогенез
Радиация взаимодействует с внутриклеточной жидкостью, в результате высвобождаются свободные радикалы, нарушающие синтез ДНК, что приводит к гибели клеток. На фоне терапии повреждаются мембраны как раковых, так и здоровых клеток, изменения затрагивают сосуды. Субэндотелиальная пролиферация, отек постепенно истощают кровоснабжение облученной зоны. Неоваскуляризация, неадекватная регенерация провоцируют формирование хрупких поверхностных сосудов, ответственных за макрогематурию при геморрагическом цистите.
Отложение коллагена запускает процессы рубцевания, способствует дальнейшей облитерации кровеносных сосудов, вследствие чего развивается гипоксия, некроз. В мочевом пузыре на фоне ишемии слизистой оболочки повреждается уротелий, что вызывает подслизистый фиброз, поскольку субэпителиальные ткани подвергаются едкому воздействию мочи. Образование язв, поражение нервов, пострадиационный фиброз обеспечивают появление развернутой клинической симптоматики.
Классификация
Лучевой цистит может быть ранним, возникающим в течение 4 недель или 6-12 месяцев после терапии, и поздним, с появлением симптомов спустя год или позже. Выделяют острое и хроническое течение пострадиационного воспаления. Специалисты в сфере онкоурологии используют в работе специальную шкалу для оценки степени выраженности изменений мочевого пузыря, подвергшегося лучевому воздействию:
- 1 степень подразумевает незначительную эпителиальную атрофию и расширение сосудов, обнаружение единичных эритроцитов в моче. Клинические проявления чаще отсутствуют.
- 2 степень характеризуется обнаружением множественных телеангиэктазий, эпизодами макрогематурии. Мочеиспускание учащено, появляются жалобы на недержание урины.
- 3 степень представлена видоизменением сосудов по всей поверхности, формированием микроциста (уменьшением емкости органа), стойким недержанием мочи, изнурительными позывами на мочевыделение до 40 эпизодов в сутки, включая ноктурию, рецидивирующей макрогематурией.
- 4 степень при цистоскопии обнаруживаются участки некротизации, признаки тотального геморрагического цистита с участками петехий, емкость пузыря при тугом наполнении менее 100 мл, отмечается полная утрата контроля над мочевыделением, требующая вспомогательных мер (катетеризации или цистэктомии). В моче постоянно присутствует кровь, белок, слущенный эпителий.
- 5 степень наиболее неблагоприятна в прогностическом плане, гематурия приводит к развитию угрожающей жизни анемии, формированию свищей. Определяется максимально выраженный болевой синдром, высокий риск летального исхода.
Симптомы лучевого цистита
Сразу или через несколько недель после одномоментного получения значительной дозы радиации развивается острый воспалительный процесс. Как правило, ранний цистит является самоограниченным, симптомы аналогичны острому инфекционному воспалению, включают рези при учащенном мочеиспускании и после, боли внизу живота, ургентные позывы на мочевыделение. Может присутствовать кровь в моче, но более типична микрогематурия. Отмечается хороший ответ на терапию.
Лучевой цистит, возникший спустя несколько месяцев либо лет после лечения, может проявляться постоянной дизурией, сильной болью, позывами к мочеиспусканию через каждые 10-15 минут из-за формирования микроциста, выделением урины с кровью, стойкой инконтиненцией. Макрогематурия приобретает рецидивирующий характер, обнаруживается значительная кровопотеря. Повышение температуры свидетельствует о вторичном бактериальном инфицировании.
Осложнения
Лучевой цистит осложняется присоединением инфекции с развитием бактериального воспалительного процесса в почках (пиелонефрит в 20%), прогрессирующим уменьшением емкости или рубцовым сморщиванием органа и неоплазией (менее 2%), образованием свища (2%), контрактуры шейки (3-5%). При выраженном пострадиационном воспалении возникает некупируемый хронический болевой синдром, значительно ухудшающий качество жизни.
Кровотечению из видоизмененных сосудов (геморрагический цистит в 3-5%) нередко сопутствует анемия, иногда частота и выраженность кровотечения настолько значительна, что требуется проведение цистэктомии, поскольку неоднократные коагуляции лишь усугубляют фиброзно-склеротический процесс. Гематурия может сопровождаться образованием сгустков, которые приводят к острой задержке мочеиспускания за счет гемотампонады уретры.
Диагностика
Прохождение лечения с использованием ионизирующего облучения с отсроченным появлением типичных жалоб – основной критерий, на основании которого врач-уролог выставляет предварительный диагноз лучевого цистита. Учитывая то, что данные симптомы могут свидетельствовать о ряде других патологических процессов, показано прохождение углубленного клинико-урологического обследования, которое включает:
- Лабораторные анализы. В ОАМ обнаруживают микро- или макрогематурию, белок, эпителий, иногда бактерии, лейкоциты. Бакпосев производят для исключения инфекции мочевыводящих путей. Цитология мочи обоснована при подозрении на рак мочевого пузыря. В результатах анализа крови обращают внимание на гемоглобин, гематокрит, уровень тромбоцитов. Коагулограмма позволяет исключить нарушения в работе свертывающей системы.
- Инструментальную диагностику. Основным исследованием является цистоскопия, которая позволяет исключить другие причины жалоб, например, камень или мочепузырную опухоль. Типичная картина – множественные телеангиэктазии на фоне отечной слизистой, на продвинутой стадии – множественные эрозии. Прочие методы визуализации (МРТ, КТ, экскреторную урографию) назначают для исключения свищей, других причин гематурии.
- Биопсию стенки пузыря. Морфологическое исследование проводят после получения неоднозначных результатов УЗИ, цистоскопии и КТ или МРТ при высокой вероятности опухолевого процесса. Перед выполнением биопсии учитывают потенциальный риск кровотечения из поверхностных сосудов в результате травматизации.
Дифференциацию осуществляют между уроцистолитиазом, распространением опухоли из малого таза в пузырь, прогрессированием рака, сопровождающегося кровотечением, болевым синдромом. КТ и МРТ становятся основными диагностическими процедурами в данной клинической ситуации.
Лечение лучевого цистита
Терапевтические мероприятия зависят от выраженности процесса, в каждом случае определяются индивидуально. Первая и вторая степени цистита после облучения требуют активной тактики только при наличии жалоб. Цистэктомия рассматривается как крайний вариант для лечения постлучевого цистита, выполняется при безуспешности консервативной терапии.
Медикаментозное лечение
Радиационно-индуцированная гематурия может быть легкой или опасной для жизни, во втором случае прибегают к реанимационным мероприятиям, переливанию компонентов крови. Перечень препаратов для лечения включает:
- антихолинергические средства;
- обезболивающие агенты;
- фибринолитики;
- лекарства, улучшающие кровообращение;
- альфа-1-адреноблокаторы.
Инстилляции в мочевой пузырь
Вливание растворов – следующий этап лечения при неэффективности пероральной терапии лучевого цистита и налаженной системы орошения. Используют следующие препараты:
- Гиалуроновая кислота. Мукополисахарид, присутствующий в соединительной и эпителиальной тканях, ингибирует образование иммунных комплексов, нейтрализует функции нейтрофилов при регуляции пролиферации фибробластов, эндотелиальных клеток. Аналогичным действием обладает хондроитин-сульфат.
- Аминокапроновая кислота. Стабилизирует процесс свертывания крови путем фибринолиза.
- Формалин. 1% раствор является тканевым фиксатором, который денатурирует поверхностный слой уротелия, обеспечивая гемостаз. Лечение сопровождается сильной болью, что требует назначения анальгетиков. Высок риск побочных эффектов.
- Соли алюминия. 1% сульфат алюминия-аммония или сульфат алюминия-калия вызывают осаждение белка на поверхности клеток и в интерстициальных пространствах, что позволяет прекратить кровоточивость.
- Плацентарный экстракт. Эффективен в эпителизации эрозий, язв.
Хирургическое лечение
Если консервативная терапия и внутрипузырные инстилляции не могут остановить кровотечение, прибегают к различным эндоскопическим или чрескожным вмешательствам. Цистоскопия с фульгурацией проблемных участков, эвакуация кровяного сгустка, выполнение электрокоагуляции являются разумными шагами в дальнейшей тактике. Виды вмешательств при лучевом цистите:
- Введение ботулинического токсина А. Препарат вводится в стенку мочевого пузыря при отсутствии эффекта от антихолинергических средств. Лечение направлено на увеличение емкости пузыря, снижение частоты мочеиспускания, купирование ургентных позывов.
- Наложение чрескожного нефростомического дренажа. Отведение мочи из ЧЛС почек способствует регенерации уротелия нижних отделов мочевого тракта. Через 3-6 месяцев восстанавливают анатомически правильный отток урины.
- Эндоскопическая склеротерапия. Введение склерозанта в кровоточащие области эффективно не в 100% случаев, но у большинства пациентов с трудноизлечимым геморрагическим циститом обеспечивает снижение выраженности симптоматики, гемостаз.
- Эмболизация сосудов. Помогает остановить кровотечение при рефрактерном пострадиационном геморрагическом цистите.
- Паллиативная цистэктомия. Органоуносящая операция показана при рецидивирующей гематурии при безуспешности всех видов лечения, формировании свища, микроцисте (объем менее 200 мл) с изнуряющими позывами на мочеиспускание, стойком болевом синдроме. Урину отводят путем создания кондуита толстой кишки или выполнения двусторонней транскутанеостомии.
Физиотерапия
Гипербарическая кислородная терапия (оксигенация) способствует нормализации ангиогенеза, мобилизации стволовых клеток, остановке кровотечения за счет активации процессов фибринолиза, разрешению ишемии. Используется как дополнительный способ лечения лучевого цистита. Проведение оксигенобаротерапии не имеет каких-либо неблагоприятных последствий.
Прогноз и профилактика
Лучевой цистит, развившийся через 4-6 недель от начала сеансов ЛТ, имеет более благоприятный прогноз. Улучшение наступает примерно через 1,5 месяца, но у 5-20% процесс переходит в стойкую форму с рецидивирующими клиническими проявлениями через несколько месяцев или даже 10-20 лет. Хронические формы менее благоприятны.
Профилактика подразумевает выбор типа лучевой терапии с максимальным воздействием на опухоль, но не на соседние ткани, выполнение инстилляций на основе гиалуроновой кислоты с превентивной целью, прием растительных диуретиков. Исследования показали уменьшение симптомов цистита при использовании добавок, содержащих клюквенный экстракт.
Источник
Комментарии
Опубликовано в журнале:
«Экспериментальная и клиническая урология», 2010, №3, с. 70-75
А.В. Сивков, В.Н. Ощепков, Н.Г. Кешишев, О.В. Шкабко
НИИ урологии Минздравсоцразвития РФ, Москва
α1-Blockers Efficiency Evaluation in Patients with Prostate Cancer after Radiation Treatment
A.V. Sivkov, , V.N. Oshhepkov, N.G. Keshishev, O.V. Shkabko
Most frequent prostate cancer radiation therapy complications are radiation, prostatitis cystitis and proctitis, with dysuria of different degree of manifestating. It can be also complicated by infravesical obstruction. α1-Blockers are used for nonsurgical treatment of dysuria and infravesical obstruction. The purpose of our clinical research was to evaluate efficiency of neoadjuvant and adjuvant therapy with α1-blockers in patients with prostate cancer underwent extracorporal radiation treatment or brachytherapy.
80 patients took part in research, randomly divided into 2 groups. First group took α1-blocker Tamsulosin (Tulosin, “Aegis”) 0.4 mg per day once as a neoadjuvant therapy for 3 months before radiation therapy, for 3 months during treatment and for 3 months after the treatment. Control group took placebo in the same scheme. Clinic evaluation was made before α1-blockers treatment(V0), directly before radiation treatment(V2), and 3 months after the treatment in a period of radiation reactions(V3).
Neoadjuvant therapy led to significant IPSS score decrease in both groups, Qmax increase and residual volume decrease.
Adjuvant therapy with α1-blockers in both extracorporal and interstitial radiation therapy led to significant improvement in urodynamics, IPSS score decrease, Qmax increase, residual volume decrease and quality of life improvement.
Analysis made due to this research shows that using α1-blockers (Tulosin) in patients undergoing radiation therapy significantly improve symptoms and voiding disorders.
Из побочных эффектов и осложнений лучевой терапии рака предстательной железы (РПЖ) наиболее частыми являются лучевые реакции: простатит, цистит, уретрит и проктит. Осложнения со стороны мочевых путей встречаются в 80% случаев после лучевой терапии и клинически проявляются в виде дизурии различной степени выраженности и длительности, в среднем до 1 года [1].
Ситуация может также осложняться инфравезикальной обструкцией (ИВО), которая, по данным литературы, встречается более чем у 75% пациентов, страдающих РПЖ [2]. Развитие лучевых реакций при наличии признаков ИВО отягощает течение заболевания. Нередким осложнением лучевой терапии РПЖ является острая задержка мочеиспускания, которая, наблюдается от 2 до 34% случаев [3, 4]. В первую очередь, возникновение задержки мочеиспускания и дизурии обусловлено отеком предстательной железы в результате неспецифического воспаления у подавляющего большинства пациентов, перенесших лучевую терапию [5]. В значительной степени это характерно для брахитерапии, причем выраженность дизурии коррелирует с лучевой нагрузкой в области простатического отдела уретры. Особенно важно отметить усиление ИВО после брахитерапии, что связанно с имплантацией большого числа источников лучевой энергии в предстательную железу [6].
Проблема профилактики и лечения ИВО у пациентов перенесших лучевую терапию РПЖ до настоящего момента не решена. В качестве оперативного лечения чаще всего используют трансуретральную резекцию предстательной железы, которая в 10% случаев осложняется недержанием мочи [7, 8]. Для нехирургического лечения ИВО и дизурии, наиболее широко применяются препараты группы α1-адреноблокаторов (α1-АБ). Назначение вспомогательной терапии α1-АБ больным получающим лучевое лечение с целью профилактики дизурии, стало уже рутинной практикой, хотя оценка эффективности метода не проводилась [9].
Поэтому, целью предпринятого нами клинического исследования явилось изучение эффективности неоадъювантной и адъювантной терапии α1-АБ у больных РПЖ, получающих лучевое лечение в виде дистанционной лучевой терапии и брахитерапии.
Термины, «адъювантная» и «неоадъювантная» терапия широко применяются в онкологии для обозначения лечения противоопухолевыми средствами с профилактической целью после или до хирургического удаления или радиотерапии первичной опухоли, когда высока вероятность рецидива ее развития из-за имеющихся в организме человека микрометастазов. Однако, более широкое толкование этих терминов, происходящих от латинского «adjuvo» (помогать, поддерживать, содействовать, способствовать, благоприятствовать, усиливать, увеличивать, быть пригодным, полезным и т.п.), допускают их использование для характеристики вспомогательного метода терапии, предпринятого для предотвращения осложнений в определенные сроки относительно основного лечения. В настоящей работе указанные термины использованы нами касательно α1-АБ именно в этом значении.
Материалы и Методы
Всего в исследование было включено 80 больных РПЖ, рандомизированных на две группы в соотношении 1:1. Первая группа получала α1-АБ тамсулозин (Тулозин, «Эгис») в дозе 0,4 мг/сут. однократно в виде неоадъювантной терапии в течение 3-х месяцев и адъювантной терапии в период прохождения лучевого лечения и еще 3х месяцев после его завершения. Другая группа, принимавшая плацебо по аналогичной схеме, составила группу сравнения. Оценку клинических показателей осуществляли до начала применения α1-АБ (V0), непосредственно перед началом лучевой терапии (V1) и через 3 мес. после нее – т.е. в момент протекания лучевых реакций (V2).
В качестве лучевого лечения 29 больным была проведена дистанционная лучевая терапия (ДЛТ) по радикальной программе в дозе 65-72 Гр. Из них 19 пациентов вошли в контрольную группу. Оставшимся больным была выполнена интерстициальная лучевая терапия (брахитерапия) с перманентной имплантацией источников 125I в дозе 150-160 Гр. Из них 30 человек были включены в основную группу, а 21 – в контрольную.
Средний возраст мужчин составил 70,9 лет (SD = 8,58): в основной группе – 68,1 (SD = 8,63), а в контрольной – 73,8 лет (SD = 7,59). Стадия РПЖ была установлена как T1-3N0-XM0. Подавляющая доля больных (76%) в группах дистанционной и интерстициальной лучевой терапии имели стадию заболевания T2.
Все пациенты проходили стандартизированное обследование перед лечением, включавшее оценку симптомов по шкале IPSS/QoL и урофлоуметрию с определением объема остаточной мочи. Из участия в исследовании исключали мужчин, получавших препараты, влияющие на функцию мочеиспускания и пациенты, индекс Карновского которых был более 3 баллов.
Все пациенты обеих групп получали неоадъювантную и адъювантную гормональную терапию аналогами ЛГРГ на протяжении всего исследования.
Результаты
Неоадъювантное лечение
До начала лечения все наблюдаемые пациенты предъявляли характерные жалобы на расстройство мочеиспускания той или иной степени. Исходные значения изучаемых клинических параметров в основной и контрольной группах статистически не различались. Неоадъювантная терапия α1-АБ привела к достоверному уменьшению выраженности симптомов по шкале IPSS в обеих группах (р Подобная тенденция отмечена и в отношении объективных параметров мочеиспускания. Как в основной, так и контрольной группах был зарегистрирован рост максимальной скорости мочеиспускания (Qmax) и уменьшение объема остаточной мочи (Vres). Прирост Qmax у пациентов получавших Тулозин составил 14% (+1,9 мл/с.), в то время как в контрольной группе – 10% (+0,6 мл/с.). Изменения носили статистически значимый характер: р Рисунок 1. Эффективность неоадъювантной терапии α1-АБ (%)
Адъювантное лечение
В различные сроки после проведения лучевой терапии все пациенты отметили появление симптомов раздражения и/или обструкции. В группе получивших курс ДЛТ, появление дизурии было зарегистрировано через 2-5 недель. После брахитерапии появление симптомов лучевых реакций наблюдали в сроки от 3 до 8 недель после имплантации. Важно отметить, что прием α1-АБ никак не повлиял на время появления этих симптомов.
Среди пациентов принимавших плацебо, зарегистрировано 6 случаев острой задержки мочеиспускания: 3 – в группе ДЛТ (10%) и 3 – после брахитерапии (6%). Среди участников исследования получавших Тулозин, случаев острой задержки мочеиспускания не было.
В целом, независимо от характера приложения лучевой энергии, у больных, получавших α1-АБ, наблюдалась общая положительная динамика: после периода ухудшения – быстрое симптоматическое улучшение, по крайней мере, до исходного уровня. В то же время, в группе плацебо отмечалась стойкая прогрессирующая дизурия.
Дистанционная лучевая терапия. Среди пациентов, перенесших ДЛТ и адъювантную терапию Тулозином, отмечено достоверное (р = 0,006), практически двукратное, снижение показателя шкалы IPSS на 44% по сравнению с исходным значением, в то время как в группе контроля наблюдался достоверный (p В группе ДЛТ, получавшей адъювантную терапию Тулозином, было зарегистрировано незначительное и статистически недостоверное (р = 0,896) изменение пиковой скорости мочеиспускания Qmax, составившее 1% (-0,2 мл/с.), в то время как в контрольной группе это ухудшение носило достоверный характер (p Уменьшение объема остаточной мочи Vres у пациентов, перенесших ДЛТ и принимавших Тулозин, составило 39% (-14,1 мл), что носило достоверный характер (р = 0,012). В отличие от проградиентного улучшения на фоне неоадъювантной и адъювантной терапии α1-АБ в основной группе, среди пациентов получавших плацебо проведение лучевой терапии привело к значительному приросту объема остаточной мочи на 96% или на 21,2 мл (рисунок 2).
Рисунок 2. Динамика IPSS, Qmax и Vres при адъювантной терапии α1-АБ по сравнению с уровнем до ДЛТ (%)
Интерстициальная лучевая терапия. Среди пациентов, перенесших брахитерапию, в группе активного лечения был отмечен недостоверный (р = 0,146) и относительно незначительный прирост на 14% выраженности симптомов по шкале IPSS (с 3,1 до 4,2 баллов). Тем не менее, этот результат на 56% достоверно (p Как и в группе ДЛТ, при анализе объективных параметров мочеиспускания было отмечено их достоверное ухудшение после брахитерапии. Так, снижение максимальной скорости мочеиспускания носило достоверный характер и в основной и в контрольной группах (p Увеличение объема остаточной мочи у пациентов, перенесших брахитерапию и получавших Тулозин, было и незначительным (1,7 мл или 21%) и недостоверным (р = 0,665). Одновременно в контрольной группе зарегистрированный прирост носил достоверный характер (р = 0,011) и составил 99% (+12,9 мл). По изменению этого параметра между группами установлено достоверное (р = 0,003) различие (рисунок 3).
Рисунок 3. Динамика IPSS, Qmax и Vres при адъювантной терапии α1-АБ по сравнению с уровнем до брахитерапии (%)
Положительная динамика симптомов и показателей мочеиспускания не могла не сказаться на улучшении качества жизни (QoL) пациентов, принимавших Тулозин. Если до начала лечения в основной и контрольный группах показатель QoL был примерно одинаков (3,7 и 3,6 баллов соответственно), то после курса неоадъювантной терапии у больных получавших α1-АБ наметились более выраженные и достоверные позитивные сдвиги, по сравнению с принимавшими плацебо: -38% против -19% (до 2,3 и 2,9 баллов).
Лучевая терапия привела к ухудшению качества жизни у пациентов обеих групп. Однако, у больных получавших Тулозин, отрицательные последствия носили менее выраженный характер, чем в контрольной группе. Так, показатель QoL, у получавших α1-АБ, увеличился на 26% – с 2,3 до 2,9 баллов, а у пациентов группы сравнения – с 2,9 до 4,3 баллов или на 48%. Характерно, что это увеличение у пациентов основной группы не достигло исходного значения QoL и было статистически незначимым, тогда как в контрольной группе – оказалось достоверным и превысило инициальный показатель качества жизни (рисунок 4).
Рисунок 4. Динамика QoL на этапах неоадъювантной и адъювантной терапии (в баллах)
Обсуждение
При анализе PubMed нами было найдено всего несколько публикаций о применении α1-АБ при лучевой терапии РПЖ, несмотря на то, что эта группа препаратов широко назначается в клинической практике. Показательно, что подавляющее большинство работ касаются исключительно тамсулозина.
Еще в 1999 г. группа авторов из Бостона (США) доложила результаты пилотного исследования тамсулозина с целью купирования лучевого уретрита у 26 пациентов, перенесших конформную ДЛТ РПЖ. Клинический ответ составил 60-62%, а достаточный контроль симптомов был достигнут у 77% пациентов [11].
Коллектив исследователей из Виржинии (США) в 2002 г. опубликовал материалы сравнения профилактического применения α1-АБ и их назначения по показаниям у больных перенесших 103Pd или 125I брахитерапию РПЖ. Из 234 наблюдавшихся пациентов, 142 – начали прием препарата до операции (в среднем, за 1 мес.) и продолжали его в течение периода, потребовавшегося для возврата симптомов (IPSS) к исходному уровню. Остальные 92 мужчины или не получали α1-АБ вовсе, или лечение им было назначено после появления симптомов нарушенного мочеиспускания. Ряд пациентов получали неоадъювантную гормонотерапию. Авторы показали, что у больных обеих групп выраженность симптомов (IPSS) после имплантации резко возрастала, достигая максимума через 1 мес.
При этом, лица профилактически принимавшие α1-АБ возвращались к исходному уровню симптомов, в среднем, через 4 мес. после операции (медиана – 3 мес.), тогда как не получавшие такого лечения – только через 10 мес. (медиана – 6 мес.). Случаев задержки мочеиспускания и возникновения необходимости в оперативном лечении у пациентов группы α1-АБ не было [9].
В 2005 г. группа канадских специалистов при наблюдении за 86 пациентами после брахитерапии и 76 – после конформной ДЛТ (СОД 75,6 Гр) продемонстрировала, что, как и в нашем исследовании, состояние больных после брахитерапии характеризовалось более выраженной симптоматикой со стороны нижних мочевых путей. При этом, для коррекции симптомов после брахитерапии, пациенты получали тамсулозин в течение 6 мес. (78%), одного года (55%) и 2-х лет – 27%. Задержка мочеиспускания, развившаяся в первые полгода после интерстициального облучения и потребовавшая интермиттирующей самокатетеризации, отмечена у 5% больных [12].
В этом же году другая группа исследователей из Кливленда (США) представила данные двойного слепого плацебо-контролируемого исследования профилактического применения тамсулозина (0,8 мг/ сут.) у 126 больных РПЖ, перенесших брахитерапию с имплантацией источников 125I. После рандомизации соотношение пациентов в группах α1-АБ и плацебо составило 58:60. Лечение начинали за 4 дня до операции и продолжали в течение 60 дней после нее. Оценку симптомов по шкале IPSS проводили до начала приема препарата и еженедельно до 8 недель наблюдения. Исходные показатели в группах статистически не отличались. Задержка мочеиспускания развилась у 17% пациентов группы плацебо и 10% принимавших тамсулозин (p = 0,3161), причем у подавляющего большинства (88%) пациентов она возникла в течение первых 2-х недель после имплантации. Соответственно, выраженные симптомы со стороны нижних мочевых путей также наблюдались в первые 2 недели после брахитерапии. На 5-й неделе лечения авторами был продемонстрирован симптоматический эффект тамсулозина, достоверно (p = 0,03) превосходящий плацебо [13].
В отличие от приведенных выше исследований, в настоящей работе изучалась как неоадъювантное, так и адъювантное применение α1-АБ против плацебо в группах пациентов подлежащих ДЛТ и брахитерапии 125I. Нам удалось показать, что в неоадъювантном режиме тамсулозин (Тулозин) достоверно превосходил плацебо по влиянию на симптомы и показатели мочеиспускания у больных РПЖ. При адъювантном применении, и в случае дистанционной и интерстициальной терапии, несмотря на различия в выраженности симптомов после лучевого воздействия, назначение α1-АБ приводило к более выраженной достоверной позитивной динамике основных симптомов и параметров мочеиспускания.
Показательно, что в этом исследовании у пациентов, получавших Тулозин в течение 3-х месяцев до облучения, задержек мочеиспускания не было, тогда, как в контрольной группе они имели место у 10% после ДЛТ и 6% после брахитерапии. В этом наши данные аналогичны результатам Merrick G.S. et. al. (2002). Более высокая частота задержек мочеиспускания, наблюдавшаяся в работе Elshaikh M.A. et al. (2005), вероятно, связана с тем, что в нем прием α1-АБ пациенты начинали лишь за 4 дня до облучения, тогда как в нашем исследовании, они проходили 3х месячный курс неоадъювантной терапии и, кроме того, находились в состоянии андрогенной депривации.
Заключение
- Включение в схему неоадъювантного лечения, проводимого пациентам РПЖ перед лучевой терапией, α1-АБ (в нашем исследовании Тулозина), наряду с андрогенной депривацией, позволяет существенно уменьшить выраженность симптомов и нарушений мочеиспускания у этой категории больных.
- Неоадъювантный и адъювантный прием α1-АБ позволяет существенно снизить риск возникновения острой задержки мочеиспускания после лучевого лечения.
- Адъювантная терапия α1-АБ способствует уменьшению дизурии, связанной с операционной травмой и возникновением лучевых реакций, а также сокращает время возврата к исходному уровню симптомов после облучения.
- Неоадъювантное и адъювантное назначение α1-АБ (возможно в сочетании с гормонотерапией) может расширить показания к выполнению лучевой терапии пациентам с умеренными проявлениями инфравезикальной обструкции, которая относится к относительным противопоказаниям и, на сегодняшний день, является наиболее частой причиной отказа от брахитерапии РПЖ, при наличии прочих показаний.
Препарат Тулозин (тамсулозин) в настоящем исследовании показал себя эффективным средством коррекции симптомов и нарушений мочеиспускания у пациентов, проходящих дистанционную или интерстициальную лучевую терапию РПЖ.
Ключевые слова: рак предстательной железы, лучевая терапия, α1-адреноблокаторы, тамсулозин, Тулозин.
ЛИТЕРАТУРА
1. Kleinberg L., Knisely J.P., Heitmiller R., Zahurak M., Salem R., Burtness B., Heath E.I., Forastiere A.A. Mature survival results with preoperative cisplatin, protracted infusion 5-fuorouracil, and 44-Gy radiotherapy for esophageal cancer//Int. J. Radiat. Oncol. Biol. Phys. 2003. Vol. 56. № 2. P. 328-334.
2. Hindley R.G., Mostafd A.H., Brierly R.D., Harrison N.W., Tomas P.J., Fletcher M.S. Te 2-year symptomatic and urodynamic results of a prospective randomized trial of interstitial radiofrequency therapy vs transurethral resection of the prostate//BJU Int. 2001. Vol. 88. № 3. P. 217-220.
3. Blasko J.C., Ragde H., Grimm P.D. Transperineal ultrasound-guided implantation of the prostate: morbidity and complications // Scand. J. Urol Nephrol. 1991. Vol. 137. Suppl. P. 113-118.
4. Locke J., Ellis W. , Wallner K., Cavanagh W. , Blasko J. Risk factors for acute urinary retention requiring temporary intermittent catheterization afer prostate brachytherapy: a prospective study//Int J Radiat Oncol Biol Phys. 2002. Vol. 52, № 3. P.712-719.
5. Kucway R., Vicini F., Huang R. Prostate volume reduction with androgen deprivation therapy before interstitial brachytherapy //J. Urol. 2002. Vol. 167. № 6. P.2443-2447.
6. Desai J., Stock R.G., Stone N.N., Iannuzzi C., DeWyngaert J.K. Acute urinary morbidity following I-125 interstitial implantation of the prostate gland//Ra-diat. Oncol. Investig. 1998. Vol. 6. № 3. P.135-141.
7. Kollmeier M.A., Stock R.G., Cesaretti J., Stone N.N. Urinary morbidity and incontinence following transurethral resection of the prostate afer brachytherapy // J. Urol. 2005. Vol. 173. № 3. P. 808-812.
8. Kleinberg L., Wallner K., Roy J., Zelefsky M., Arterbery V.E., Fuks Z., Harrison L. Treatment-related symptoms during the frst year following trans-perineal 125I prostate implantation // Int. J. Radiat. Oncol. Biol. Phys. 1994. Vol. 28. № 4. P. 985-990.
9. Merrick G.S., Butler W.M., Wallner K.E., Lief J.H., Galbreath R.W. Prophylactic versus therapeutic alpha-blockers afer permanent prostate brachytherapy // Urology. 2002. Vol. 60. № 4. P.650-655.
10. Whittington R., Broderick G.A., Arger P. , Malkowicz S.B., Epperson R.D., Arjomandy B., Kassaee A. Te efect of androgen deprivation on the early changes in prostate volume following transperineal ultrasound guided interstitial therapy for localized carcinoma of the prostate // Int. J. Radiat. Oncol. Biol. Phys. 1999. Vol. 44. № 5. P.1107-1110.
11. Prosnitz R.G., Schneider L., Manola J., Rocha S., Lofredo M., Lopes L., D’Amico A.V. Tamsulosin palliates radiation-induced urethritis in patients with prostate cancer: results of a pilot study. //Int. J. Radiat. Oncol. Biol. Phys. 1999. Vol. 45. № 3. P. 563-566.
12. Tsui G., Gillan C., Pond G., Catton C., Crook J. Posttreatment complications of early-stage prostate cancer patients: brachytherapy versus three-dimensional conformal radiation therapy // Cancer J. 2005. Vol. 11. № 2. P. 122-132.
13. Elshaikh M.A., Ulchaker J.C., Reddy C.A, Angermeier K.W., Klein E.A., Che-hade N., Altman A., Ciezki J.P. Prophylactic tamsulosin (Flomax) in patients undergoing prostate 125I brachytherapy for prostate carcinoma: fnal report of a double-blind placebo-controlled randomized study //Int. J. Radiat. Oncol. Biol. Phys. 2005. Vol. 62, N 1. P. 164-169.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
