Вызванные потенциалы при нарушениях мочеиспускания

Что мы знаем про функциональную диагностику?
Есть расхожее выражение, что наука не стоит на месте. Несомненно, в полной мере это относится и к медицине.
Развитие средств массовой информации, и в особенности интернета, позволяет при необходимости получить огромное количество информации по интересующему вопросу в кратчайшие сроки. Все наверняка знают, или по крайней мере слышали, про МРТ (магнитно-резонансную томографию) или КТ (мультиспиральную компьютерную томографию), про УЗИ, рентгенографию, гастроскопию. Но что Вы слышали про так называемую функциональную диагностику?
Все перечисленные выше методики – УЗИ, МРТ, МСКТ, рентгенография – это методы визуализации. То есть различные способы заглянуть внутрь пациента, не прибегая к хирургическому вмешательству. Результатом этих исследований будет являться картинка, изображение, в том или ином роде, какой-либо части Вашего организма.
А ведь такая картинка далеко не всегда может показать, как функционирует орган в определенный момент времени.
К примеру. МРТ головного мозга – это набор изображений (срезов) вещества головного мозга. На этом изображении можно увидеть изменения, например, очаги инсульта или опухоль. Однако, картинка остается картинкой. Мы видим мозг, но его изображению не можем сказать, как именно функционируют отдельные его части. Особенно актуально это становится в случае, когда клиника поражения головного мозга есть, а изменений на «фотографии» мозга – нет.
Тоже будет касаться и других методов, и других органов.
Так что такое функциональная диагностика? Ответ становится очевиден – это исследования, позволяющие оценить функционирование различных органов и систем.
С одним из таких методов Вы несомненно знакомы лично – это электрокардиография (ЭКГ). При помощи ЭКГ можно оценить электрическую активность сердца, которая будет изменяться при различных патологических процессах. А еще есть суточное мониторирование ЭКГ (его так же называют холтеровским мониторированием). Ведь ЭКГ записывается в течение нескольких секунд и если заболевание проявляет себя время от времени, хотя бы и только во сне, то зафиксировать изменения на обычной ЭКГ нет никакой вероятности. Запись ЭКГ в течение суток во много раз увеличивает шансы на успешный поиск патологии.
Но вернемся к нервной системе. Тут тоже есть метод, про который Вы наверняка слышали, а если получали водительские права или лицензию на оружие, то и испытали когда-то на себе. Электроэнцефалография (ЭЭГ). Регистрация электрической активности головного мозга. Наиболее частая причина назначения – исключение или подтверждение эпилепсии.
Собственно на этих двух последних строках знания о исследовании функционирования нервной системы заканчивается у подавляющего большинства пациентов и, к огромному сожалению, у многих врачей.
В течение десятилетий существуют зарекомендовавшие себя, проверенные инструментальные методы диагностики – электронейромиография и исследование вызванных потенциалов головного мозга. Для многих специалистов, не только в России, но и «на Западе», эти диагностические процедуры ассоциируются только с несколькими относительно редкими неврологическими заболеваниями. И очень зря.
Что такое вызванные потенциалы и зачем их регистрировать?
Работа любого органа связана с определенной электрической активностью.
Не углубляясь в подробности просто спрошу: Вы, как пациент, относитесь к ЭКГ или ЭЭГ как к какому-то шаманству?
Отвечу за Вас: нет.
А ведь ЭКГ и ЭЭГ – это и есть запись той самой электрической активности (сердца и мозга соответственно). Вызванные потенциалы – тоже самое и даже проще. Вы знаете, что определенные участки головного мозга отвечают за определенные функции. В затылочной области, к примеру, зрительный центр. В височных областях центры, связанные с речью и слухом. К этим центрам идут «проводящие пути» – отростки нервных клеток, которые можно представить в виде кабелей, протянутых от органов чувств (глаз, ушей, кожи и т.д.) к центрам в головном мозге. Когда эти центры активно работают – в них возрастает электрическая активность.
Регистрация вызванных потенциалов – это не что иное, как фиксация этой самой активности, возникающей в ответ на целенаправленное раздражение каких-либо рецепторов (зрительных, слуховых, чувствительных и прочих).
В итоге, полученный результат помогает оценить функциональное состояние и определенных центров в головном мозге, и состояние проводящих путей.
Все элементарно. Понятна и диагностическая ценность подобного исследования. Так почему же регистрация вызванных потенциалов мало кому назначалась и мало кто о ней хоть что-то слышал (в отличие от той же МРТ, которую проводят не только по назначению врача, но и самостоятельно по любому поводу)? Ответить Вам на этот вопрос я затрудняюсь.
Как проводится регистрация вызванных потенциалов головного мозга?
На определенные участки головы (или в области позвоночника) наклеиваются электроды – они и будут регистрировать электрическую активность соответствующих центров.
В зависимости от вида регистрируемых потенциалов, производится стимуляция.
Для системы зрения (зрительные вызванные потенциалы) используют монитор со специальной динамически изменяющейся картинкой или очки со светодиодами.
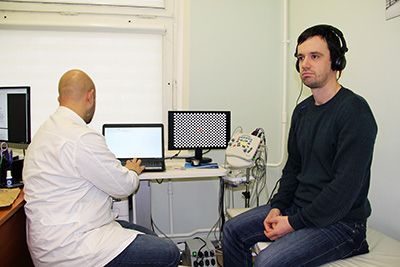
Для оценки слухового анализатора на исследуемого надевают наушники, через которые подаются звуки (в виде «щелчков») определенных параметров. Кстати, регистрацию акустических стволовых вызванных потенциалов (АСВП) часто сочетают с другим видом функциональной диагностики – аудиометрией (это объективная оценка слуха на специальной аппаратуре, которая проводится врачом-сурдологом).
Проводящие пути и мозговые центры отвечающие за чувствительность стимулируются легкими импульсами тока – ощущения несколько неприятны, но опасности ток никакой не представляет.
Есть еще много видов вызванных потенциалов. Можно оценить состояние вестибулярного аппарата (вестибулярные миогенные вызванные потенциалы), состояние памяти (когнитивные вызванные потенциалы Р300), вегетативной нервной системы (многим ведь ставился полумифический диагноз «вегето-сосудия дистония», но почему-то никто не проверял «тонус» той самой вегетатики с помощью вызванных потенциалов), определить изменения болевого порога при хронических болях и многое другое.
Само исследование занимает от нескольких минут до часа, в зависимости от типов регистрируемых потенциалов. Каких-либо дискомфортных ощущений исследования не вызывают. Разве регистрация ССВП (соматосенсорных вызванных потенциалов) проводится с помощью электрической стимуляции, что несколько неприятно. И не стоит приходить обследоваться после кропотливой укладки волос – электроды крепятся на голову с помощью специальной пасты, так что прическа будет безнадежно испорчена.
При каких заболеваниях и симптомах необходима регистрация вызванных потенциалов?
Выше уже говорилось, что это исследование нервной системы назначают крайне редко при всей его информативности. Ниже краткий список заболеваний и состояний при которых может быть рекомендована регистрация вызванных потенциалов.

- Стоимость: 3 000 руб.
- Продолжительность: 30 – 60 минут
- Госпитализация: Амбулаторно
Зрительные вызванные потенциалы (ЗВП)
- снижение зрения, слепота
- рассеянный склероз
- сахарный диабет 1 и 2 типа
- ретробульбарный неврит
- невропатия зрительного нерва
- опухоли головного мозга и сосудистые мальформации со сдавлением зрительного нерва или зрительного тракта
- повышение внутриглазного давления
- снижение зрения или слепота неясной этиологии
- травмы и сосудистые заболевания головного мозга
- энцефалит, энцефаломиелит
- и другие заболевания
- Стоимость: 3 000 руб.
- Продолжительность: 30 – 60 минут
- Госпитализация: амбулаторно или до 2-ух часов в стационаре
Акустические стволовые (слуховые) вызванные потенциалы (АСПВ)
- нарушение слуха (для проведения дифференциальной диагностики между периферическим и центральным поражением)
- нарушение речи у детей
- рассеянный склероз
- энцефалит, энцефаломиелит и их последствия
- травмы и сосудистые заболевания головного мозга и их последствия
- опухоли головного мозга
- и ряд других заболеваний
У детей регистрация АСВП может проводится, а иногда и единственно возможна, во время наркоза.

- Стоимость: 8 500 руб.
- Продолжительность: 20 – 50 минут
- Госпитализация: Амбулаторно
Соматосенсорные вызванные потенциалы (ССВП)
- нарушение чувствительности в конечностях (онемение, болезненные ощущения)
- слабость в руках и/или ногах
- нарушение потенции
- нарушение мочеиспускания
- рассеянный склероз
- энцефаломиелит, миелит и их последствия
- плекоспатии, полинейропатии
- нарушения потенции и мочеиспускания
- хронические болевые синдромы
- травмы и сосудистые заболевания спинного мозга, головного мозга и их последствия
Регистрация ССВП часто дополняется проведением игольчатой и стимуляционной электронейромиографии (ЭНМГ).
Когнитивные вызванные потенциалы (P300, MNN)
- снижение памяти
- деменция
- болезнь Альцгеймера
- болезнь Паркинсона
В отличие от предыдущих методов, исследование не может быть проведено у больных, с которыми не возможен адекватный контакт и которые не могу выполнять инструкции исследователя.
Тригеминальные вызванные потенциалы, R III ноцицептивный рефлекс, экстероцептивная супрессия жевательных мышц
- острые и хронические болевые синдромы различного происхождения
- хронические головные боли различного происхождения
- невропатия тройничного нерва, тригеминальная невралгия
Вестибулярные миогенные вызванные потенциалы (ВМВП)
- нарушения равновесия и головокружения различной этиологии
- болезнь Меньера
- сосудистые и воспалительные поражения центральной нервной системы, вестибулярного аппарата
- нарушения слуха различной этиологии
- опухоли головного мозга
Регистрация вестибулярных миогенных вызванных потенциалов часто дополняется проведение регистрации АСВП (акустических стволовых вызванных потенциалов).
Кожные симпатические вызванные потенциалы, вегетативные вызванные потенциалы (КСВП)
- полинейропатии различной этиологии
- сахарный диабет 1 и 2 типа
- дисфункция вегетативной нервной системы («вегето-сосудистая дистония»)
- хронические болевые синдромы
Как видно, список совсем не маленький. Несомненно, само подозрение на перечисленные заболевания или возникновение указанных симптомов требует самого серьезного внимания со стороны заболевшего и непременного посещения врача. Да и сам результат регистрации вызванных потенциалов требует отдельной трактовки лечащим врачом в совокупности с клинической картиной. Важно помнить, что любое обследование, так же, как и любая терапия (пусть и кажущиеся безобидными обезболивающие, например) должны быть к месту, чтобы не стать бесполезной тратой времени и денег. Собственно говоря, именно в этом и состоит работа грамотного врача.
В следующей части мы поговорим о другом относительно редком методе исследования нервной системы – о игольчатой и стимуляционной электронейромиографии (ЭНМГ).
Источник
Регистрацию вызванных потенциалов (ВП) применяют для оценки нервной проводимости по афферентным проводящим путям. При исследовании ВП оценивают прохождение импульса, возникающего в ответ на стимул, на участке от периферического нерва до коры больших полушарий, благодаря чему появляется возможность оценить состояние афферентного пути на различных уровнях нервной системы: периферическом, стволовом и корковом [1]. ВП, регистрируемые при электростимуляции периферических нервов, рассматривают как соматосенсорные (ССВП). ССВП отражают проведение афферентной волны возбуждения по путям общей чувствительности, проходящим преимущественно в задних столбах спинного мозга, далее поступающим в стволовые отделы мозга и через спиноталамический тракт – в кору. В связи с этим регистрация ССВП является важным диагностическим методом при заболеваниях спинного и головного мозга [1-3].
Диагностическая ценность результатов исследования ВП в нейроурологической практике является предметом изучения на протяжении длительного периода времени. Н. Madersbacher и соавт. [4] изучали корковые ССВП в ответ на стимуляцию большеберцового и срамного нервов, а также везикоуретрального сегмента у добровольцев и больных с симптомами нижних мочевыводящих путей (СНМП) нейрогенного происхождения. Авторы отметили отсутствие коркового потенциала при стимуляции везикоуретрального сегмента и срамного нерва, в то время как при стимуляции большеберцового нерва отклонений от нормы не выявлено. Позже эти же авторы [5] изучали корковые ВП при стимуляции везикоуретрального сегмента и срамного нерва у больных с детрузорной арефлексией, подтвержденной комплексным уродинамическим обследованием. Причинами детрузорной арефлексии были повреждения спинного мозга, грыжи межпозвонковых дисков, spina bifida с интраспинальным повреждением, полинейропатии, последствия хирургических вмешательств на органах таза (экстраспинальные повреждения). При анализе результатов исследования ВП установлено, что у больных с экстраспинальными повреждениями корковые потенциалы отсутствовали при стимуляции везикоуретрального сегмента и были зарегистрированы при стимуляции срамного нерва. У больных с интраспинальными повреждениями при стимуляции срамного нерва и везикоуретрального сегмента корковые потенциалы не зарегистрированы. Это позволило авторам предположить, что исследование ВП может использоваться в дифференциальной диагностике интра- и экстраспинальных повреждений, а также при прогнозировании результатов интравезикальной нейростимуляции в лечении больных с СНМП. Анализ процессов, происходящих в нервной системе, позволяет осуществлять лечебное воздействие (фармакологическое и/или физиотерапевтическое) на тот или иной процесс регуляции тазовых органов. S. Malaguti и соавт. [6] высказали предположение о том, что исследование ССВП позволит прогнозировать эффективность сакральной нейромодуляции. Пациентам с СНМП проводили исследование ВП при стимуляции срамного и большеберцового нервов. При сопоставлении данных исследования ВП с результатами лечения авторы установили, что у больных с положительными результатами сакральной нейромодуляции имело место укорочение латентного периода коркового потенциала при стимуляции срамного и большеберцового нервов. У больных с отрицательными результатами лечения имелось укорочение латентного периода только при стимуляции срамного нерва.
Е.Б. Мазо и соавт. [7] представили результаты изучения ССВП у 13 больных с гиперактивным мочевым пузырем, которые показали большую эффективность тибиальной нейромодуляции у пациентов с наличием коркового потенциала, чем у пациентов с отсутствием такового при стимуляции большеберцового нерва. П.Г. Шварц и соавт. [8] сообщили результаты исследования афферентации от срамных нервов у 13 пациентов с субкортикальной артериосклеротической энцефалопатией и 11 – с мультиинфарктной гипертонической энцефалопатией. При исследовании ССВП от срамных нервов были зарегистрированы ответы центрального и периферического уровней. При стимуляции срамных нервов регистрировался корковый ответ, также было отмечено увеличение латентности вызванного ответа и снижение его амплитуды, при этом периферические ответы не выделялись. У больных с мультиинфарктной гипертонической энцефалопатией было установлено уменьшение амплитуд пиков при сохранных значениях латентностей, что было обусловлено ишемическим поражением преимущественно подкоркового серого вещества. В группе больных с субкортикальной артериосклеротической энцефалопатией имело место увеличение латентностей и увеличение значений центрального времени проведения (ЦВП), что, по мнению авторов, было связано с центральной демиелинизацией сосудистого генеза. Разнородность изменений ССВП при стимуляции срамных нервов в разных клинических группах позволила предположить различные механизмы формирования фенотипически сходных уродинамических нарушений при каждой конкретной форме заболевания. В этой связи исследование ССВП при стимуляции срамных нервов наряду с уродинамическим исследованием, по мнению авторов, имеет большой потенциал при использовании на диагностическом этапе у больных с предположительно нейрогенным характером расстройств акта мочеиспускания.
Таким образом, изучение диагностических возможностей ССВП для уточнения механизмов формирования нарушений мочеиспускания и оценки эффективности лечения является актуальной и до конца не решенной проблемой нейроурологии, что явилось основанием для проведения данного исследования.
Цель исследования – изучение диагностических возможностей ССВП у больных с нейрогенной задержкой мочи для уточнения механизмов формирования нарушений мочеиспускания.
Проведена оценка диагностических возможностей исследования ССВП при стимуляции срамного и большеберцового нервов у больных с нейрогенной задержкой мочи. Исследование афферентных ССВП от срамного и большеберцового нервов проводили на приборе Viking Select (Nicolet, США) по методике Y. Choi и соавт. При стимуляции срамного нерва регистрировали корковый и периферический ответы [9]. Ветви срамного нерва находятся в непосредственной близости к поверхности кожи, что делает их доступными для нейрофизиологических исследований (ССВП, бульбокавернозный рефлекс и др.), а также для электрических (пудендальная электростимуляция) и магнитных (ритмическая магнитная стимуляция) лечебных процедур [10-13].
При стимуляции срамного нерва пластинчатые электроды размещали симметрично по обе стороны от клитора (у женщин) и на две половины дорсальной поверхности пениса поочередно, наряду с использованием кольцевых электродов (у мужчин). Проводили сравнение особенностей проведения нервных импульсов при стимуляции срамного и большеберцового нервов у пациентов с нейрогенной задержкой мочи и повреждением коркового представительства ядра Онуфровича вследствие ишемического инсульта в теменных долях (центр Ферстера-Клейста, прецентральная извилина) – 1-я группа (n=4) больных, проводящих путей на уровне грудного отдела спинного мозга вследствие спинального ишемического инсульта (2-я группа, n=10) или миелита (3-я группа, n=7). Повреждение периферического отдела срамного нерва регистрировали при исследовании 3 пациентов с нейрогенной задержкой мочи и опухолями конского хвоста (4-я группа).
Использовали не кольцевые электроды, а пластинчатые, что позволило выделять корковые ответы и определять асимметричность проведения нервных импульсов. При исследовании ССВП от срамных нервов регистрировали ответы центрального (Cz) – Р42 и периферического (LI) уровней. При стимуляции большеберцового нерва выделялись ответы на периферическом (LIII) и центральном (Cz) уровнях – P37, N45. При исследовании ССВП от срамных нервов регистрировали ответы центрального (Cz) – Р42 и периферического уровней (LI).
Статистическая обработка результатов исследования включала стандартные методы вариационной статистики с определением средней (μ) каждого оцениваемого параметра и ее отклонения (σ). Сравнение средних проводили с помощью метода наименьших квадратов с использованием критерия Стьюдента. Различия считали достоверными при р<0,05. Формирование базы данных и их статистическую обработку проводили при помощи программ Excell пакета Microsoft Office и istica 6.0.
Учитывая возможность сочетания функциональных и органических нарушений мочеиспускания (особенно в пожилом возрасте), уже на ранних этапах диагностики необходимо дифференцировать причины возникновения СНМП. Установление функциональной природы расстройств мочеиспускания является важным этапом дифференциальной диагностики неврологических заболеваний. Актуальность исследований, ведущихся в этом направлении, обусловлена частым сочетанием функциональных нарушений мочеиспускания с выявленными органическими заболеваниями нижних мочевыводящих путей (доброкачественная гиперплазия предстательной железы и др.), которые проявляются сходной симптоматикой, но требуют других подходов к лечению. Среди параклинических методов обследования, позволяющих установить функциональную природу расстройств мочеиспускания, наиболее важным является исследование афферентных ССВП со срамного нерва. ССВП позволяет регистрировать сенсорные ответы на периферическом, спинальном и церебральном уровнях (ствол мозга, кора больших полушарий) представительства срамного нерва и ядра Онуфровича.
Для подтверждения функционального характера нарушений мочеиспускания в нашей работе был использован метод исследования ССВП при стимуляции большеберцового и срамного нервов. Результаты исследования ССВП при их стимуляции у больных c нейрогенной задержкой мочи приведены в таблице.
Результаты исследования ССВП при стимуляции большеберцового и срамного нервов у больных c нейрогенной задержкой мочи Примечание. * – нормальные показатели по [9]; ** – различие достоверно по сравнению с соответствующим показателем нормы (p<0,05).
У больных с ишемическим инсультом в проекции центра Ферстера-Клейста, отвечающего за произвольное начало и окончание мочеиспускания (пирамидная система), отмечали уменьшение значений амплитуд пиков при сохранных значениях латентностей, в то время как в 3-й группе имело место удлинение латентностей и, следовательно, увеличение значений ЦВП. Это можно объяснить ишемическим поражением преимущественно коркового серого вещества у больных с ишемическим инсультом (как и законом Бабинского-Жарковского в случае спинальной ишемии) и центральной воспалительной демиелинизацией у больных миелитом. При опухолях конского хвоста, на ранних стадиях заболевания, отмечены признаки периферической демиелинизации (в результате сдавления опухолью), а в поздние сроки – признаки ишемии и деструкции ткани (при распаде опухоли).
Выраженность изменений на ССВП у больных разных групп при стимуляции большеберцового и срамного нервов может свидетельствовать о различных механизмах нарушения проведения нервных импульсов при ишемическом, демиелинизирующем и опухолевом процессах в головном, спинном мозге, периферических нервах и имеет различия в зависимости от уровня и характера повреждения.
В настоящее время наиболее информативным методом определения функционального состояния проводящих путей является регистрация ВП, позволяющая оценить проводимость импульсов по афферентным путям. Разнородность изменений ССВП при стимуляции срамных нервов в различных группах больных позволила предположить разные механизмы формирования сходных по своим проявлениям уродинамических расстройств при различных заболеваниях. В этой связи регистрация ССВП при стимуляции срамных нервов наряду с уродинамическим исследованием может быть использована для обследования больных с подозрением на нейрогенные расстройства акта мочеиспускания. Неоднородность данных, полученных при раздельной стимуляции левого и правого срамных нервов, и отсутствие четкой нейрофизиологической картины при использовании общих кольцевых электродов позволяют предположить важность асимметрии импульсации как причины нарушений мочеиспускания и указывают на необходимость исследования симметричных проводящих путей.
Ниже перечислены основные рефлексы, обеспечивающие мочеиспускание человека [14]. Курсивом выделены те из них, в реализации которых принимает участие срамной нерв. В скобках показано участие этого нерва в передаче афферентных и/или эфферентных импульсов интегральных мочепузырных рефлексов:
Интегральные мочепузырные рефлексы:
1. Симпатический детрузорнотормозящий.
2. Симпатический сфинктеросжимающий.
3. Перинеодетрузорный тормозящий (афферентное звено)1.
4. Уретросфинктерный защитный (афферентное звено, эфферентное звено).
5. Перинеобульбарнодетрузорный расслабляющий (афферентное звено).
6. Детрузорнодетрузорный расслабляющий.
7. Детрузорноуретральный тормозящий.
8. Детрузорносфинктерный тормозящий (эфферентное звено).
9. Уретродетрузорный расслабляющий (афферентное звено).
10. Уретродетрузорный тормозящий.
11. Уретросфинктерный тормозящий (афферентное звено, эфферентное звено).
12. Перинеобульбарнодетрузорный тормозящий (афферентное звено).
Как видно, срамной нерв участвует в том или ином качестве в 7 из 12 рефлексов, связанных с сокращением и расслаблением детрузора, сфинктера и мышц промежности. Наличие выявленных изменений указывает на вовлечение структур нервной системы, регулирующих синхронную сократительную и чувствительную функции нижних мочевыводящих путей. Отсутствие описанных выше изменений при регистрации ВП различных модальностей не исключает повреждение проводящих и аналитических центров нервной системы, так как в реализации нормального мочеиспускания принимают участие другие 5 рефлексов, не связанных ни в афферентном, ни в эфферентном звеньях рефлекторной дуги со срамным нервом. Рефлекторные дуги этих рефлексов замыкаются с участием гипогастрального и тазового нервов и их представительств в центральной нервной системе (интермедиолатеральные вставочные нейроны нижнегрудных сегментов спинного мозга и сакральный центр мочеиспускания соответственно). К сожалению, на сегодняшний день их прижизненное исследование не представляется возможным.
В настоящее время существует точка зрения о преимущественно спинальном контроле работы мочевого пузыря. В этой связи наиболее интересным было выделение пудендальных ССВП на спинальном уровне для анатомически более точной локализации имеющихся нарушений. В то же время наибольшая частота расстройств мочеиспускания зарегистрирована при поражении головного мозга, а отсутствие корковых ответов при ряде заболеваний центральной нервной системы свидетельствует о необходимости дальнейшего изучения функциональных взаимоотношений между ее центральными и периферическими звеньями при реализации функций нижних мочевыводящих путей.
Авторы заявляют об отсутствии конфликта интересов.
The s declare no conflicts of interest.
Сведения об авторах
Сведенция об авторах:
Кадыков А.С. – д.м.н., проф., гл. научный сотрудник 3-го неврологического отделения (ранней реабилитации для больных с инсультом и другими заболеваниями нервной системы) с психолого-логопедической группой ФГБНУ «Научный центр неврологии», Москва
Шварц П.Г. – д.м.н., руководитель лаборатории нейроурологии и уродинамики ФГБНУ «Научный центр неврологии», ст. научный сотрудник, врач-уролог, Москва
Федин П.А. – к.м.н., вед. научный сотрудник лаборатории клинической нейрофизиологии ФГБНУ «Научный центр неврологии», Москва
Попов С.В. – : servit77@yandex.ru; https://orcid.org/0000-0002-0567-4616
Моисеев П.П. – https://orcid.org/0000-0002-5870-345X
Как цитировать:
Кадыков А.С., Шварц П.Г., Федин П.А., Попов С.В., Моисеев П.П. Диагностические возможности исследования соматосенсорных вызванных потенциалов у больных с нейрогенной задержкой мочи. Журнал неврологии и психиатрии им. С.С. Корсакова. 2019;119(6):-64. https://doi.org/10.17116/jnevro2019119061
Автор, ответственный за переписку: Попов Сергей Витальевич – : servit77@yandex.ru
Источник
