Учащение мочеиспускания при грыжах
Статья посвящена проблеме нейрогенных расстройств мочеиспускания при травме позвоночника и спинного мозга
Путь пациента с осложненной травмой позвоночника, т. е. сопровождающейся повреждением спинного мозга, начинается с нейрохирургического оперативного вмешательства и продолжается многоэтапной реабилитацией, направленной на коррекцию сопутствующих осложнений и восстановление утраченных функций организма [1]. Для таких больных есть специфический термин – «спинальные».
Одним из тяжелейших последствий травмы спинного мозга является расстройство произвольного мочеиспускания, обусловленное нарушением проводимости спинномозговых путей. По данным М.Р. Касаткина, подобное осложнение встречается в 92,1% случаев закрытых повреждений спинного мозга [2]. Патогенез изменений функции нижних мочевых путей при травме спинного мозга, проявляющийся в утрате рефлекторной деятельности, сложен и многообразен [3].
Механизм нормального мочеиспускания и характер его расстройства у спинальных пациентов напрямую связаны с особенностями физиологии этой области. Периферическую иннервацию нижних мочевых путей осуществляют тазовый нерв, представляющий парасимпатическую нервную систему, гипогастральный нерв, реализующий симпатическую регуляцию, и пудендальный соматический нерв. Афферентную информацию несут волокна всех трех нервов – вегетативных от детрузора (гладкой мышцы мочевого пузыря) и уретры и полового нерва от тканей промежности. Первичным анализатором для парасимпатического тазового нерва являются нейроны сакрального центра мочеиспускания, расположенного на уровне S2‒S4 сегментов спинного мозга. Здесь же, в анатомическом соседстве, находится ядро Онуфа, представляющее собой скопление нервных клеток, аксоны которых образуют пудендальный нерв [4]. Симпатическая афферентная иннервация, опосредованная гипогастральным нервом, являющимся частью подчревного и поясничного сплетения, осуществляется через пограничный симпатический ствол и вставочные интернейроны боковых рогов спинного мозга на уровне его Th10‒L2 сегментов. Эти же нервы несут и эфферентные сигналы к иннервируемым органам. Регулирующие структуры спинного мозга связаны с вышерасположенными центрами иннервации проекционно, а также с помощью нейрогуморальных и рефлекторных механизмов [5]. Однако следует отметить, что концепции регуляции функции нижних мочевых путей в норме и патологии являются в большей степени эмпирическими, и единого понимания этого вопроса на сегодняшний день нет.
Клиническая картина
Врачу-неврологу, курирующему пациента с осложненной травмой позвоночника, необходимо оценить уровень и степень повреждения спинного мозга и учесть посттравматические сроки. Клиническая картина в острый и ранний периоды после получения травмы обусловлена спинальным шоком, что проявляется арефлексией и задержкой мочи. По мере восстановления можно наблюдать активизацию рефлекторной деятельности и формирование «в сухом остатке» нейрогенного расстройства мочеиспускания. При повреждении спинного мозга на уровне сакрального центра мочеиспускания и периферических нервных волокон развивается атония или гипотония детрузора, при этом за счет интактности симпатических структур иннервации внутренний уретральный сфинктер сохраняет сократительную способность. Таким образом, нарушается взаимосвязь симпатических и парасимпатических влияний [6]. Клинически наблюдается нейрогенная задержка мочеиспускания с элементами парадоксальной ишурии (выделения мочи по каплям на фоне переполненного мочевого пузыря). При локализации травмы выше сакрального центра и ядра Онуфа повреждаются проводниковые нервные волокна, осуществляющие взаимосвязь регулирующих структур, однако сами центры иннервации могут быть интактны. В этом случае и детрузор, и внутренний сфинктер уретры способны к циклическому сокращению и расслаблению, но рассогласованность в работе приводит не к нормальному акту мочеиспускания, а к детрузорно-сфинктерной диссинергии. Поражение на уровне нижнегрудного и верхнепоясничного отделов позвоночника, вовлекающее симпатические регулирующие структуры, вызывает нарушение сократительной способности внутреннего сфинктера уретры и недержание мочи. Травма спинного мозга на уровне шейного и верхнегрудного отделов позвоночника ведет к прерыванию взаимосвязи спинальных и стволовых, а также кортикальных структур регуляции. В ситуации, когда центры иннервации спинного мозга и нервные проводники между ними сохраняют свою анатомическую целостность, клинически может сформироваться автономный процесс мочеиспускания, а также гиперактивность мочевого пузыря. В этом случае накопление и выделение мочи происходят рефлекторно, в т. ч. с участием аксон-рефлексов, без контроля центров, отвечающих за произвольную составляющую физиологического процесса [7].
Описанные клинические нарушения достаточно вариабельны и зависят от характера и тяжести повреждения, а также сроков, прошедших с момента травмы, поэтому можно наблюдать переход одной формы нейрогенного расстройства мочеиспускания в другую.
Невролог, понимая обусловленность клинической картины уровнем поражения спинного мозга, определяет тактику ведения спинального пациента и дальнейший прогноз. Осуществление адекватной коррекции урологических осложнений лежит, несомненно, в междисциплинарной плоскости. В связи с этим нейроурологическая практика, а вернее, четкое и скоординированное взаимодействие невролога и уролога способно обеспечить квалифицированную и своевременную помощь. И если врач-невролог сосредоточен на повреждении спинного мозга и нарушении иннервации, то уролог контролирует непосредственное функциональное состояние нижних мочевых путей и коррекцию сопутствующих воспалительных и нефротических осложнений. Отсюда вытекает необходимость тесной взаимосвязи специалистов для полноценной коррекции нейрогенных расстройств мочеиспускания.
В представлении уролога, оказывающего специализированную помощь пациентам с неврологическими расстройствами, процесс мочеиспускания выглядит несколько сложнее, чем простой циклический акт, состоящий из чередования фаз накопления и выведения мочи, обеспеченный двумя основными функциями мочевого пузыря: резервуарной и эвакуаторной. Функционально этот процесс определяется синергией детрузора с гладкомышечным сфинктером уретры и мышцами тазового дна, включающими наружный уретральный сфинктер.
Физиологически мочевой пузырь, природой созданный резервуар для сбора мочи, обладает способностью к полному опорожнению в подходящее время и в удобном для совершения акта мочеиспускания месте согласно социально-поведенческим нормам. Эта крайне важная способность реализуется в результате сложной регуляции с участием центральной и периферической нервных систем. Фундаментально акт мочеиспускания – это спинальный рефлекс, обеспечиваемый работой центров головного мозга, реализация и подавление этого рефлекса находятся под волевым контролем. Возможность произвольного управления делает функцию нижних мочевых путей уникальной по сравнению, например, с сердечно-сосудистой системой, и в то же время более уязвимой при неврологических заболеваниях [8]. Таким образом, основными функциями нижних мочевых путей являются накопление мочи в мочевом пузыре, длящееся относительно продолжительное время, и мочеиспускание, занимающее в норме несколько секунд. Реципрокные отношения – расслабление/напряжение детрузора, закрытие уретрального сфинктера и сокращение/расслабление детрузора, открытие уретрального сфинктера – обеспечивают скоординированность процессов накопления и удаления мочи и находятся под нейромедиаторным контролем [9].
Нейрогенная дисфункция нижних мочевых путей является следствием патологии центральной нервной системы или периферических нервных окончаний ‒ отделов нервной системы, выполняющих контроль над актом мочеиспускания. В этом состоит главное отличие рассматриваемого нарушения от нарушений нижних мочевых путей ненейрогенной этиологии, развивающихся вследствие поражения непосредственно мочеполовой системы.
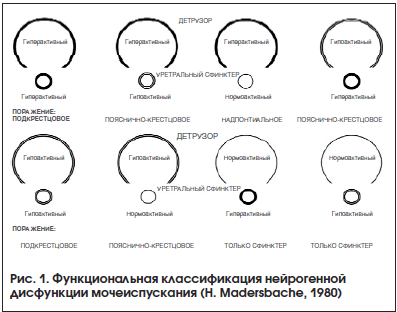
В урологическом сообществе длительное время основной опорой для определения формы нейрогенного расстройства мочеиспускания являлась классификация, предложенная профессором Г. Мадерсбахером в 1980 г. и рекомендуемая Европейской ассоциацией урологов (рис. 1) [10]. В ней автор выделяет 8 основных форм нейрогенных расстройств мочеиспускания в зависимости от состояния детрузора и внутреннего сфинктера уретры. Подразумевается, что указанные структуры могут быть в гипертонусе, гипотонусе и в нормальном состоянии. Однако сложность в постановке диагноза и категоричность в выборе одной из 8 форм нарушений мочеиспускания сегодня заставляют говорить о пересмотре форм расстройств мочеиспускания. С клинической точки зрения все возможные виды нарушений мочеиспускания рассмотреть в рамках одной из существующих классификаций невозможно. В определении поражения у пациента наиболее часто специалисты основываются на преобладающем нарушении эвакуаторной или резервуарной функции мочевого пузыря, различных видах детрузорно-сфинктерной диссинергии и уродинамических показателях максимального детрузорного давления в точке утечки. При этом важность знания о максимальном детрузорном давлении и максимальном давлении в точке утечки делает необходимым проведение специализированного уродинамического исследования практически каждому пациенту с нарушениями мочеиспускания на фоне неврологического заболевания.
Лечение
Основными задачами урологической помощи на всех этапах нейрореабилитации являются:
1) сохранение и обеспечение функции верхних мочевыводящих путей;
2) независимость регуляции функции нижних мочевыводящих путей;
3) улучшение качества жизни.
С практической точки зрения важны борьба с вторичными осложнениями нейрогенной дисфункции мочеиспускания, а также их профилактика. К таким осложнениям относятся манифестация инфекции мочевыводящих путей (исключая бессимптомную бактериурию), уролитиаз, микроцистис, гидронефротическая трансформация и почечная недостаточность, стриктура уретры и т. д. [11].
Наименьшего риска осложнений со стороны верхних мочевыводящих путей следует ожидать при сохранении резервуарной функции мочевого пузыря с низким внутрипузырным давлением, например при гипотонии детрузора, его достаточной функциональной емкости и нормальном состоянии поперечно-полосатого сфинктера уретры или его гипотонии. В этом случае к хорошим результатам коррекции, в т. ч. улучшению качества жизни спинального пациента, приводит адекватное дренирование нижних мочевых путей, при этом следует руководствоваться международными стандартами и отечественными клиническими рекомендациями. При нарушении функции опорожнения мочевого пузыря вследствие повреждения позвоночника и спинного мозга методом выбора является асептическая периодическая катетеризация. Она подразумевает использование одноразового стерильного лубрицированного катетера. Процедура выполняется самостоятельно или с посторонней помощью каждые 4‒6 ч [12].
Иные методы дренирования мочевого пузыря, такие как приемы Креде или Вальсальвы, длительное использование постоянного мочевого катетера, должны быть строго обоснованы, т. к. несут значительные риски развития вторичных нейрогенных осложнений работы мочевого пузыря, достигающих 34% [13].
Периодическая катетеризация 4‒6 раз в сутки при условии отсутствия выраженных нарушений со стороны верхних мочевыводящих путей, шокового состояния, гнойно-инфекционных процессов в уретре и мочевом пузыре может быть назначена любым специалистом, курирующим пациента. Вопрос о том, когда переводить пациента на периодическую катетеризацию для постоянного уретрального дренажа, находится в стадии обсуждения сообщества специалистов по нейроурологии [14]. Формальных ограничений и четких рекомендаций по срокам нет, однако считается, что при отсутствии противопоказаний и достаточной укомплектованности отделения средним и младшим медицинским персоналом следует избавлять пациента от постоянных дренажей как можно раньше.
Гиперактивный мочевой пузырь, встречающийся на фоне детрузорно-сфинктерной диссинергии и без нее, является другой формой нейрогенного расстройства мочеиспускания вследствие травмы позвоночника и спинного мозга. Если такой тип нарушения клинически проявляется недержанием мочи, то он не несет значительного риска осложнений со стороны верхних мочевыводящих путей. К проблемам нейрогенного гиперактивного мочевого пузыря следует отнести снижение качества жизни.
Детрузорно-сфинктерная диссинергия характеризуется тем, что в момент напряжения мочевого пузыря для его опорожнения происходят различные по силе и продолжительности сокращения внутреннего и наружного сфинктеров уретры, обеспечивающих функцию удержания. В норме сокращения детрузора синхронны с расслаблением этих сфинктеров, что способствует свободному выведению мочи по уретре. Нарушение функции опорожнения в сочетании с высоким внутрипузырным давлением ‒ наиболее опасная форма нейрогенной дисфункции мочеиспускания из-за развития пузырно-мочеточникового рефлюкса, а также возможности структурных повреждений самого мочевого пузыря. В этом случае перед урологом стоят две основные задачи: 1) подавление высокого внутрипузырного давления, 2) обеспечение оттока мочи по уретре.
Для подавления детрузорной гиперактивности в качестве первой линии терапии применяются антихолинергические средства, в дополнение к которым можно назначать препараты из группы бета-3-адреномиметиков [15]. Вторая линия лечения включает инъекционное введение в стенку мочевого пузыря 200 ЕД ботулинического нейропептида. Надо понимать, что терапия направлена на создание низкого внутрипузырного давления в мочевом пузыре, необходимого для нормальной работы верхних мочевых путей. Одним из результатов купирования гиперактивности, особенно при сохранении нормального или повышенного тонуса поперечно-полосатого сфинктера уретры, будет увеличение количества остаточной мочи или отсутствие мочевыделения. Поэтому крайне важно объяснить пациенту необходимость проведения указанной терапии с назначением периодической катетеризации мочевого пузыря.
При своевременной коррекции нарушений мочеиспускания у спинальных пациентов, применении рекомендованного метода отведения мочи, компенсации избыточного внутрипузырного давления вследствие гиперактивности детрузора или детрузорно-сфинктерной диссинергии удается избежать многих вторичных осложнений.
В комплексной программе реабилитационного лечения пациентов с травмой позвоночника и спинного мозга используются методики немедикаментозной коррекции, показавшие различный терапевтический потенциал в ходе исследований. В частности, применение электростимуляции мочевого пузыря с помощью имплантируемых электродов в работе А.В. Лившица и соавт. показало, что создать управляемый акт мочеиспускания невозможно, т. к. возбуждение детрузора распространяется на внутренний сфинктер уретры, моделируя детрузорно-сфинктерную диссинергию [16]. Несмотря на то что исследователи представили некоторые положительные результаты, методика не нашла клинического применения в связи с высокой инвазивностью и риском вторичных осложнений.
Применение электростимуляции переменным пульсирующим током по лонно-сакральной методике и электрофореза с прозерином на передней брюшной стенке в проекции мочевого пузыря в настоящий момент представляется несостоятельным вследствие особенностей физиологии нижних мочевых путей и неучастия мышц живота в акте мочеиспускания.
Перспективно использование современных методик: сакральной инвазивной электронейростимуляции с помощью имплантируемых электродов и ритмической периферической магнитной стимуляции в области сакрального центра мочеиспускания и крестцовых корешков [17, 18]. В настоящее время механизм действия магнитной стимуляции на физиологию нижних мочевых путей остается неясным. Многоступенчатость и сложность нервной регуляции процесса удержания мочи и акта мочеиспускания предполагают возможность вовлечения различных структур в ответ на внешнее воздействие. Клинические и уродинамические эффекты магнитной стимуляции, вероятно, связаны с восстановлением интеграции регуляторных рефлексов, при этом наблюдается эффект нейромодуляции, когда происходит изменение активности (торможение или возбуждение) структур центральной, периферической и вегетативной нервных систем [19, 20].
Нейрогенное нарушение мочеиспускания, обусловленное травмой позвоночника и спинного мозга, клинически чрезвычайно гетерогенно вследствие вариабельности уровня и степени тяжести поражения [21, 22]. Этот аспект диктует необходимость индивидуального диагностического подхода, выбора адекватного метода коррекции работы нижних мочевых путей. Реабилитационный путь спинального пациента в настоящее время невозможно представить без тесного сотрудничества невролога и уролога. Совместный современный подход специалистов к проблеме урологических осложнений травмы спинного мозга обеспечивает пациенту верное понимание собственного состояния и адекватную прогностическую оценку, а также возможность социальной адаптации и повышения качества жизни [23, 24].
Источник
А.Г. Иванов, Ю.В. Хоронько
ФГБОУ ВО «Ростовский государственный медицинский университет» МЗ РФ; Ростов-на-Дону, Россия
Введение
Скользящая паховая грыжа является сложной проблемой, находящейся на стыке современной хирургии и урологии. Риски, связанные со сложностью диагностики, особенностями оперативного вмешательства, вероятностью травмы мочевого пузыря, мочеточников обуславливают интерес к данной проблеме. Цель исследования: описать клинический случай большой скользящей грыжи, этапы диагностики, оперативного лечения и послеоперационные результаты.
Клинический случай
Пациент К., 66 лет. Обратился с жалобами на наличие выпячивания в левой паховой области, боли в проекции данного выпячивания при физических нагрузках, увеличение мошонки слева, затруднения при мочеиспусканиях, отсутствие чувства полного опорожнения мочевого пузыря после мочеиспусканий.
Анамнез заболевания: считает себя больным в течение 3 лет, когда после физической нагрузки появилась боль и грыжевое выпячивание в левой паховой области. За медицинской помощью не обращался. В последние несколько недель грыжевое выпячивание увеличилось в размерах, появилась боль в проекции выпячивания, отметил увеличение мошонки слева.
Из анамнеза жизни: в 1970 году аутовенозная пластика левой бедренной артерии вследствие травматического повреждения, в 2008 году – операция по поводу гидрогеле слева, в 2017 году – натяжная герниопластика задней стенки пахового канала слева, рецидив в течение полугода.
us urogenitalis. Почки не пальпируются. Мочеиспускание затруднено, прерывистое, после мочеиспускания чувство полного опорожнения мочевого пузыря отсутствует.
Per rectum: простата значительно увеличена, симметрично уплотнена. Контуры её чёткие, ровные, поверхность гладкая, междолевая борозда не определяется, верхний полюс не достижим. Подвижность сохранена. Болезненность при пальпации умеренная.
us localis: в левой паховой области определяется грыжевое выпячивание размерами 4х5х5 см. В положении лежа выпячивание вправляется в брюшную полость, при пальпации мягко-эластической консистенции, умеренно болезненное. Грыжевые ворота до 2 см в диаметре. Элементы семенного канатика расположены медиально. Кожа над выпячиванием не изменена.
Результаты исследований
УЗИ органов мошонки. Наружное кольцо пахового канала слева при натуживании расширяется до 20 мм. Лоцирован грыжевой мешок 4х5х5 см с неоднородным содержимым. Размеры яичек обычные, контуры их чёткие, ровные. Придатки умерено диффузно неоднородные с двух сторон. Эхографические признаки кист головки правого придатка, умеренного гидроцеле справа, выраженного гидроцеле слева.
УЗИ мочевого пузыря и простаты. Объём мочевого пузыря – 350 мл. Объём простаты – 170 мл. Объём остаточной мочи – более 200 мл.
Урофлуометрия: максимальная скорость потока мочи (Q max) – 12-13 мл/сек.
Оценка качества жизни по I-PSS -21 балл.
PSA – 3,5 нг/мл.
Триплексное сканирование артерий и вен нижних конечностей. Атеросклеротические изменения стенок артерий. Артерии на бедре и голени с обеих сторон проходимы, УЗ признаков гемодинамически значимых стенозов артерий нижних конечностей не выявлено.
При спиральной компьютерной томографии (СКТ) таза визуализирован резко деформированный мочевой пузырь, часть его пролоббирует в грыжевой мешок пахово-мошоночной грыжи слева. Оба мочеточника впадают в типичном месте. Нижняя треть левого мочеточника извита, лежит вне грыжевого мешка (рис. 1).
Рисунок 1. СКТ таза: А – сагиттальный срез; В – компьютерная реконструкция таза. Мочевой пузырь резко деформирован, часть его пролоббирует в грыжевой мешок пахово-мошоночной грыжи слева
Выполнена уретроцистоскопия. Значительно увеличенная простата обусловила затруднения при поиске устья грыжевого компонента мочевого пузыря, которое с трудом визуализировано при фиброцистоскопии (рис. 2).
Рисунок 2. Фиброуретроцистоскопия. Устье грыжевого компонента
Диагноз: Основной: Большая левосторонняя косая пахово-мошоночная грыжа с вовлечением мочевого пузыря в грыжевой мешок.
Сопутствующий: Доброкачественная гиперплазия простаты. Хроническая неполная задержка мочи. Хронический левосторонний эпидидимит. 2-х стороннее гидроцеле.
Операция: Герниотомия слева, герниопластика задней стенки пахового канала сетчатым имплантом.
После иссечения рубцовых тканей визуализированы грыжевые ворота неправильной формы и шейка грыжевого мешка. От окружающих тканей мобилизован тесно спаянный с ними грыжевой мешок, опускающийся в мошонку. Содержимое грыжевого мешка – стенка мочевого пузыря, предбрюшинная жировая клетчатка. В процессе мобилизации стенки мочевого пузыря полного её расправления не достигнуто ввиду наличия выраженных фиброзных и спаечных изменений.
Пластика задней стенки пахового канала произведена с применением сетчатого импланта размерами 10х15см.
Наблюдение 3 месяца. В послеоперационном периоде проводилась стандартная терапия, включающая тамсулозин по 0,4 мг 1 раз в сутки утром.
Пациент отметил значимое уменьшение степени выраженности дизурических расстройств. Оценка качества жизни по I-PSS: 18 баллов. При урофлуометрии Q max – 17,5 мл/сек.
Вместе с тем, обратил внимание на появление и постепенное увеличения овоидного безболезненного образования в левой половине мошонки, прилежащего к яичку.
Выполнено УЗИ нижних мочевых путей и органов мошонки. Объём мочевого пузыря – 360 мл.
Рисунок 3. Урофлуометрия. Значимых обструктивных признаков не отмечено
Объёмпростаты – 170 мл. Объёмостаточноймочи – 140 мл. Отмечено расправление мочевого пузыря (рис. 4-5). Признаки жидкостных образований в области проекции левого придатка. Размеры яичек обычные, контуры чёткие ровные (рис. 6-7).
Рисунок 4. УЗИ мочевого пузыря (через 3 месяца после операции.) Мочевой пузырь несколько деформирован, признаков сохраняющегося изолированного грыжевого компонента не отмечается
Рисунок 5. УЗИ простаты. Объём простаты увеличен до 170 мл
Рисунок 6. УЗИ органов мошонки. Левое яичко без признаков значимой патологии
Рисунок 7. УЗИ органов мошонки. Жидкостное образование в проекции левого придатка яичка
МРТ таза. Визуализированы органы таза, мошонки, паховые области.
Оба яичка расположены в мошонке, правильной формы, нормальных размеров. Структура однородная. Справа придаток яичка, семенной канатик не изменены. Умеренно увеличено количество жидкости между оболочками яичка.
Слева придаток яичка удлинен и деформирован, фиброзно изменен. Сформировано полостное образование размерами 65х49х46 мм с фиброзной капсулой, широким основанием вдоль придатка, от верхнего полюса которого начинается семявыносящий проток. Имеются множественные перегородки, создающие анатомически правильный рисунок, содержимое достаточно однородное, жидкостное, с высоким содержанием белка в жидкости. В проекции головки придатка выявлено полостное образование размерами 17х18х19 мм с перегородками, содержащее простую жидкость.
По ходу семенного канатика и пахового канала в целом выражены фиброзные, спаечные изменения, распространяющиеся на клетчатку паховой области, в меньшей степени – на клетчатку таза. По ходу фиброзных тяжей в паху расположены множественные лимфатические узлы с максимальной осью 15-16 мм.
Предстательная железа увеличена, преимущественно за счет центральной доли, размеры 71 мм (вертикальны) х 77 мм (латеральный) х 63 м (переднезадний). Дифференцировка долей нарушена. Структура паренхимы неоднородная за счет однотипных округлых включений различного диаметра с достаточно четким границами. Капсула железы нормально выражена.
Смененные пузырьки не изменены.
Мочевой пузырь расположен типично, не туго наполнен, стенки с четким контурами, сигнал однородный. Нижние трети обоих мочеточников не расширены.
Прямая кишка без особенностей.
В тазу и в нижних отделах забрюшинного пространства лимфатические узлы не увеличена. Видимые кости без продуктивных и деструктивных изменений.
Заключение: MPT-признаки кисты придатка яичка слева, выраженных фиброзных изменений в паховом канале слева (рис. 8).
Рисунок 8. МРТ таза. Киста придатка левого яичка. Грыжевой компонент не дифференцируется
Выполнена скрототомия. Визуализировано левое яичко, которое несколько уменьшено в размере тургор его несколько снижен, собственная оболочка умеренно гиперемирована, «пёстрая». В области головки придатка – тонкостенное жидкостное образование диаметром до 2 см.
Вплотную к яичку прилежит округлое плотноэластическое образование диаметром до 3 см. Образование отделено от левого яичка. Отмечена интимная связь образования с элементами семенного канатика. При пункции образования эвакуировано до 50 мл геморрагической жидкости. Внешние стенки образования белесоватого цвета, плотные, толщиной до 1 мм, Образование отсечено от семенного канатика острым путём.
Произведено вскрытие кисты придатка левого яичка. Содержимое – прозрачная жидкость жёлтого цвета. Выполнено иссечение оболочек кисты.
Гистоисследование: Кистозная лимфангиома с хроническим воспалением, геморрагиями, гемосидерозом и склерозом стенки.
Послеоперационный период протекал стандартно.
Результаты лечения. Ликвидирована большая скользящая пахово-мошоночная грыжа с вовлечением мочевого пузыря в грыжевой мешок. Сохраняется аденома простаты значительных размеров. В послеоперационном периоде отмечено уменьшение степени выраженности дизурических расстройств. Перемещённый из мошонки мочевой пузырь полностью расправлен. Однако, неясной остается функциональная возможность той зоны мочевого пузыря, которая находилась в грыжевом мешке. Следовательно, в генезе дизурических расстройств имеет значение не только обструктивный фактор, обусловленный значительным увеличением простаты. Нельзя исключить роль «грыжевой» части мочевого пузыря в генезе дизурических расстройств. В связи с сохраняющимися дизурическими расстройствами планируется дообследование.
Обсуждение
Своевременное распознавание скользящей паховой грыжи при вовлечении мочевого пузыря в медиальную стенку грыжевого мешка у ряда пациентов может быть затруднительным [1, 2]. Длительное существование пахово-мошоночной грыжи приводит к развитию выраженного рубцово-спаечного процесса и зачастую сопровождается формированием грыжевого мешка большой длиныпо оси. В более редких случаях вовлечение стенки мочевого пузыря осложняется формированием мешковидного резервуара значительных размеров [3, 4]. Выполнение хирургического пособия в подобной ситуации требует принятия двух ключевых решений. Первое касается проведения наиболее эффективного и безопасного хирургического пособия в отношении сформированного дивертикула. Второе – заключается в выборе надёжного варианта герниопластики. Отсутствие однозначного решения в вопросе выбора оптимальной хирургической тактики требует углубленного изучения.
Литература
- Волков С.В., Еремеев А.Г., Карташов И.Н., Воронов С.П., Голубев А.А., Башар Якуб. Редкое наблюдение рецидивной скользящей паховой грыжи, содержащей мочеточник, с развитием гидронефроза. Верхневолжский медицинский журнал. 2015;14(2): 48-52. eLIBRARY ID: 35379345
- Samra NS, Ballard DH, Doumite DF, Griff en FD. Repair of Large Sliding Inguinal Hernias. Am Surg. 2015; 81(12):1204- 1208. PMID: 26736154
- Komorowski AL, Moran-Rodrigues J, Kazi R, Wysocki WM. Sliding inguinal hernias. Int J Surg. 2012; 10(4):206-208. DOI:10.1016/j.ijsu.2012.03.002
- Wang P, Huang Y, Ye J, Gao G, Zhang F, Wu H. Large sliding inguinal-scrotal hernia of the urinary bladder: A case report and literature review. Medicine (BalƟ more). 2018; 97(13):e9998. DOI:10.1097/MD.0000000000009998
Статья опубликована в журнале “Вестник урологии” № 1 2019, стр. 53-58
Источник
