Тип эпителия мочевого пузыря

Мочевыводящие пути. Строение мочевыводящих путей.
К мочевыводящим путям относят почечные чашечки, лоханки, мочеточники, мочевой пузырь и мочеиспускательный канал. Строение этих органов в общих чертах сходно, так как их стенка состоит из слизистой оболочки, подслизистой основы, мышечной и наружной оболочек. Эпителий мочевыводящих путей называется переходным. Он относится к эпителиям кожного типа. В эпителии различают базальные клетки, выполняющие роль камбия, и более дифференцированные поверхностные клетки. При этом около половины поверхностных клеток являются полиплоидными.
В стенке почечных чашечек описаны особые гладкие мышечные клетки – водители ритма (пейсмекеры). За счет ритмического сокращения этих клеток моча порциями поступает из собирательных трубочек и происходит опорожнение почечных чашечек.
В мочеточниках гладкая мышечная ткань образует в верхней половине два слоя: внутренний – продольный и наружный – циркулярный. В нижней части мочеточников добавляется еще один продольный слой, расположенный снаружи от циркулярного.
В мочевом пузыре слизистая оболочка приспособлена к растяжению, связанному с периодическим накоплением мочи. Эпителий при этом меняет свою гистологическую картину от растянутого двухслойного до псевдомногослойного в спавшемся пузыре. В слизистой оболочке мочевого пузыря сильно развиты сосудистые подэпителиальные сплетения. Мышечная оболочка мочевого пузыря состоит из трех слоев: внутреннего, наружного с продольным расположением гладких миоцитов и среднего – циркулярного. В шейке мочевого пузыря имеется мышечный сфинктер.
Наружная оболочка образована соединительной тканью, а в области дна – серозной оболочкой. Мочевой пузырь иннервируется симпатическими и парасимпатическими, а также спинальными нервами. В нем имеется много вегетативных нервных ганглиев.
Стенка мужского мочеиспускательного канала состоит из слизистой и мышечной оболочек, а женского – слизистой, мышечной и адвентициальной оболочек. Эпителий слизистой оболочки из переходного постепенно трансформируется в многослойный плоский неороговевающий. В составе эпителия встречаются скопления слизистых клеток. Собственная пластинка слизистой оболочки содержит уретральные слизистые железы. Мышечная оболочка включает внутренний продольный и наружный циркулярный слои гладких миоцитов.
При прохождении мочеполовой диафрагмы мужская уретра окружается поперечнополосатой мышечной тканью наружного сфинктера мочевого пузыря. Женская уретра в средней своей части окружается поперечнополосатой мышечной тканью наружного сфинктера.
Возрастные изменения мочевыводящих путей. В постнатальном периоде продолжаются рост и развитие нефронов. При этом увеличиваются их длина и толщина. В связи с этим на единицу массы почечной ткани у взрослого приходится в 10 раз меньше почечных телец по сравнению с новорожденным.
Реактивность и регенерация мочевыводящих путей. Реактивные изменения почек при действии экстремальных факторов (переохлаждение организма, отравление ядовитыми веществами, действие проникающей радиации, ожоги, травмы и др.) весьма разнообразны с преимущественным поражением сосудистых клубочков или эпителия различных отделов нефрона вплоть до гибели нефронов.
Регенерация нефрона происходит более полно при внутриканальцевой гибели эпителия. Наблюдаются клеточная и внутриклеточная формы регенерации. Эпителий мочевыводящих путей обладает достаточно выраженной восстановительной способностью.
Аномалии мочевыделительной системы, органогенез которой достаточно сложен, являются одним из наиболее частых пороков развития. Причинами их образования могут быть как наследственные факторы, так и действие различных повреждающих факторов – ионизирующего излучения, алкоголизма и наркомании родителей и др. Вследствие того, что нефроны и собирательные трубочки имеют разные источники развития, неправильность или отсутствие их контактов друг с другом приводит к патологии развития почек (поликистоз, гидронефроз, агенезия почек и др.).
– Также рекомендуем “Иммунный комплекс органов. Красный костный мозг.”
Оглавление темы “Выделительная система. Кроветворная система.”:
1. Плевра. Выделительный комплекс органов.
2. Почки. Строение почек. Нефрон. Функции и строение нефрона.
3. Петля Генле. Дистальный отдел нефрона. Собирательные трубочки почки. Сосуды почки.
4. Миоидные эндокриноциты. Юкставаскулярные клетки – Гурмагтига.
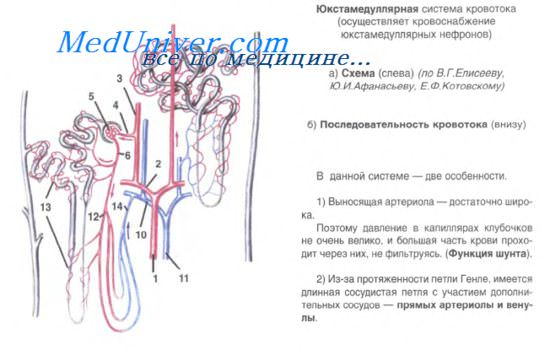
5. Мочевыводящие пути. Строение мочевыводящих путей.
6. Иммунный комплекс органов. Красный костный мозг.
7. Тимус. Развитие тимуса. Строение тимуса.
8. Лимфатические узлы. Развитие лимфатических узлов. Строение лимфатических узлов.
9. Селезенка. Развитие селезенки. Строение селезенки.
10. Иммунитет. Виды иммунитета. Виды иммунной реактивности организма.
Источник
Admin2 | 11.04.2016
Мочевой пузырь, vesica urinaria – полый мышечный
орган плоско-округлой формы, размеры которого меняются в зависимости от
наполнения его мочой. Наполненный мочевой пузырь имеет грушевидную форму. и
сужается вниз. В опорожненном виде он имеет блюдцеобразную форму; вместимость
его в среднем 750 см3.
В мочевом пузыре выделяют несколько отделов, переходящих один в другой:
тело пузыря, corpus vesicae, его верхушку, apex vesicae,
срединную пупочную связку, ligamentum umbilicale num,
соединяющую мочевой пузырь с пупком; связка эта представляет заросший
мочевой проток, urachus.
Дно мочевого пузыря практически неподвижно и направлено у мужчин
в сторону прямой кишки, а у женщин – в сторону влагалища.
Передненижняя вытянутая часть пузыря составляет его шейку, cervix
vesicae, в этой части находится внутреннее отверстие
мочеиспускательного канала, ostium urethrae internum.
В теле мочевого пузыря различают переднюю, заднюю и боковые стенки;
передняя стенка соответствует участку пузыря между верхушкой и шейкой; она
обращена к лобковому симфизу, а при наполненном пузыре располагается
позади передних брюшных мышц – пирамидальных и прямых живота; задняя
стенка, обращенная кверху в брюшную полость, составляет отдел, покрытый
брюшиной.
Стенка мочевого пузыря образовано гладкой мышечной тканью, полость которой
выстлана слизистой оболочкой, сверху же он частично покрыт соединительнотканной
оболочкой, частично – серозной, брюшинной. Мышечная оболочка, tunica
muscularis, довольно толстая и состоит из переходящих друг в друга трех слоев:
наружного, среднего и внутреннего. Наружный продольный слой, stratum
externum, начинается с каждой стороны лобкового сращения от
нижней ветви лобковой кости лобково-пузырной мышцей, m.. pubovesicalis:
она, в свою очередь, назад к шейке пузыря и по нижней, а затем
задней поверхности достигает верхушки пузыря; проходя по задней стенке пузыря.
У мужчин она переходит в парную прямокишечно-пузырную мышцу, m.. recto
vesicalis, у женщин же за ней располагается прямокишечно-маточная
мышца, m.. rectouterinus.
Под наружным слоем расположен наиболее мощный мышечный слой мочевого пузыря,
средний слой, который является основным в структуре мышечных стенок.
В области шейки мочевого пузыря он формирует так называемый мышечный жом
мочевого пузыря. Внутренний слой развит слабее всех и состоит из пучков мышц продольного,
частично косого, направления и развит лишь в области дна мочевого
пузыря. В результате наличия косо идущих мышечных пучков между слоями границы
между ними выражены достаточно слабо. Кроме того, неравномерность развития
мышечных слоев обусловлена тем, что при сильном растяжении пузыря некоторые
участки его стенки истончаются.
Слизистая оболочка, tunica mucosa, образована клетками многослойного
переходного эпителия. Она имеет подслизистую основу, tela submucosa,
богатую волокнистой соединительной тканью, складки которой повторяют контур
мышечного слоя.
В переднем отделе дна мочевого пузыря существует три отверстия: два –
устья мочеточников, мочеточниковые отверстия, ostia ureterwn,
и одно – внутреннее отверстие мочеиспускательного канала. Они
находятся по углам мочепузырного треугольника, trigonum vesicae,
который представляет собой наиболее фиксированный участок пузыря. Правый
и левый верхние углы треугольника образованы мочеточниковыми отверстиями,
соединенными межмочеточниковой складкой, plica interureterica:
она, в свою очередь, образована пучками мышц от обоих мочеточников.
У вершины треугольника, расположенной спереди и внизу, находится
полулунной формы внутреннее отверстие мочеиспускательного канала, ostium
urelhrae internum.
В задней части, рядом с устьем мочеиспускательного канала слизистая оболочка
формирует выпячивание, язычок пузыря, uvula vesicae, который
переходит в гребень мочеиспускательного канала, crista urethralis.
Верхнезадняя и отчасти боковые поверхности мочевого пузыря покрыты
брюшиной, на границе с которой образуется поперечная пузырная складка, plica
vesicalis transversa. В своей задней части на уровне впадения
мочеточников брюшина переходит с пузыря на прямую кишку, а у
женщин – на матку.
Передней поверхностью мочевой пузырь соприкасается с лобковым симфизом и
верхними ветвями лобковых костей. Он отделен от них листком предпузырной
фасции, однако при наполнении мочой пузырь выходит из-за лобкового симфиза
кверху, располагаясь позади прямых мышц живота.
У мужчин дно пузыря соприкасается с семенными пузырьками, семявыносящими
протоками и отчасти простатой и передней стенкой ампулы прямой кишки.
У женщин ко дну пузыря плотно примыкают шейка матки и передняя стенка
влагалища. Шейка мочевого пузыря примыкает у мужчин к заднему участку
простаты, у женщин – к мочеполовой диафрагме.
Источник
 | Александр Константинович Носов К.м.н., зав. отделением онкоурологии ФГБУ НИИ онкологии им. Н. Н. Петрова Минздрава России (Санкт-Петербург) nakuro@yandex.ru |
Сергей Александрович Рева К.м.н., врач-онкоуролог отделения онкоурологии ФГБУ НИИ онкологии им. Н. Н. Петрова Минздрава России (Санкт-Петербург) sgreva79@mail.ru |
На сегодняшний день диагностика, лечение и оценка прогноза при лейкоплакии мочевого пузыря до сих пор вызывают разногласия среди специалистов. Одни авторы под термином «лейкоплакия» понимают плоскоклеточную метаплазию с кератинизацией (D. B. Connery, 1953), другие – плоскоклеточную метаплазию уротелия в целом, выделяя различные тактику лечения и прогноз в зависимости от формы (Б. П. Матвеев, 2011). Некоторые авторы рассматривают плоскоклеточную метаплазию без кератинизации и кератинизирующую метаплазию как стадии одного процесса (А. И. Неймарк и др., 2003). В абсолютном большинстве случаев плоскоклеточная метаплазия представлена изменениями без кератинизации (R. H. Young, 2008), кератинизирующая форма относится к нечастым состояниям и выявляется в 1 случае на 10 тыс. всех госпитализаций в урологический стационар (D. B. Connery, 1953).
Типичная картина, характерная для плоскоклеточной метаплазии, – определяемое при цистоскопии белесоватое бархатистое пятно в области треугольника Льето. Такие изменения могут быть выявлены у 80 % здоровых женщин, что в 4 раза превышает встречаемость у мужчин. В зарубежн ых руководствах это рассматривается как норма, а в России часто становится поводом для применения инвазивных методов лечения. Отечественные мультимедийные источники, зачастую не имеющие отношения к медицине, трактуют любую форму плоскоклеточной метаплазии как заболевание, предрасполагающее к развитию рака мочевого пузыря, и рекомендуют агрессивный подход в лечении лейкоплакии.
Кератинизирующая метаплазия уротелия
На начальном этапе развития плоскоклеточная метаплазия является адаптивным и протективным механизмом, защищающим стенку мочевого пузыря от агрессивного внешнего воздействия (K. M. Denlay et al., 1999). При этом не исключается спонтанное восстановление уротелия. Классически плоскоклеточная метаплазия подразделяется на кератинизирующую и некератинизирующую (Б. П. Матвеев, 2011). Четкое описание кератинизирующей плоскоклеточной метаплазии (КПМ) было предложено McDonald, описавшим это состояние как «ороговение неороговевающей мембраны». Некоторые авторы считают КПМ предраковым состоянием, особенно при массивном поражении мочевого пузыря (F. V. Alonso et al., 2012). Первый случай карциномы мочевого пузыря, развившейся при длительном наблюдении за пациентом с КПМ, был описан в 1961 г. Holley и Mellinger. Позднее в работах других авторов была выявлена связь КПМ и плоскоклеточного рака с хронической (особенно шистосоматозной) инфекцией (M. S. Khan et al., 2002).
Цистоскопическая картина характеризуется белесоватыми бляшками на фоне гиперемированной слизистой, расположенными в любом месте мочевого пузыря или диффузно, с преимущественной локализацией в области устьев мочеточников и по передней стенке мочевого пузыря. Проникновение мочи в подлежащий бляшке подслизистый слой может служить причиной поддержания воспалительных изменений в стенке мочевого пузыря, что было подтверждено данными электронной микроскопии (R. G. Morgan et al., 1980). Гистологически очаги поражения представляют собой сквамозный эпителий различной толщины, покрытый слоем кератина, и напоминают карциному in situ (R. H. Young, 2008). Очаги поражения могут быть четко отделены или сливаться с окружающей слизистой мочевого пузыря. В диагностике и прогнозе КПМ в последнее время вызывают интерес различные маркеры (EGFR, PPRAy, PTEN, FOXA1 и т. д.), однако их диагностическая ценность требует дальнейшего подтверждения. Считается, что риск развития плоскоклеточной карциномы при КПМ составляет от 21 до 42 %. Время от диагностирования метаплазии до верифицирования рака мочевого пузыря может варьировать от 4 до 28 лет, а в 9-22 % случаев плоскоклеточный рак развивается синхронно с метаплазией (M. S. Khan et al., 2002). Авторы, проводившие исследование среди 78 больных с КПМ, сообщили о синхронном выявлении карциномы мочевого пузыря и метаплазии у 21 % больных и выявлении рака после диагностирования метаплазии при средней продолжительности 11 лет в 20 % случаев (R. C. Benson et al., 1984). Результатом другого исследования стал вывод о том, что КПМ является предраковым процессом с риском злокачественной трансформации при объеме поражения мочевого пузыря более 50 % и длительном течении (M. S. Khan et al., 2002). Выявлена связь КПМ с формированием сморщенного мочевого пузыря, развитие переходноклеточной или недифференцированной карциномы предполагает плохой прогноз (R. W. Reece et al., 1975). В случае сморщивания мочевого пузыря и при прогрессировании заболевания пациенту может быть предложена цистэктомия (M. S. Khan et al., 2002). Пятилетняя специфическая выживаемость составляет в этих случаях в среднем 57 %.
Одни авторы сообщают о возможности химиопрофилактики КПМ (A. L. Cheng et al., 2001), другие сомневаются в ее эффективности (R. Torrisi et al., 2000). Антибактериальные препараты могут приводить к регрессу симптомов в трансформированной слизистой, но не к объективным изменениям, поэтому наиболее рациональным методом представляется трансуретральная резекция участков при ограниченной площади поражения (F. V. Alonso et al., 2012).
Пациенты, находящиеся на интермиттирующей катетеризации, должны подвергаться мониторингу в целях выявления КПМ.
Наиболее распространенные схемы предлагают проведение ежегодной цистоскопии и цитологического исследования мочи с периодическим выполнением рандомных биопсий (А. И. Неймарк и др., 2003).
Некератинизирующая метаплазия уротелия
НПМ уротелия – наиболее частая трансформация слизистой мочевого пузыря. НПМ известна как «вагинальная метаплазия», так как эпителий при исследовании напоминает влагалищный, и практически всегда выявляется у женщин репродуктивного возраста в области мочепузырного треугольника. Основное отличие от КПМ – отсутствие клеточной атипии, что позволяет рассматривать данные изменения как вариант нормальной слизистой, развивающийся вследствие гормональной активности эстрогенов и не имеющий клинической значимости (C. C. Guo et al., 2006). Такие изменения присутствуют у 86 % женщин в репродуктивном возрасте и почти у 75 % в постменопаузальном периоде (T. J. Stephenson et al., 1989; E. D. Long et al., 1983). Данный тип эпителия очень редко выявляется у мужчин, но может быть обнаружен у пациентов, получающих терапию эстрогенами по поводу аденокарциномы предстательной железы, что подтверждает гормональную природу описанных трансформаций уротелия (L. Henry et al., 1971). Некоторые авторы сообщают, что НПМ не должна ассоциироваться с КПМ, так как развивается в результате гормональных изменений и является вариантом нормального течения процесса перестройки эпителия (R. H. Young et al., 2008). На сегодняшний день нет данных о стадийных изменениях слизистой мочевого пузыря и развитии ороговевающей формы метаплазии из неороговевающей, нет свидетельств предракового характера НПМ.
Лабораторная диагностика часто не приносит результатов. В работе F. C. Burkhard et al. (2004) только у 15 % больных был выявлен инфекционный возбудитель и у 30 % определялась лейкоцитурия. При цистоскопии выявляются белесоватые очаги в шейке мочевого пузыря.
В случае сочетания НПМ с симптомами нижних мочевых путей необходимость локального лечения метаплазии остается спорной. Пациентки проходят длительную медикаментозную терапию, диагноз выставляется после смены множества антибактериальных препаратов, схем мочепузырных инстилляций и т. д. Тем не менее в ряде исследований показана высокая эффективность консервативного лечения. Так, среди пациентов с клинически диагностированной лейкоплакией была отмечена эффективность доксициклина (отсутствие или уменьшение симптомов) в 71 % случаев (F. C. Burkhard et al., 2004). Авторы подчеркнули роль хронической инфекции и необходимость лечения полового партнера, который может быть бессимптомным носителем.
Тактика наблюдения за пациентами при НПМ заключается в периодических цистоскопиях с биопсией слизистой или без нее, так как отмечаются случаи сочетания ороговевающих и неороговевающих участков у одного пациента (A. Kasianandan et al., 2012).
Методы лечения и прогноз
Таким образом, КПМ считается предраковым состоянием, при котором необходимо тщательное наблюдение вследствие вероятного злокачественного потенциала и возможных последствий прогрессирования кератинизации мочевого пузыря. При ограниченном по объему поражении наиболее эффективным методом лечения на сегодняшний день считается трансуретральная резекция. НПМ относится к одному из вариантов нормального строения уротелия и развивается в результате гормональных изменений в организме, не является предраковым состоянием и не требует хирургического лечения.
Основной вопрос, вызывающий дискуссии у большинства авторов, – это возможная связь стойкой дизурии у женщин с очагами НПМ. К настоящему моменту убедительных доказательств такой связи нет. Пациенткам с очагами НПМ необходимо тщательное уродинамическое обследование и, возможно, лечение гиперактивности мочевого пузыря. Доказательств эффективности купирования дизурии при локальном инвазивном лечении очагов НПМ не выявлено.
Юрий Владиславович Кудрявцев Д.м.н., врач-патологоанатом, проф. кафедры патологической анатомии ПМГМУ им. И. М. Сеченова, зав. патологоанатомическим отделением Госпиталя для ветеранов войн № 2 kuv50@mail.ru |
Проблема плоскоклеточной метаплазии уротелия является недостаточно изученной. Так, существуют некоторые разногласия в понимании процессов трансформации слизистой оболочки, их классификации, остаются открытыми вопросы диагностики и прогноза. Важные акценты по данной теме расставил д.м.н., проф. кафедры патологической анатомии Первого МГМУ им. И. М. Сеченова Юрий Владиславович Кудрявцев.
– Среди специалистов существуют разногласия в понимании термина «лейкоплакия» и соответствующих процессов в уротелии. Одни ученые рассматривают метаплазию в целом, представляя некератинизирующую плоскоклеточную ме та плазию (НПМ) и кератинизирующую плоскоклеточную ме та плазию (КПМ) в качестве последовательных стадий одного процесса. По мнению других исследователей, НПМ является вариантом нормальной слизистой, не имеющим клинической значимости, а к лейкоплакии следует относить только КПМ. Какова Ваша точка зрения на эту проблему?
– Говоря о лейкоплакии, мы всегда имеем в виду исключительно плоскоклеточную метаплазию, и не более того. Это состояние относится к группе общепатологических (компенсаторно-приспособительных) процессов и является ответной реакцией на изменяющиеся условия внешней среды (относительно клеточного пула, но не макроорганизма).
– О каких условиях идет речь?
– Это могут быть бактериурия, изменение pH мочи, хроническое воспаление, склероз, гормональный дисбаланс, конкременты, раздражающие и травмирующие слизистую оболочку, и т. д. Важно отметить, что мы говорим о стадийности единого процесса. Сначала развивается неороговевающая форма плоскоклеточной метаплазии, потом – ороговевающая (т. е. собственно лейкоплакия), далее крайняя степень гиперкератоза – сквамозный, другими словами, слущивающийся вариант.
– Ранее даже употреблялся термин «эпидермизация» применительно к слизистой оболочке мочевого пузыря, не так ли?
– Да, при микроскопии наблюдаются клетки, напоминающие кожный покров. После увеличения количества клеточных элементов (гиперплазии) происходит их уплощение и вытяжение параллельно базальной мембране (трансформация переходного эпителия или уротелия в плоскоклеточный); затем начинается активный синтез кератина, и можно обнаружить кератогиалин либо внутри клеток (некератинизирующая метаплазия), либо вне клеток (кератинизирующая метаплазия).
– Что можно увидеть при эндоскопии?
– Выявляется либо очаг белесоватого цвета, либо большое количество чешуек во взвешенном состоянии, что иногда называют «фибринозным циститом». Слущивающиеся пластинки при гиперкератозе дают видимость плавающих белесоватых структур в моче.
– Что Вы можете сказать о лабораторной диагностике?
– Лабораторной диагностики метаплазии не существует. Проводятся только цистоскопия и гистологическое исследование. Цистоскопия информативна лишь в стадии ороговения.
– Во всех ли случаях при подозрении на лейкоплакию уротелия (при цистоскопическом исследовании) показана биопсия? Как Вы к ней относитесь?
– Да, биопсия показана во всех случаях и всегда. Она нужна прежде всего для исключения фокусов дисплазии в очаге лейкоплакии. Отношение к биопсии положительное.
– Какое место отводится неопластическим процессам в описанной Вами системе?
– Любое неадекватное воздействие приводит к соответствующей реакции со стороны мочевого пузыря (его слизистой оболочки). Данный компенсаторно-приспособительный процесс выражается в гиперплазии (сначала очаговой, затем – тотальной или диффузной). После этого процесс может развиваться в двух направлениях. Первый путь – слизистая оболочка приспосабливается к повреждающему фактору, т. е. развивается плоскоклеточная метаплазия. Второй путь – слизистая оболочка трансформируется в сторону дисплазии, что, в свою очередь, приводит через 1-3 стадии дифференцировки к карциноме in situ и в конечном итоге к инфильтративному раку.
– На какой стадии метаплазии может произойти инициация диспластического процесса?
– На фоне метаплазии, безусловно, может возникнуть диспластический процесс; более того, неопластические процессы могут наблюдаться как при КПМ, так и при НПМ.
– У многих здоровых женщин может быть выявлена плоскоклеточная метаплазия. При этом зачастую говорится о необходимо сти ее лечения как предракового состояния мочевого пузыря. Что, на Ваш взгляд, является патологией и вариантом нормы?
– Плоскоклеточная метаплазия в любом случае – патология. Но при этом абсолютно неправильно говорить, что лейкоплакия или плоскоклеточная метаплазия в целом являются предраковыми состояниями. Они представляют лишь способ существования слизистой оболочки – протективный механизм.
– В чем суть этого явления?
– К примеру, рассмотрим вариант со склеротическими изменениями подслизистого слоя собственной пластинки. Они приводят к неадекватному питанию слизистой оболочки в силу нарушений механизмов доставки питательных веществ. Как следствие, слизистая оболочка переходит на энергетически менее затратный способ существования – из уротелия возникает плоскоклеточный эпителий (напомним, что метаплазия – это развитие другой ткани в рамках одного гистогенетического ростка).
– В чем, с Вашей точки зрения, должно заключаться лечение?
– Терапия должна быть направлена на активный поиск и ликвидацию причины, вызвавшей метаплазию, но отнюдь не на сам эпителий. Более того, стоит убрать раздражающий фактор – и все вернется в нормальное состояние, включая диспластические процессы. Наш ведущий онкоморфолог Дмитрий Иванович Головин еще в начале 1970-х годов говорил, что карцинома in situ обратима (в отличие от инфильтративного рака, когда разрушена базальная мембрана).
– Исходя из этой логики, подлежат ли участки лейкоплакии радикальному удалению?
– Нет, не подлежат.
– Постановка диагноза метаплазии (особенно при сочетании с симптомами нижних мочевых путей) часто происходит после смены различных антибактериальных препаратов (что приводит к формированию резистентности микрофлоры и т. д.). Какова, на Ваш взгляд, роль инфекционных возбудителей в развитии метаплазии? Какое влияние антибактериальная терапия оказывает на трансформированную слизистую оболочку?
слизистую оболочку? – Инфекционный возбудитель – это лишь один из травмирующих факторов, с которым нужно бороться. Грамотная антибактериальная терапия эффективна в рамках воздействия на конкретного возбудителя и влияет на него, а не на трансформированную слизистую оболочку. На мой взгляд, наиболее опасную роль в развитии плоскоклеточной метаплазии играют внутриклеточные паразиты (хламидии, уреаплазма и т. д.), инициирующие скрытый, вялотекущий, малозаметный воспалительный процесс, который сложно увидеть и распознать.
– Что Вы думаете о применении различных маркеров в диагностике и определении прогноза метаплазии?
– Метаплазия – это изменение типа ткани. И наша задача – доказать, что это не порок развития, т. е. не эмбриопатия. Для этого мы применяем любой иммуногистохимический маркер переходного эпителия (из которого под внешним воздействием, путем трансформации, возникает плоский эпителий). Если мы хотим доказать факт начала диспластического процесса (путь малигнизации), нужно сопоставить маркеры апоптоза и пролиферации (p53 и Ki-67). При этом снижение p53 говорит о слабой ингибиции онкогенов (их дестабилизации), но не о наличии карциномы как таковой; рост Ki-67 говорит о высокой степени репродукции ДНК, что не всегда связано с озлокачествлением (а, например, может характеризовать процессы репарации).
– Могут ли встречаться случаи сочетания ороговевающих и неороговевающих участков у одного пациента?
– Да, такие случаи встречаются, и достаточно часто; метаплазия может носить как очаговый, так и диффузный характер; при этом, как правило, присутствует гетерогенность изменений.
Беседовал Андрей Трофименко
Источник
