Свойства гладких мышц мочевого пузыря
Мышечные ткани – это ткани, для которых способность к сокращению является главным свойством. Мышечные ткани составляют активную часть опорно-двигательного аппарата (пассивной частью являются кости, соединения костей).
Общими свойствами всех мышечных тканей является сократимость и возбудимость. К данной группе тканей относятся гладкая, поперечнополосатая скелетная и поперечнополосатая сердечная мышечные ткани. Клетки мышечной ткани имеют хорошо развитый цитоскелет, содержат много митохондрий.
Гладкая (висцеральная) мускулатура
Эта мышечная ткань встречается в стенках внутренних органах (бронхи, кишечник, желудок, мочевой пузырь), в стенках сосудов, протоках желез. Эволюционно является наиболее древним видом мускулатуры.
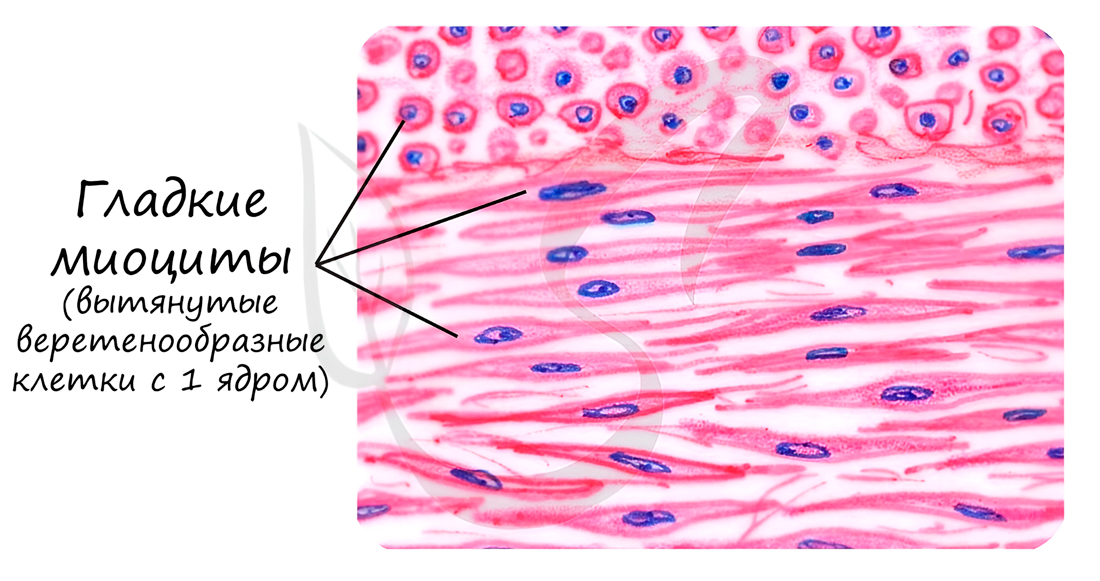
Состоит из веретенообразных миоцитов – коротких одноядерных клеток. Между клетками имеются межклеточные контакты – нексусы (лат. nexus – связь). Благодаря нексусам возбуждение, возникшее в одной клетке, волнообразно распространяется на все остальные клетки.
Гладкая мышечная ткань отличается своей способностью к длительному тоническому напряжению, что очень важно для работы внутренних органов (к примеру мочевого пузыря), сокращается медленно, практически не утомляется. Скелетная мышечная ткань, которую мы изучим чуть позже, такой способностью не обладает – сокращается и утомляется быстро.
Осуществляется сокращение с помощью клеточных органоидов – миофиламентов, которые расположены в клетке хаотично и не имеют такой упорядоченной структуры, как миофибриллы в скелетной мускулатуре (все познается в сравнении, уже скоро мы их тоже изучим).
Особо заметим, что в гладкой мышечной ткани миофиламенты собираются в миофибриллы только во время сокращения. У таких временных миофибрилл не может быть регулярной организации, а значит ни у таких миофибрилл, ни у гладких миоцитов не может быть поперечной исчерченности.
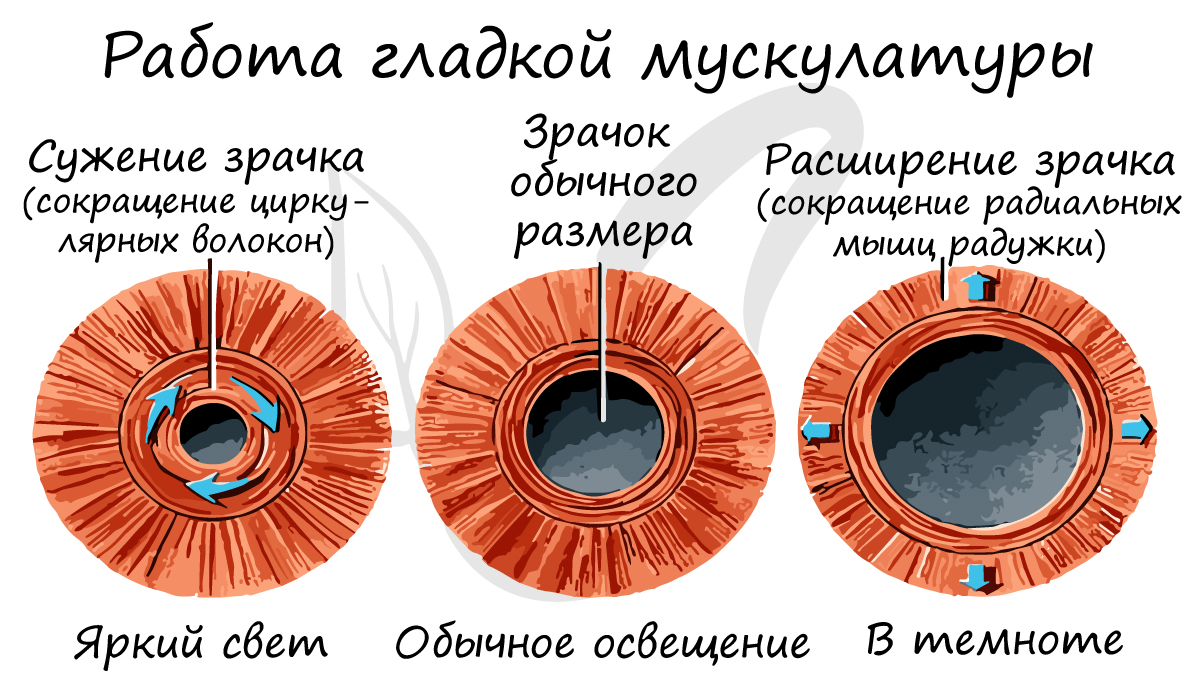
Гладкая мышечная ткань сокращается непроизвольно (неподвластна воле человека). Работа гладких мышц обеспечивается вегетативной (автономной) нервной системой. К примеру невозможно по желанию сузить или расширить бронхи, кровеносные сосуды, зрачок.
Гладкая мышечная ткань называется неисчерченной, так как не обладает поперечной исчерченностью, характерной для поперечнополосатых скелетной и сердечной мышечных тканей.
Скелетная (поперечнополосатая) мышечная ткань
Скелетная мышечная ткань образует диафрагму (дыхательную мышцу), мускулатуру туловища, конечностей, головы, голосовых связок.
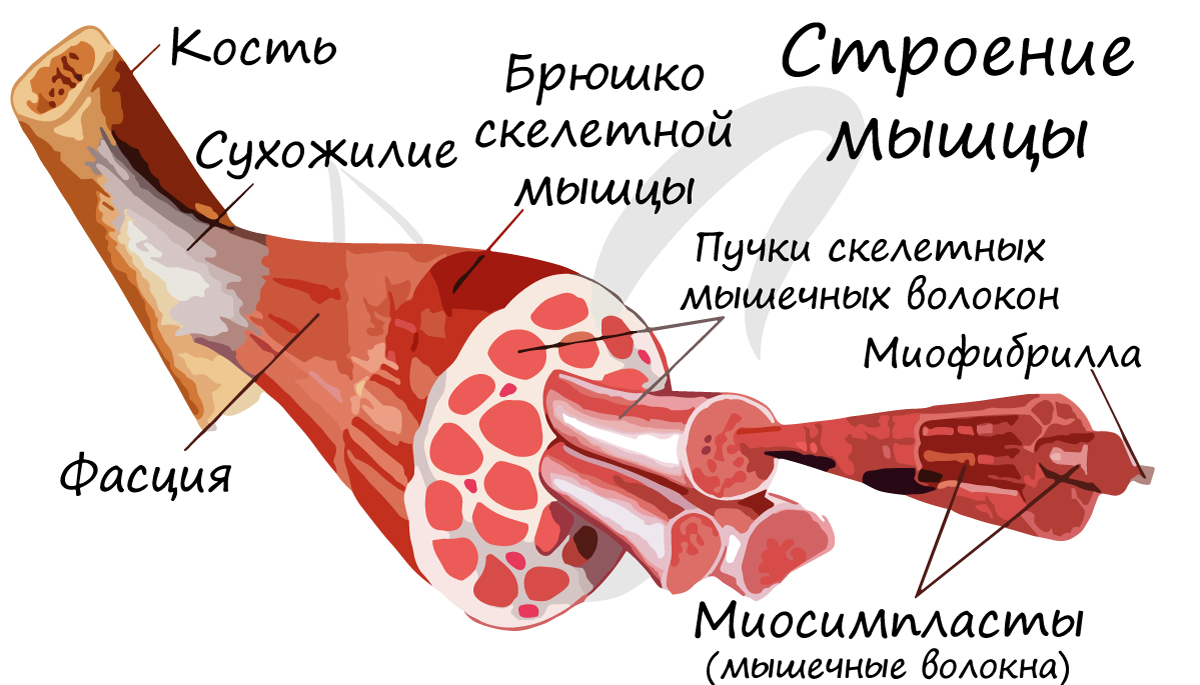
В отличие от гладкой мускулатуры, скелетная образована не отдельными одноядерными клетками, а длинными многоядерными волокнами, имеющими до 100 и более ядер – миосимпластами. Миосимпласт (греч. sim – вместе + plast – образованный) представляет совокупность слившихся клеток, имеет длину от нескольких миллиметров до нескольких сантиметров (соответствует длине мышцы).
Внутри миосимпласта находится саркоплазма, снаружи миосимпласт покрыт сарколеммой. Сократительные элементы – миофибриллы (лат. fibra – волоконце) – длинные тяжеобразные органеллы в миосимпласте (около 1400).
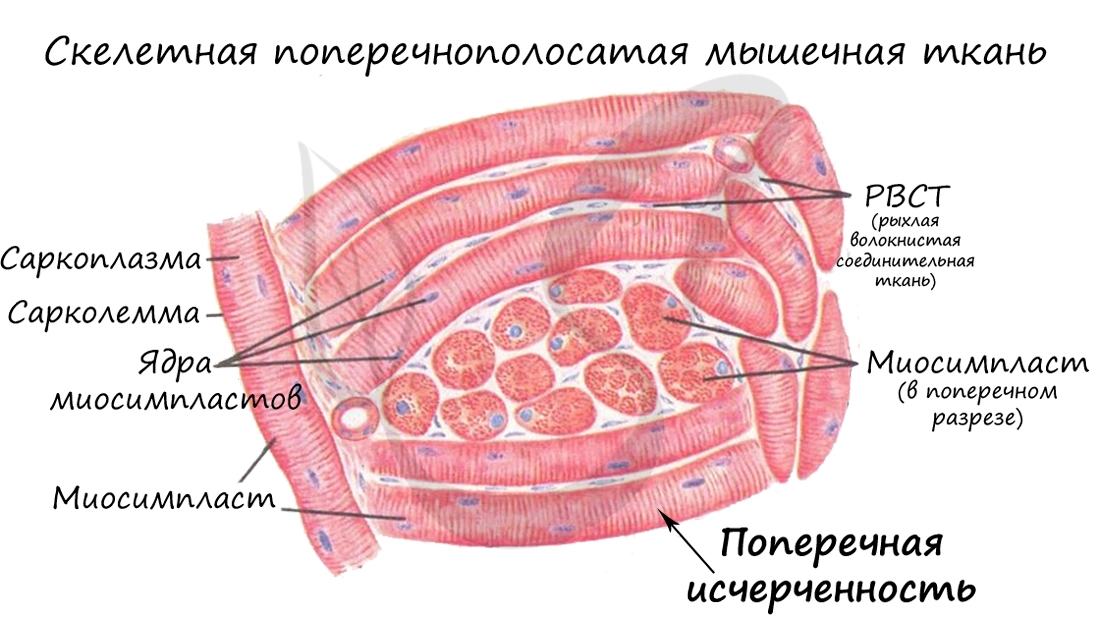
Характерная черта данной ткани – поперечная исчерченность, выражающаяся в равномерном чередовании светлых и темных полос на мышечном волокне. Это происходит потому, что границы саркомеров в соседних миофибриллах совпадают, вследствие чего все волокно приобретает поперечную исчерченность. Теперь самое время изучить микроскопическую основу мышцы – саркомер.
Саркомер (от греч. sarco – мясо (мышца) + mere – маленький)
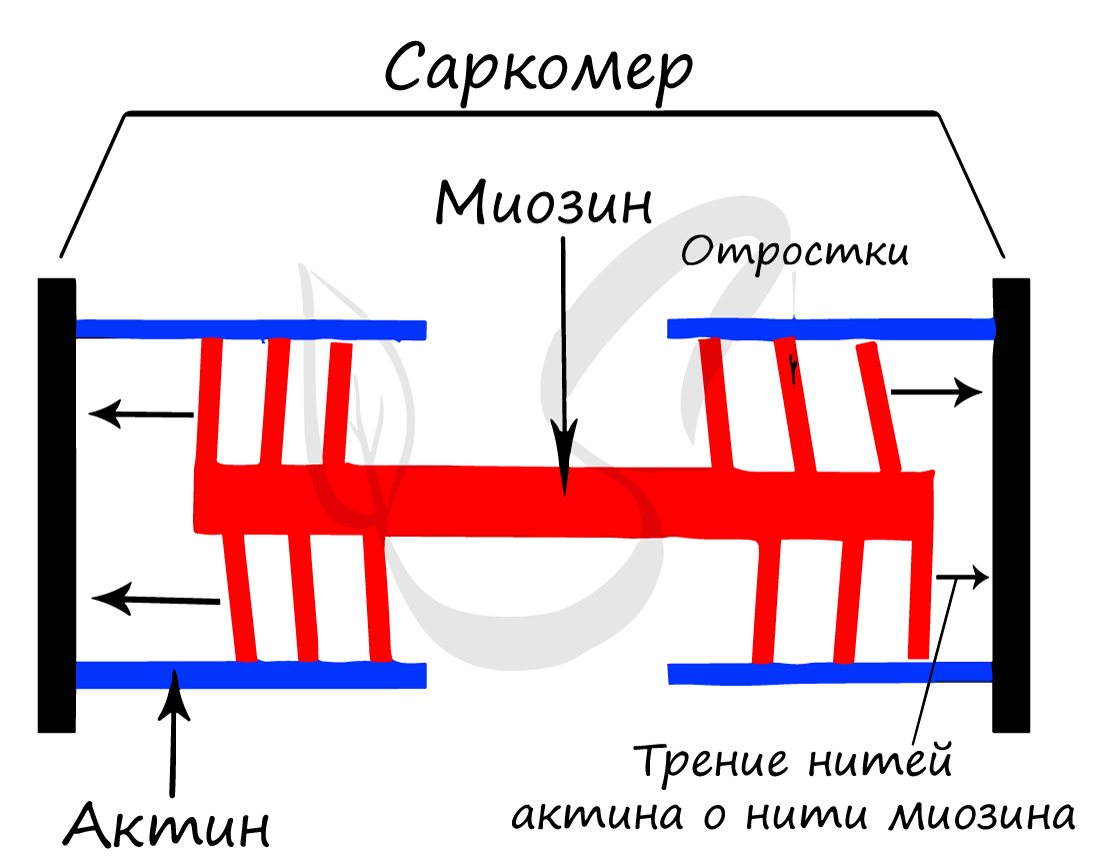
Саркомер – элементарная сократительная единица поперечнополосатых мышц, структурная единица миофибриллы. В состав саркомера (и миофибриллы в целом) входят миофиламенты (лат. filamentum – нить) двух типов, которые обеспечивают сократимость мышечной ткани.
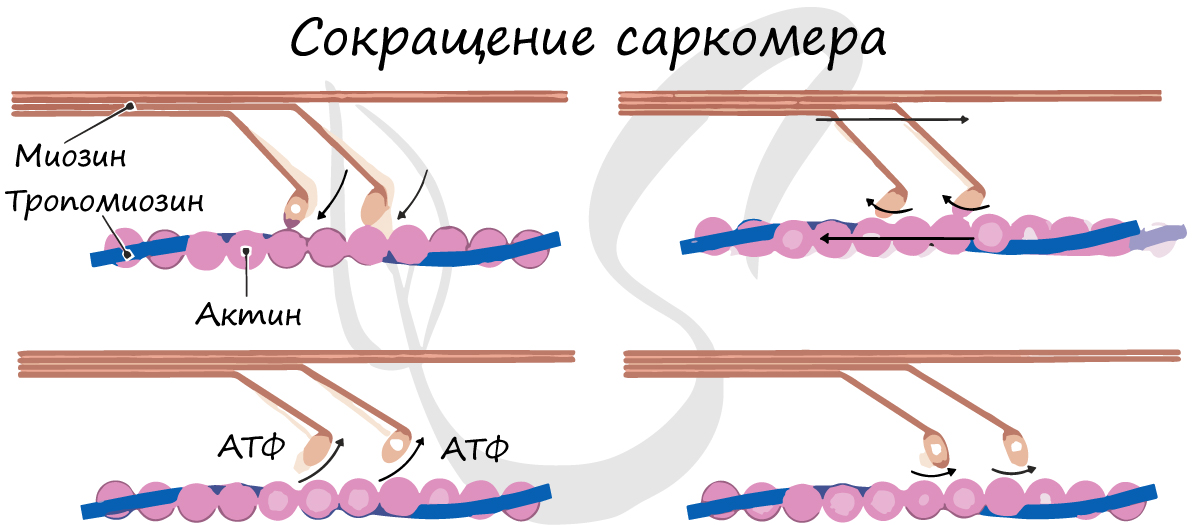
Саркомер состоит из актиновых (тонких) и миозиновых (толстых) филаментов, которые образованы главным образом белками актином и миозином. Сокращение происходит за счет взаимного перемещения миофиламентов: они тянутся навстречу друг другу, саркомер укорачивается (и мышца в целом).
Источником энергии для сокращения служат молекулы АТФ. К тому же невозможно представить сокращение мышц без участия ионов кальция: именно они связываются с тропонином, что приводит к изменению конформации тропомиозина (тропонин и тропомиозин – регуляторные белки между нитями актина), за счет чего становится возможно соединение актина и миозина. При сокращении мышц выделяется тепло (сократительный термогенез).
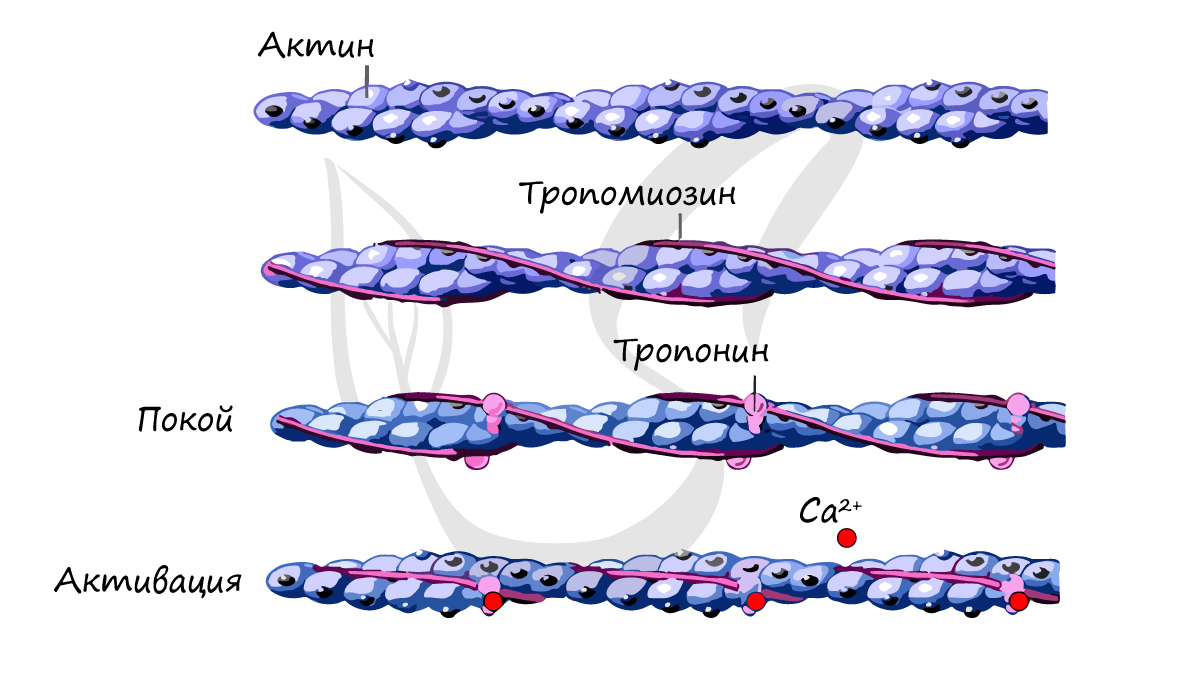
Замечу, что трупное окоченение (лат. rigor mortis) – посмертное затвердевание мышц – связано именно с ионами кальция, которые устремляются в область низкой концентрации (в саркоплазму миосимпласта), способствуя связыванию актина и миозина.
После смерти в мышце перестает синтезироваться АТФ, ее уровень быстро снижается. Как следствие этого перестает функционировать Ca-АТФаза – насос, выкачивающий ионы Ca из саркоплазмы в саркоплазматический ретикулум (мембранная органелла мышечных клеток (сходная с ЭПС), в которой запасаются ионы Ca).
В саркоплазме повышается концентрация ионов Ca – замыкаются мостики между актином и миозином, однако разомкнуться они уже не могут, в связи с чем наблюдается стойкая мышечная контрактура (лат. contractura – стягивание, сужение): конечности очень сложно разогнуть или согнуть.
Вернемся к скелетным мышцам. Имеется еще ряд важных моментов, о которых нужно знать.
В процесс возбуждения вовлекается изолированно один миосимпласт, соседние миосимпласты (волокна) не возбуждают друг друга, в отличие от гладких миоцитов, где возбуждение предается между соседними клетками через нексусы. Скелетные мышцы сокращаются быстро и быстро утомляются (у гладких мышц фазы сокращения и расслабления растянуты во времени, мало утомляются) .
Скелетные мышцы сокращаются произвольно: они подконтрольны нашему сознанию. К примеру, по желанию мы можем изменить скорость движения руки, темп бега, силу прыжка. Мышцы покрыты фасцией, крепятся к костям сухожилиями, и, сокращаясь, приводят в движение суставы.

Сердечная поперечнополосатая мышечная ткань
Сердечная мышечная ткань образует мышечную оболочку сердца – миокард (от др.-греч. μῦς «мышца» + καρδία – «сердце»). Миокард – средний слой сердца, составляющий основную часть его массы. При работе сердечная мышечная ткань не утомляется.
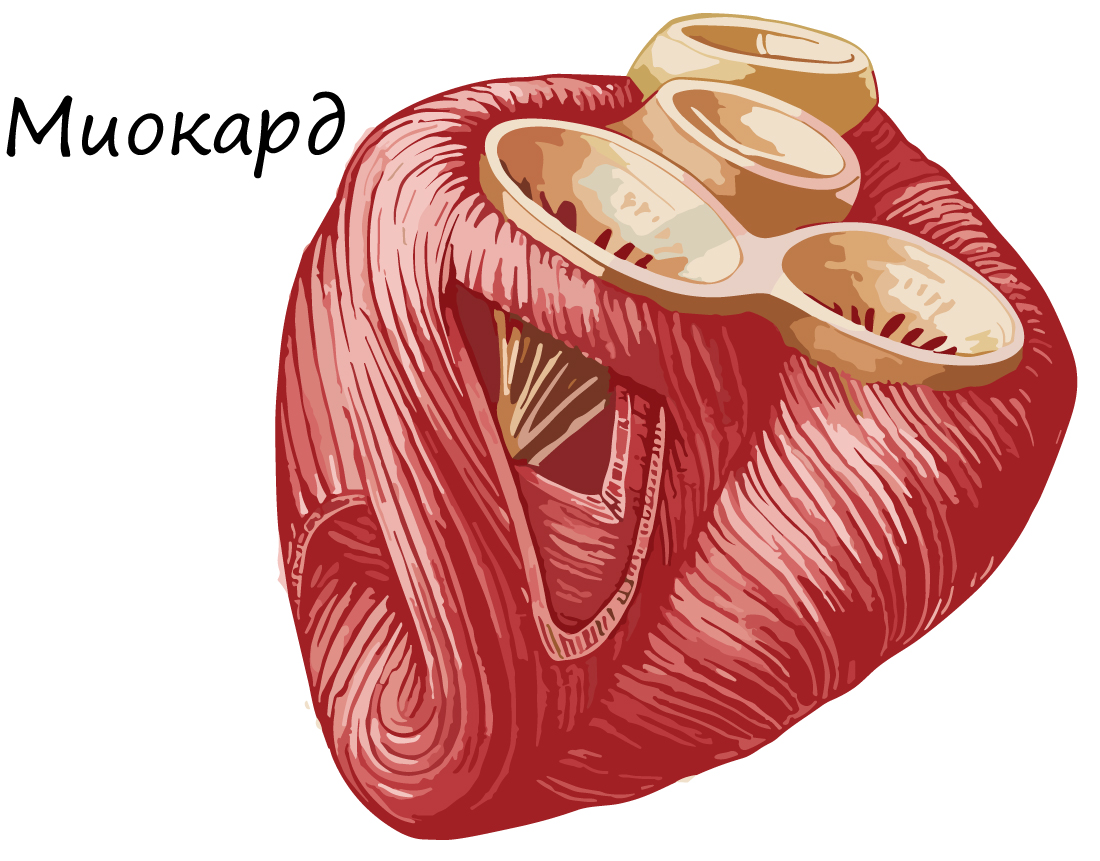
Сердечная мышечная ткань состоит из кардиомиоцитов – одиночных клеток, имеющих поперечную исчерченность. Соединяясь друг с другом, кардиомиоциты образуют функциональные волокна.
Этот тип мышечной ткани удивительным образом сочетает свойства двух предыдущих, изученных нами, тканей (возбудимость, сократимость) и имеет одно новое уникальное свойство – автоматизм.
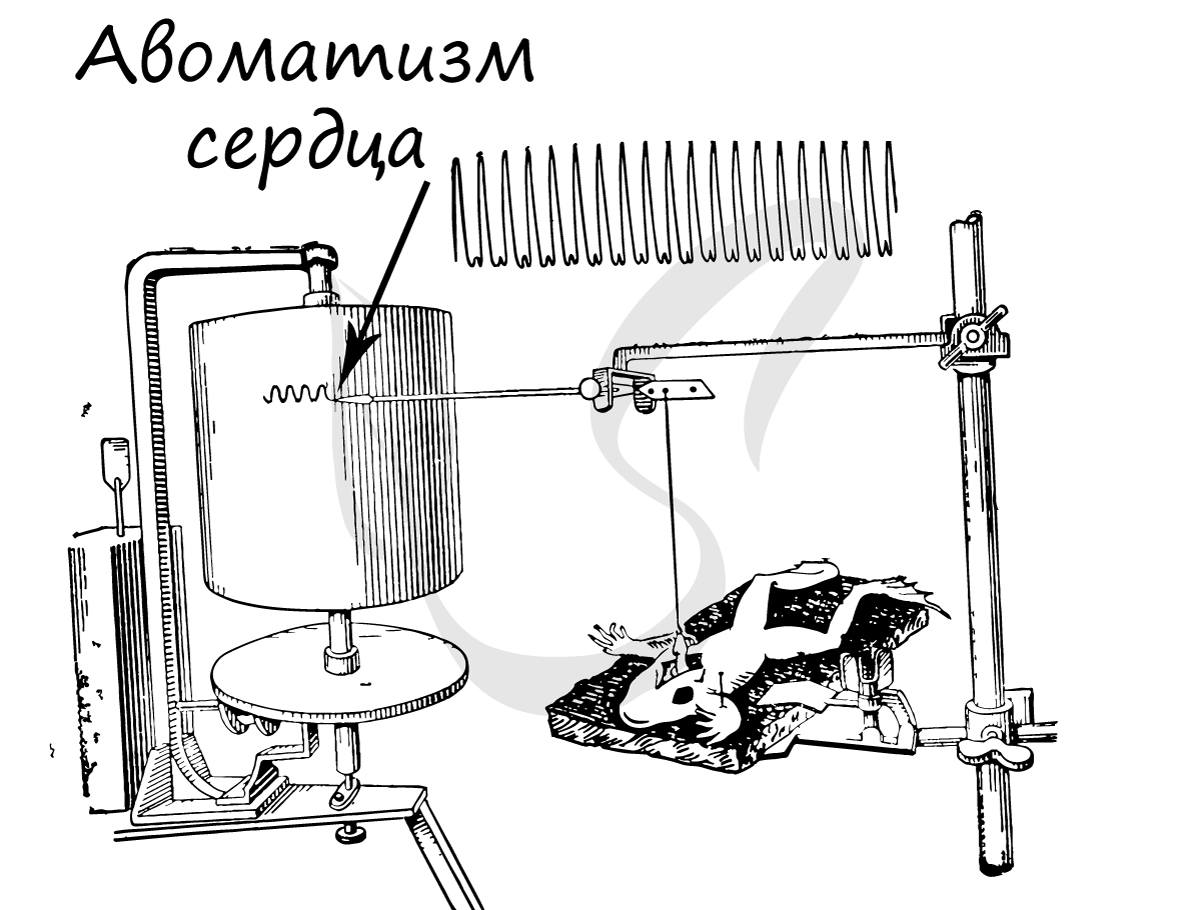
Автоматизм – способность сердечной мышечной ткани возбуждаться и сокращаться самопроизвольно, без влияний извне. Это легко можно подтвердить, наблюдая сокращения изолированного сердца лягушки в физиологическом растворе: сокращения сердца в нем будут продолжаться несколько десятков минут после отделения сердца от организма.
Места контактов соседних кардиомиоцитов – вставочные диски (в их составе находятся нексусы), благодаря которым возбуждение одной клетки передается на соседние, таким образом волнообразно охватываются возбуждением и сокращаются новые участки миокарда.
Большое число контактов между кардиомиоцитами обеспечивает высокую эффективность и надежность проведения возбуждения по миокарду. Сокращается эта ткань непроизвольно, не утомляется.
На рисунке или микропрепарате узнать данную ткань можно по центральному положению ядер в клетках, поперечной исчерченности, наличию вставочных дисков и анастомозов (греч. anastomosis – отверстие) – мест соединений боковых поверхностей функциональных волокон (кардиомиоцитов).

В норме возбуждение проводится по проводящей системе сердца от предсердий к желудочкам (однонаправленно). Участок сердечной мышцы, в котором генерируются импульсы, определяющие частоту сердечных сокращений – водитель сердечного ритма.
Автоматизм возможен благодаря наличию в миокарде особых пейсмекерных (англ. pacemaker – задающий ритм) клеток, которые также называют водителями ритма. Они спонтанно генерируют нервные импульсы, которые охватывают весь миокард, в результате чего осуществляется сокращение. Именно благодаря водителям ритма сердце лягушки продолжает биться, будучи полностью отделенным от тела.
Ответ мышц на физическую нагрузку
Физические нагрузки приводят к гипертрофии мышц (от др.-греч. ὑπερ- чрез, слишком + τροφή – еда, пища) – в них увеличивается количество мышечных волокон, объем мышечной массы нарастает.

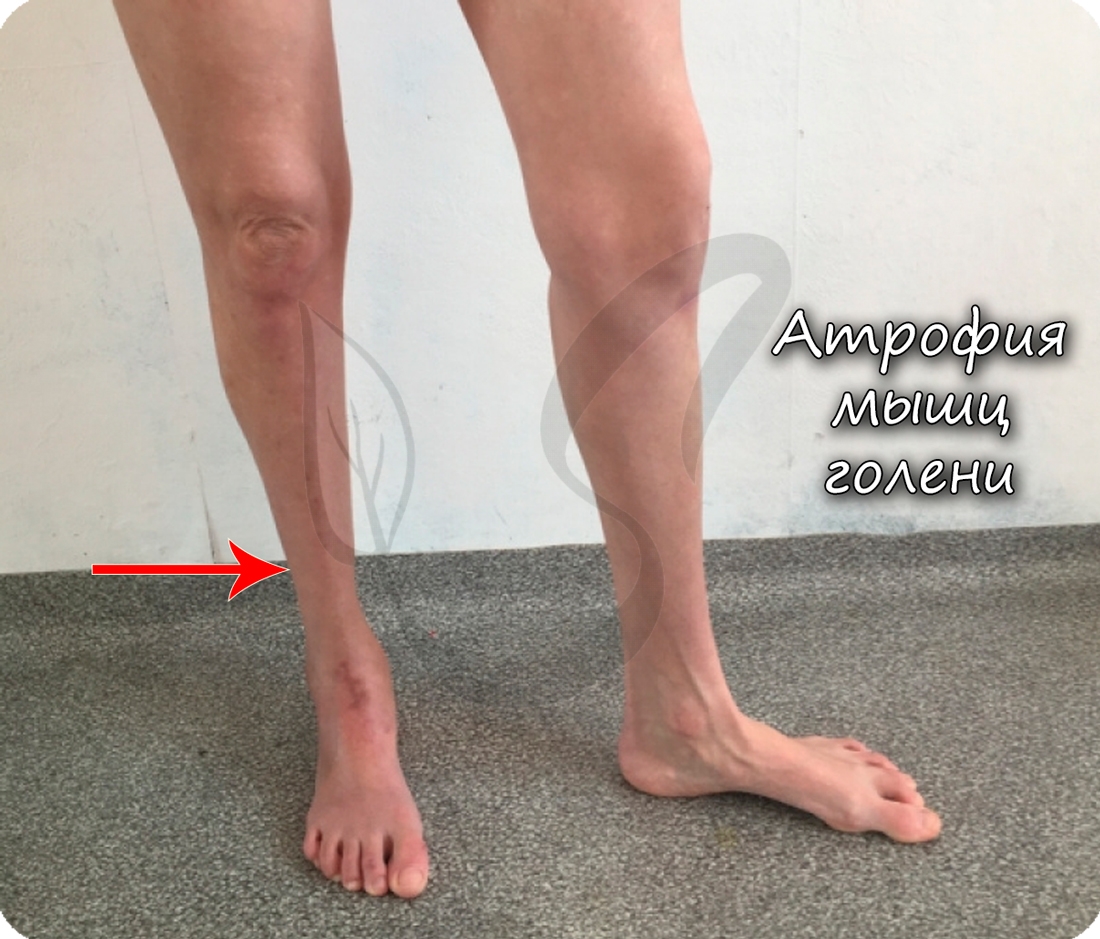
В условиях гиподинамии (от греч. ὑπό – под и δύνᾰμις – сила), то есть пониженной активности, мышцы уменьшаются вплоть до полной атрофии (греч. а – “не” + trophe – питание). В худшем случае волокна мышечной ткани перерождаются в соединительную ткань, после чего пациент становится обездвиженным.
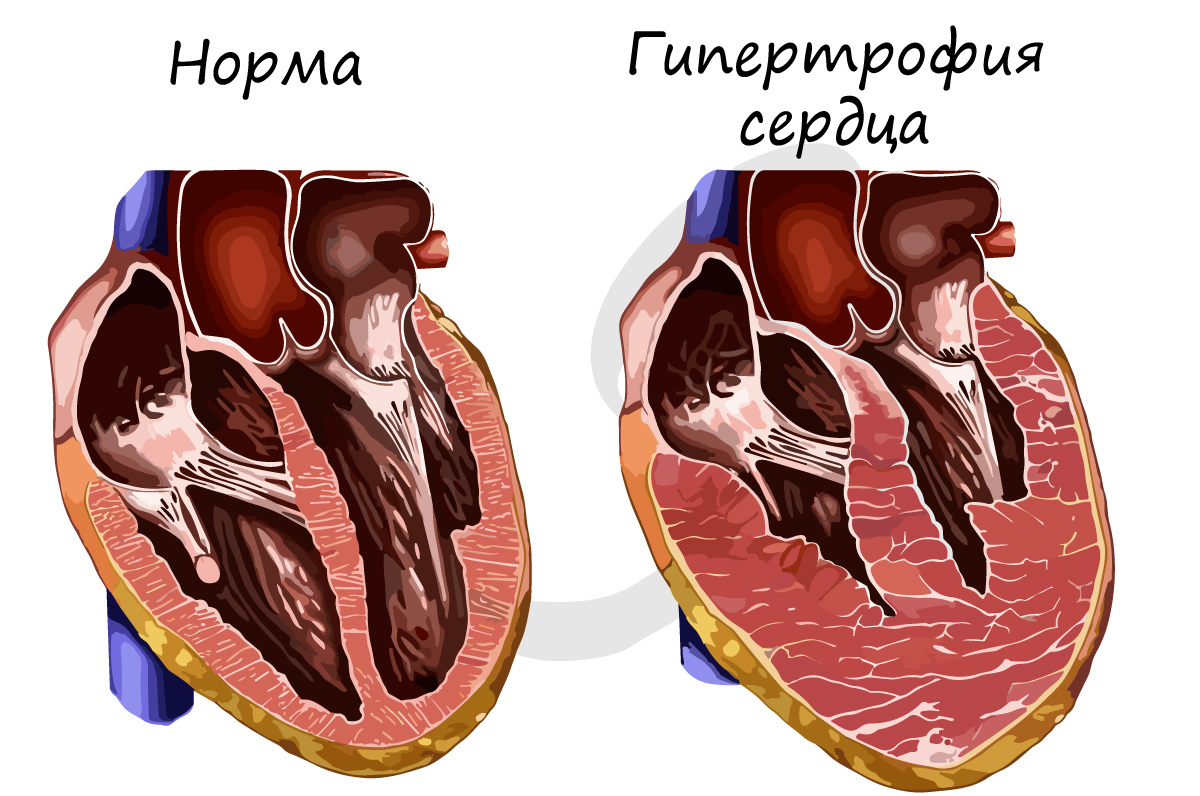
Необходимо отметить, что сердечная мышечная ткань также дает ответную реакцию на чрезмерную нагрузку: сердце увеличивается в размере, нарастает масса миокарда. Причиной могут быть генетические заболевания, повышенное артериальное давление. Гипертрофия сердца – состояние, требующее вмешательства врача и наблюдения за пациентом.
В большинстве случае гипертрофия сердца обратима, а у спортсменов наблюдается так называемая физиологическая гипертрофия (вариант нормы).
Происхождение мышц
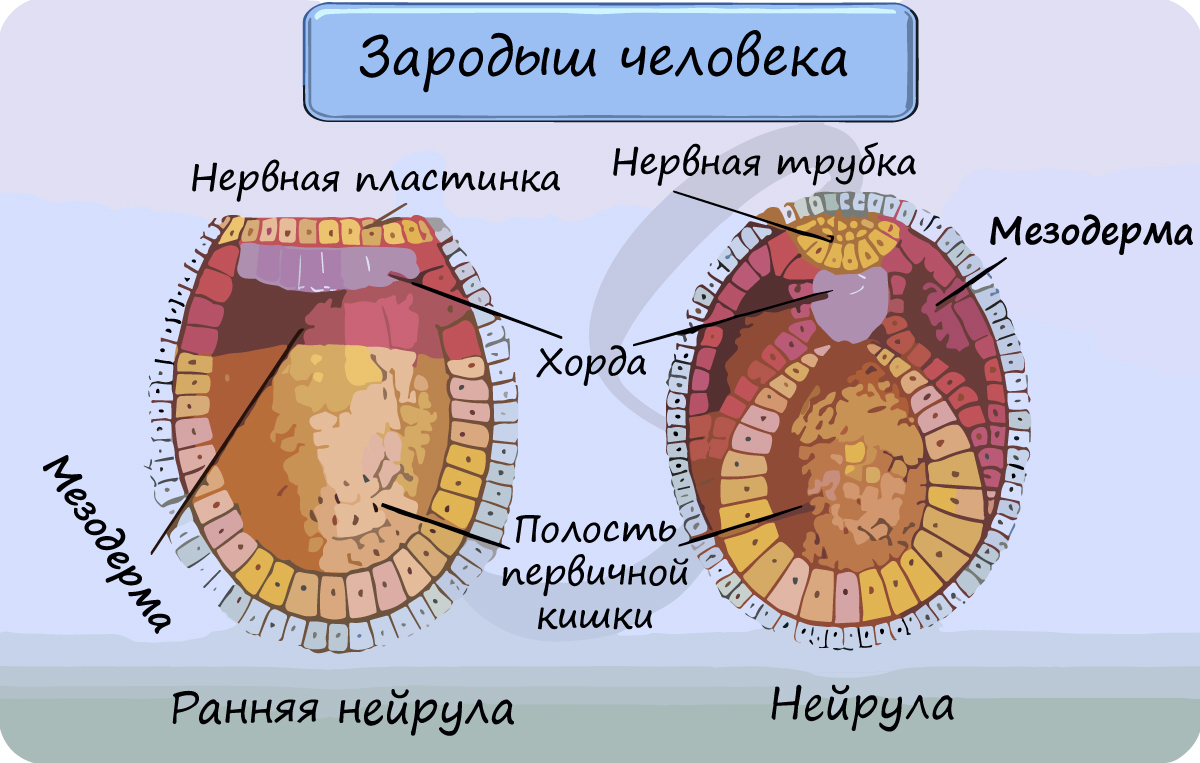
Мышцы развиваются из среднего зародышевого листка – мезодермы.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.

Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения – основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря – это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры – это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций – у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Proe Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры – центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи – с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи – с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата – ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением – расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5-2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора – к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3-8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва
Источник
