Склероз мочевого пузыря таблетки
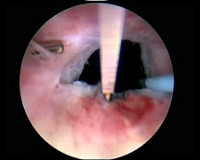
Склероз шейки мочевого пузыря – это рубцовая деформация уретро-везикального перехода, обусловленная травматическими воздействиями, воспалительными процессами. Проявляется затруднением мочеиспускания, вялостью струи мочи, дизурическими явлениями. Диагностируется при помощи урофлоуметрии, ретроградной и микционной уретрографии, УЗИ мочевыводящих органов, МСКТ цистоуретрографии, задней уретроскопии, цистоскопии. Лечится оперативно путем трансуретральной резекции склерозированного участка. Хирургическое вмешательство дополняют антибактериальной и противовоспалительной терапией, при выраженной обструкции или обтурации предваряют эпицистостомией.
Общие сведения
По результатам исследований в сфере клинической урологии, склеротическая деформация с сужением просвета мочепузырно-уретрального сегмента выявляется у 0,4-1,5% пациентов, перенесших операцию по поводу доброкачественной гиперплазии простаты. Менее распространены случаи заболевания, обусловленные другими причинами. Вероятность развития склероза зависит от способа выполнения аденомэктомии. Реже всего рубцовая деформация возникает после ТУР гольмиевым лазером и биполярной плазменно-кинетической резекции, чаще всего – после чрезпузырной аденомэктомии. Обычно заболевание диагностируют у мужчин в возрасте после 45 лет, идиопатическая врожденная форма болезни может проявляться даже у младенцев.

Склероз шейки мочевого пузыря
Причины
Заболевание имеет полиэтиологическую основу, может быть как приобретенным, так и врожденным. Склеротические процессы в области шейки пузыря обычно вторичны, развиваются на фоне другой урологической патологии или под действием различных повреждающих факторов. Непосредственными причинами возникновения склероза в зоне мочепузырного треугольника являются:
- Хирургическое лечение урологических заболеваний. Обычно склеротические изменения выявляются у пациентов, перенесших открытые и эндоскопические операции по поводу аденомы предстательной железы. Реже интенсивное склерозирование начинается после лучевой терапии рака мочевого пузыря или простаты.
- Воспаление органов мочевыделительной системы. Вероятность склероза в области мочепузырно-уретра льного перехода увеличивается при хронических простатитах и циститах. В таких случаях регенеративная фаза воспаления принимает патологический характер, в пораженных участках формируется плотная соединительная ткань.
- Дизэмбриогенез. Идиопатическая форма склероза мочепузырной шейки носит название болезни Мариона. Патология встречается редко, характеризуется кольцевидным фиброзом подслизистого и мускульного слоев на выходе из мочевого пузыря. Факторы, способствующие возникновению врожденного склероза, пока не установлены.
Анатомической предпосылкой к развитию заболевания являются особенности строения стенки пузыря в области мочепузырного треугольника. Соединительная ткань собственной пластинки под уротелием этой зоны отличается меньшей рыхлостью, из-за чего слизистая оболочка менее растяжима и практически не имеет складок. В результате склеротические изменения плохо компенсируются и быстро проявляются клинически.
Патогенез
Механизм склерозирования шейки мочевого пузыря основан на чрезмерном разрастании соединительнотканных элементов при патологической регенерации поврежденных тканей. Как правило, предрасполагающими факторами к появлению склеротических изменений являются нарушение энергетического метаболизма в стенке органа, локальная воспалительная реакция, клеточная дистрофия, микроциркуляторные нарушения, характерные для доброкачественной гиперплазии предстательной железы. Иногда процесс провоцируется действием прямых повреждающих факторов (операционной травмы, лучевого излучения).
Склероз мочепузырной стенки формируется поэтапно. Сначала после фагоцитоза разрушенных клеток и коллагеновых волокон макрофагами в зоне повреждения происходит активная пролиферация фибробластов, усиливается синтез коллагена. В условиях ишемии, посттравматического воспаления, дисциркуляторных явлений нарушается баланс между коллагеногенезом и коллагенолизисом с нарастанием избытка соединительной ткани, преобладанием массы волокон над клеточными элементами, уменьшением количества специализированных клеток. В результате шейка мочевого пузыря подвергается фиброзированию, склерозированию или рубцеванию с частичным сужением (стриктурой) или полным перекрытием (облитерацией) просвета, что проявляется соответствующей клинической картиной.
Симптомы
Основным клиническим признаком заболевания является нарастающее ухудшение оттока мочи вплоть до ее полной острой задержки. На начальных этапах патологического процесса пациенты жалуются на затруднения при мочеиспускании, отмечают вялость мочевой струи. По мере прогрессирования склероза и увеличения количества остаточной мочи в полости органа у больных появляется ощущение неполного опорожнения мочевого пузыря. О присоединении воспаления свидетельствуют частые позывы к мочеиспусканию, болезненное отхождение мочи, повышение температуры тела до субфебрильных цифр.
Осложнения
Нарушение оттока мочи постепенно приводит к увеличению ее остаточного объема и застою в вышерасположенных органах мочевыделительной системы. В крайних случаях расширение мочеточников и чашечно-лоханочной системы завершается развитием двухстороннего уретерогидронефроза и хронической почечной недостаточности. Наличие пузырно-мочеточникового рефлюкса способствует восходящему распространению уроинфекций с возникновением уретерита, пиелонефрита.
На фоне мочепузырного застоя мочи чаще наблюдаются хронические циститы, могут сформироваться микродивертикулы. У некоторых пациентов происходит сморщивание мочевого пузыря. Длительное нарушение мочеиспускания способствует появлению невротических расстройств, депрессии, социальной дезадаптации пациентов.
Диагностика
Обследование мужчин с подозрением на склероз шейки мочевого пузыря включает инструментальные методы, позволяющие выявить признаки сужения участка пузырно-уретрального перехода, исключив другие причины обструкции. Важную роль в диагностическом поиске играет связь патологического процесса с проведенной операцией на простате, лучевой терапией тазовых органов, урологическими инфекциями. Наибольшей информативностью обладают:
- Уродинамические исследования. При сохраненном мочеиспускании пациентам обычно назначают урофлоуметрию. Длительное нарастание и уменьшение объемной скорости тока мочи подтверждает обструкцию нижних отделов мочевыделительной системы, однако не позволяет выявить точное место стеноза. Поэтому методика обычно предваряет проведение других инструментальных исследований.
- Уретрография. Рентгенологический метод дает возможность обнаружить препятствие току мочи в области перехода мочевого пузыря в уретру, при этом уретральный канал остается полностью проходимым. Чаще применяется ретроградная уретрография, визуализирующая заполнение мочеиспускательного канала рентген-контрастным раствором, реже – микционное исследование процесса мочевыделения.
- Эхография. С помощью УЗИ мочевого пузыря оценивают анатомические особенности строения органа, в том числе пузырно-уретрального сегмента, определяют его вместимость и объем остаточной мочи, который при склерозе шейки обычно превышает 20 мл. Дополнительное ультразвуковое исследование почек, мочеточников, простаты (при ее наличии), уретры позволяет установить другие причины нарушения мочеиспускания.
- Мультиспиральная компьютерная томография. МСКТ цистоуретрография, обеспечивающая создание трехмерной модели пораженной области – один из наиболее точных неинвазивных методов диагностики склероза. Используя МСКТ, можно точно определить место стриктуры нижних мочевыводящих путей, выраженность склеротических изменений, толщину стенки везикально-уретрального перехода.
- Эндоскопия. Визуализация пораженной области при уретроцистоскопии дает возможность не только выявить участок стриктуры, но и оценить состояние слизистой оболочки, степень рубцовых изменений. При достаточном для прохождения эндоскопа просвете шейки осматривается полость мочевого пузыря. Обследование может дополняться биопсией для гистологического исследования тканей.
Общий анализ мочи при склерозе мочепузырной шейки играет вспомогательную роль, направлен на выявление возможных сопутствующих воспалительных процессов. Заболевание дифференцируют с аденомой предстательной железы, ложным ходом из мочеиспускательного канала в мочевой пузырь, предпузырем мочевого пузыря, склерозом простаты, злокачественными и доброкачественными опухолями мочевого пузыря. По показаниям врач-уролог может назначить консультацию онколога, андролога.
Лечение склероза шейки мочевого пузыря
Эффективная консервативная терапия заболевания не предложена. Единственный метод восстановления проходимости уретро-везикального сегмента – хирургическое иссечение рубцовой ткани. Эффект от ликвидации стриктуры с помощью бужирования временный, проведение этого вмешательства зачастую приводит к возникновению различных осложнений.
На этапе предоперационной подготовки и в послеоперационном периоде пациенту проводится антибактериальная терапия для профилактики инфекционных осложнений. При наличии признаков воспаления и болевого синдрома возможно дополнительное назначение нестероидных противовоспалительных средств. Для быстрой разгрузки мочевыделительной системы при значительной обструкции шейки предварительно может выполняться открытая или троакарная эпицистостомия.
Наиболее эффективным и наименее травматичным вмешательством для восстановления нормального пассажа мочи является ТУР шейки мочевого пузыря. При трансуретральной резекции склерозированные ткани полностью удаляются лазерными либо электрокоагуляционными ножами, что позволяет устранить обструкцию. Открытые инвазивные операции на мочепузырной шейке из-за травматичности и высокого риска осложнений в настоящее время практически не применяются.
Прогноз и профилактика
Эффективность хирургического лечения склеротической деформации мочепузырной шейки достигает 91%, однако при значительном сужении ее просвета возрастает риск послеоперационных рецидивов. Профилактика склероза направлена на адекватную своевременную терапию урологических заболеваний, щадящее выполнение аденомэктомии, других вмешательств на простате и мочевом пузыре. Для предотвращения рецидива обструкции после ТУР рекомендовано использование современных высокоэнергетичных генераторов, работающих в режиме менее травматичного биполярного резания и коагуляции.
Источник
Нейроурологические осложнения, как правило, сопровождают ряд заболеваний ЦНС, таких как врожденные поражения: сирингомиелия, сосудистые (инсульты), опухолевые, травматические и компрессионные (дискогенные миелопатии) виды неврологической патологии. К числу таких заболеваний относится и рассеянный склероз (РС), представляющий собой тяжелое демиелинизирующее аутоиммунное заболевание ЦНС, поражающее преимущественно генетически предрасположенных лиц молодого возраста (чаще женщин) и приводящее к стойкой инвалидизации.
Нарушения со стороны нижних мочевыводящих путей (НМВП) являются одними из наиболее типичных и распространенных проявлений РС и встречаются у 60-80% больных. Эти нарушения относятся к числу весьма тяжелых инвалидизирующих осложнений заболевания, существенными сторонами которых являются не только чисто медицинские, но и психологические и психические аспекты, резко ухудшающие быт и состояние больных, их трудовую деятельность и социальную активность.
Влияние РС на урогенитальный тракт в целом варьирует от мочепузырных дисфункций, сопровождающихся нарушением произвольного характера мочеиспускания, до импотенции.
Виды урологических нарушений при РС
К числу основных видов нарушений со стороны НМВП при РС относятся детрузорно-сфинктерная диссинергия (ДСД), арефлексия мочевого пузыря (АМП) и наиболее распространенная среди них гиперрефлексия детрузора мочевого пузыря (ГРД). Выраженность соответствующих этим нарушениям клинических симптомов в значительной мере зависит от уровня демиелинизирующих поражений белого вещества в ЦНС. Характер урологических нарушений со стороны НМВП отражает прежде всего анатомическую локализацию, а также количество и размеры демиелинизирующих бляшек в головном и спинном мозге.
При нарушении функционирования нижних мотонейронов, наблюдаемом при локализации процесса в сакральной области, развивается гипоконтрактильность детрузора и АМП, сопровождающаяся перерастяжением МП, его неполным опорожнением и часто – инфицированием остаточной мочи.
Недостаточность супраспинального подавления автономных сокращений мочевого пузыря (МП) при краниальном и надсакральном расположении РС-бляшек с вовлечением спинобульбоспинальных проводящих путей ведет к развитию ГРД, характеризующейся неспособностью удерживать даже незначительный объем мочи, частыми императивными позывами на мочеиспускание и недержанием мочи. У данной группы больных непроизвольное выделение небольшой порции мочи может возникать при физической нагрузке, кашле, чиханьи и др.
Недостаточность ретикуло-спинальной иннервации нередко вызывает нарушение синергии между наружным сфинктером уретры, образованным продольными мышцами, и детрузорной мышцей МП, а также неполную релаксацию и паралич сфинктера. Кроме того, указанные нарушения могут приводить к одновременному сокращению детрузора и наружного сфинктера – ДСД, проявляющейся клинически чувством неполного опорожнения МП, незавершенным мочеиспусканием или полной его задержкой, которая может приобретать хронический характер. К числу возможных осложнений ДСД относится появление остаточной мочи, ее инфицирование, развитие бактериального цистита и др.
Диагноз урологических нарушений при РС ставится на основании подробного анамнеза, клинических данных, а также результатов параклинических исследований и, прежде всего, урофлоуметрии.
Патофизиологические основы фармакотерапии
Консервативное лечение урологических нарушений у больных РС является основным видом медицинских мероприятий при данной патологии и чаще всего включает использование фармакологических средств (фармакотерапию), а также другие методы неоперативного лечения.
Применение лекарственных препаратов является в настоящее время ведущим среди других методов лечения урологических нарушений при РС. Использование средств различных фармакотерапевтических групп и разного механизма действия обусловлено как анатомо-физиологическими особенностями урогенитального тракта, прежде всего участием различных нейрогенных структур в его иннервации, так и патогенетическими особенностями развития отдельных форм урологических нарушений, наблюдаемых у больных РС. Наряду с разными группами нейротропных и миотропных лекарственных препаратов, определенное значение при лечении данной патологии имеют и антибактериальные препараты, что связано с нередко наблюдаемыми у таких больных инфекционными поражениями мочевыводящих путей.
Как уже было отмечено выше, нарушения мочеиспускания при РС, связанные с расстройством функций МП, отражают локализацию центральных демиелинизирующих поражений (бляшек) в белом веществе головного и спинного мозга, сопровождающихся нарушениями передачи нервных импульсов между этими отделами ЦНС и иннервируемыми органами. При этом обычно страдают функции чувствительных проводящих путей, ответственных за контроль наполнения МП, а также симпатических, парасимпатических, экстрапирамидных и спинальных путей, через которые осуществляется регуляция моторных стимулов, определяющих активность детрузорной мышцы, мускулатуры сфинктеров и тазового дна в процессах наполнения и мочеиспускания. Согласно современным представлениям, важную роль в функционировании МП как в физиологических, так и патологических условиях играет холинергическая иннервация. Сокращение детрузорной мышцы МП осуществляется, прежде всего, за счет стимуляции мускариновых холинорецепторов (М-ХР), выделяющимся из пресинаптических структур ацетилхолином (АХ). В настоящее время установлено наличие нескольких подтипов М-ХР (М1, М2, М3 и др.), различающихся как по строению, локализации и функциям, так и отношению к агонистам и антагонистам. Показано, что М1 и М2 подтипы М-ХР участвуют, главным образом, в процессах проведения нервных импульсов, тогда как ХР подтипа М3 – в активации клеток-мишеней гладкомышечных и других органов.
МП содержит М1, М2 и М3 подтипы ХР. Хотя в тканях этого органа преобладают М2 рецепторы (около 80%), его сокращения осуществляются благодаря активации относительно небольшой популяции М3 ХР.
Адренергическая (симпатическая) иннервация детрузорной мышцы МП по сравнению с холинергической представлена в значительно меньшем объеме. Однако нейропередатчик в адренергических синапсах – норадреналин (НА) может играть ингибирующую роль в функционировании МП как за счет торможения по механизму обратной связи передачи нервных импульсов в парасимпатических ганглиях, так и, возможно, благодаря стимуляции b-адренорецепторов, приводящей к расслаблению детрузора в фазу наполнения МП. В противоположность ситуации с детрузором МП, в мышцах дна МП, предстательной железе и уретре, играющих важную роль в удержании мочи, широко представдены b-адренорецепторы.
Именно указанные особенности парасимпатической и симпатической иннервации органов НМВП являются основой для выбора лекарственных препаратов различного механизма действия для лечения урологических нарушений у больных РС.
Выбор лекарственного препарата
Индивидуализации и оптимизации фармакотерапии в значительной мере способствует использование функциональной классификации урологических нарушений, которые подразделяют на:
• нарушения способности к накоплению мочи в МП,
• нарушения способности осуществлять опорожнение МП,
• комбинацию обоих типов нарушений.
При умеренной выраженности перечисленных нарушений подбор лекарственного препарата осуществляется эмпирически, методом проб и ошибок. Однако при тяжелых формах урологических нарушений, подтвержденных данными исследования уродинамики, обычно прибегают к комбинированной фармакотерапии, включающей использование лекарственных средств, воздействующих на различные механизмы регуляции функций МП (см.таблицу 1).
Характеризуя в целом лекарственные средства, применяемые для лечения урологических осложнений РС, необходимо отметить, что, несмотря на оказываемый ими в той или иной мере терапевтический эффект, ни одно из них не отвечает в полном объеме современным критериям эффективности и переносимости. Именно недостаточная эффективность либо связанные с основным механизмом действия и особенностями фармакокинетики побочные эффекты не только применяемых в течение многих лет, но и современных лекарственных препаратов являются причиной отмены или ограничения их использования у больных РС с урологическими осложнениями.
Тем не менее, имеющиеся в настоящее время лекарственные препараты позволяют в значительной мере решать проблемы, связанные с нарушениями мочеиспускания у больных РС.
Антихолинергические препараты
Основной группой лекарственных средств, применяемых для лечения нестабильного МП вообще и ГРД при РС, в частности, являются антихолинергические препараты, в литературе нередко обозначаемые как холинолитические, холиноблокирующие или антимускариновые средства. Эти препараты блокируют М-ХР с разной степенью органной специфичности и избирательности в отношении разных подтипов. За счет этого достигается уменьшение или полное предупреждение действия АХ на детрузорную мышцу МП, что вызывает уменьшение ее сократимости в условиях гиперрефлексии. Блокада М-ХР ведет к снижению тонуса МП (так как антихолинергические препараты, как правило, обладают миотропными спазмолитическими свойствами), подавлению непроизвольных позывов на мочеиспускание и уменьшению их частоты, увеличивает объем наполнения МП.
Несмотря на достаточно хорошую в целом клиническую эффективность, использование этих препаратов, в том числе наиболее широко применяемого оксибутинина (клиническая эффективность которого у больных с ГРД, по данным контролируемых исследований, достигает в среднем 67%), в ряде случаев ограничивается характерными для всех антихолинергических средств побочными эффектами. В частности, при применении оксибутинина, сочетающего умеренную миотропную спазмолитическую активность с относительно избирательными блокирующими М3-ХР свойствами, у 50-70% пациентов отмечаются характерные побочные эффекты (наиболее часто – сухость во рту). К числу других системных побочных эффектов антихолинергических препаратов, блокирующих М-ХР разных органов (экзокринные железы, глаза, сердце, ЖКТ и др.), относятся нарушения четкости зрения, снижение тонуса гладкомышечных органов и связанные с этим торможение перистальтики кишечника и запоры, тахикардия, в отдельных случаях центральные эффекты (сонливость) и др. Все указанные побочные эффекты объясняются недостаточной избирательностью действия, особенно “старых” препаратов этой группы и реже встречаются при использовании более современного препарата оксибутинина. Но даже в случае с этим препаратом частые побочные эффекты ведут к ухудшению восприятия больными данного вида фармакотерапии. В клинических исследованиях около 1/3 больных прекращали прием оксибутинина из-за плохой переносимости препарата. По-видимому, в рутинной поликлинической практике этот показатель среди больных, прекращающих прием антихолинергических препаратов, еще выше.
Для предупреждения или снижения частоты и выраженности побочных эффектов терапии приобретают большое значение индивидуальный подбор дозировок препаратов, а также информирование пациента о мерах предосторожности при их применении, соблюдении временных интервалов между приемами, а также необходимости постепенного, в течение нескольких недель повышения дозы до появления сухости во рту, являющейся признаком достижения максимальной дозы. В случае с оксибутинином максимальная доза обычно составляет 5-10 мг 2-3 раза в день. Действие препарата развивается постепенно в течение нескольких недель.
В последние годы для лечения гиперреактивного МП предложен новый антихолинергический препарат толтеродин (Детрузитол), являющийся смешанным антагонистом М2 и М3 ХР и отличающийся от оксибутинина по данным фармакологических исследований отчетливой органной специфичностью действия в отношении МП. Дозы толтеродина, вызывающие ограничение реализуемых через холинергические механизмы сократительных реакций мускулатуры МП существенно ниже, чем вызывающие антихолинергические эффекты в других органах (слюнные железы, глаза и др.). В этом отношении данный препарат существенно отличается от оксибутинина, оказывающего в равной степени выраженное влияние на холинергические структуры разных органов, имеющих М-ХР.
Клиническая эффективность толтеродина была подтверждена в ряде контролируемых испытаний. Одновременно у этого препарата была установлена лучшая, чем у оксибутинина, переносимость. Его обычно применяют в дозе 2 мг 2 раза в день длительно. Эффект наступает относительно быстро (на 1-2-й неделе применения), однако, как и в случае с оксибутинином, максимальной выраженности достигает к 5-8-й неделе лечения. Препарат достаточно хорошо переносится, о чем свидетельствуют результаты клинических испытаний, в рамках которых 6- и 12-месячный курсы лечения закончили 83 и 70% пациентов соответственно. Эти данные свидетельствуют и о том, что эффективность терапии сохраняется в течение длительного времени. Частота побочных эффектов при применении толтеродина (в дозе 2 мг 2 раза в день) практически не отличается от группы плацебо за исключением сухости во рту (16 и 39% соответственно) и значительно ниже, чем в группе больных, получавших оксибутинин в дозе 5 мг 3 раза в день (сухость во рту у 78% больных). Тем не менее, эффективность толтеродина для лечения урологических нарушений при РС нуждается в дальнейшем изучении.
Другие из указанных выше препаратов антихолинергического действия уступают как по эффективности, так и по переносимости оксибутинину.
Необходимо отметить, что антихолинергические средства с осторожностью применяют у пациентов с сердечными аритмиями; противопоказанием к их назначению является закрытоугольная глаукома.
Препараты других групп
В случаях недостаточной эффективности монотерапии с помощью антихолинергических средств лечебное действие при ГРД у больных с РС может быть достигнуто включением в терапию миотропных спазмолитических препаратов, таких как флавоксат, вызывающий расслабление гладкой мускулатуры НМВП, противерин и др., а также антагонистов кальция (нифедипин и др.). Противерин, наряду с расслаблением гладкой мускулатуры, блокирует кальциевые каналы. Как было показано, применение препарата увеличивает объем мочи в МП при первом позыве на мочеиспускание, что ведет к снижению его частоты. Несмотря на удовлетворительную в целом переносимость данного препарата, при его применении может наблюдаться нарушение четкости зрения, связанное с антимускариновыми свойствами.
Симптомы ГРД могут уменьшаться при включении в комплексную фармакотерапию агонистов ГАМК, таких как диазепам. В отдельных случаях при комбинированной терапии урологических расстройств при РС, особенно при наличии у пациентов с ГРД проявлений депрессии, используют трициклические антидепрессанты, из которых лучше изучен и чаще других применяют имипрамин. Этот препарат сочетает умеренные антиадренергические и антимускариновые свойства с блокирующим влиянием на Са++ и К+-каналы, а также с ингибированием обратного захвата моноаминов в нервных синапсах. Применение антидепрессантов способствует не только улучшению функционирования МП, но и нормализации настроения пациентов. Однако зачастую их использование ограничено рядом побочных эффектов, включая кардиотоксическое действие и повышение риска аритмий у предрасположенных больных.
В комплексной терапии нарушений функций МП при РС у пациентов со спастичностью мышц тазового дна может быть использован баклофен, который применяют как внутрь, так и интратекально (10-100 мг в сутки). Этот препарат относится к группе центральных миорелаксантов и антиспастических средств. Он оказывает ингибирующее влияние на моно- и полисинаптические рефлексы на спинальном уровне, как полагают, за счет гиперполяризации афферентных нервных волокон.
У некоторых больных с нарушениями опорожнения МП, связанными с недостаточностью сфинктеров МП и уретры, имеющими адренергическую иннервацию, может быть показано использование a-блокирующих препаратов (феноксибензамин и др.). Механизм действия препаратов этой группы связан с блокадой a-адренорецепторов органов, получающих иннервацию от спинальных симпатических нервов поясничной и тазовой областей.
Определенный практический интерес представляет и использование у пациентов с мочепузырными нарушениями при РС фармакологических препаратов иной направленности действия. К их числу относится препарат десмопрессин, применяемый с целью ограничения образования мочи. Этот препарат представляет собой синтетический аналог антидиуретического гормона и уменьшает образование мочи за счет повышения реабсорбции воды в собирательных канальцах почек. Его используют, в частности, при лечении никтурии у больных РС. При его применении возможно развитие гипонатрийурии, в связи с чем в процессе лечения рекомендуется контролировать уровень натрия в плазме крови. Использование десмопрессина должно проводиться с осторожностью у больных с тяжелой сопутствующей сердечно-сосудистой и почечной патологией. Его не назначают пациентам старших возрастных групп.
Таким образом, фармакотерапия урологических нарушений при РС включает лекарственные средства различного механизма действия, среди которых наиболее широко используются антихолинергические препараты.
Толтеродин –
Детрузитол (торговое название)
Нарушения со стороны нижних мочевыводящих путей встречаются у 60-80% больных рассеянным склерозом
В фармакотерапии урологических нарушений при РС широко используются антихолинергические препараты
Просмотреть [ t234.gif ]
Источник
