Шунтирование мочевого пузыря у плода

Врожденная обструкция нижних мочевыводящих путей — редкое заболевание, встречающееся в 1 случае на 5000 беременностей, приводящее к антенатальной гибели или рождению ребенка с тяжелой почечной недостаточностью и гипоплазией легких. Как и в случае с любой другой врожденной патологией, вмешательство, проведенное до рождения, может повысить выживаемость и качество жизни ребенка. Сегодня мы рассмотрим два возможных вмешательства: пузырно-амниотическое шунтирование и внутриутробную цистоскопическую операцию.
Основными причинами врожденной обструкции считаются стриктуры уретры, атрезия уретры и клапан задней уретры.
Обструкция запускает патологический каскад: нарушается отток мочи, вследствие чего мочевой пузырь переполняется и растягивается, отсутствие выделения мочи приводит к уменьшению объема околоплодных вод. Уменьшение объема околоплодных вод негативно влияет на развитие почек и легких, что может быть фатально для плода.
Диагностика врожденной обструкции включает в себя:
- УЗИ почек и мочевыводящих путей плода. Специализированные ультразвуковые уродинамические исследования плода с регистрацией сократительной активности детрузора, определением резервуарной емкости пузыря, продолжительности микционного цикла (цикла наполнения и опорожнения мочевого пузыря), количества остаточной мочи позволяют оценить функциональное состояние мочевого пузыря плода и выявить отсутствие опорожнения мочевого пузыря;
- Измерение почасового диуреза плода. Нормативный условный показатель почасовой продукции мочи у плода 20 нед гестации составляет 9,93 мл/кг/ч, 30 нед — 15,15 мл/кг/ч, 36 нед — 17,5 мл/кг/ч;
- Определение электролитного состава мочи плода. Забор мочи производится посредством пункции мочевого пузыря. Определяется уровень натрия (норма < 100 мэкв/л), хлора (норма < 90 мэкв/л), осмолярность (норма < 210 мосм/л), b2-микроглобулина (норма < 6 мг/л).
Для внутриутробного вмешательства подходят пациенты, соответствующие следующим критериям:
- Срок гестации 18–30 недель;
- Признаки обструкции и маловодия по результатам УЗИ.
- Повышенные показатели биохимического исследования мочи.
Наилучшие результаты достигаются при отсутствии у плода других аномалий развития, наличии нормального кариотипа и отсутствии ультразвуковых признаков дисплазии почек и гидронефроза.
В зависимости от результатов УЗИ и биохимических исследований мочи можно выделить четыре стадии течения данного заболевания (Табл. 1)
Таблица 1 | Стадии обструкции нижних мочевыводящих путей и тактика ведения пациентов.
УЗИ плода | Показатели биохимического анализа мочи плода 18-30 недель | Тактика ведения | |
Стадия I | Нормальный индекс амниотической жидкости, нет признаков кист и дисплазии почек | Норма | Еженедельное УЗИ |
Стадия II | Маловодие, тяжелый двусторонний гидронефроз, нет признаков кист и дисплазии почек | Пограничные показатели, показатели выше нормы после 3 проб мочи | Цистоскопия или пузырно-амниотическое шунтирование |
Стадия III | Маловодие, отсутствие околоплодных вод. Гиперэхогенность почек, наличие кист и/или дисплазии почек | Показатели выше нормы | Пузырно-амниотическое шунтирование с амниоинфузией |
Стадия IV | Отсутствие околоплодных вод и анурия по результатам оценки наполняемости мочевого пузыря. Гиперэхогенность почек и наличие дисплазии | Показатели выше нормы | Амниоинфузия |
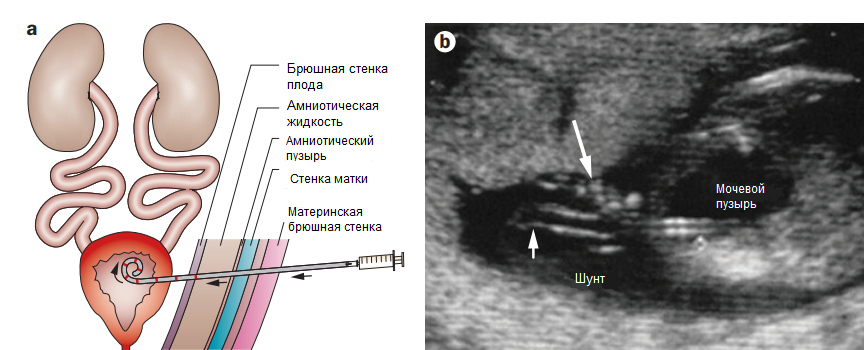
Пузырно-амниотическое шунтирование
Шунтирование проводится под ультразвуковым контролем с цветовой допплерографией для визуализации пупочных артерий. При наличии маловодия рекомендуется предварительная амниоинфузия, чтобы обеспечить потенциальное пространство для размещения внутриамниотического конца шунта. Троакар вводится на середине расстояния между лобковой костью и пуповиной, по проводнику вводится шунт на глубину, достаточную для предотвращения его смещения после опорожнения мочевого пузыря. Осложнениями данной процедуры являются преждевременные роды, хориоамнионит, мочевой асцит, ятрогенный гастрошизис. Также к возможным осложнениям может привести смещение шунта из-за повышенной активности плода.

Рисунок 1 | Установка пузырно-амниотического шунта.
Цистоскопия проводится под ультразвуковым контролем с цветовой допплерографией для визуализации пупочных артерий. Плод через пупочную вену получает общий анестетик и миорелаксант. Троакар вводится ближе к верхушке мочевого пузыря, моча аспирируется и передается в лабораторию для биохимического анализа. Производится осмотр стенок мочевого пузыря, мочеточниковых отверстий, шейки мочевого пузыря, визуализируется причина обструкции — клапан задней уретры, стриктуры, проводится дифференциальная диагностика с атрезией уретры. На данный момент есть данные об устранении клапана задней уретры с помощью лазера, инъекции физиологического раствора под давлением и механического разрушения клапана посредством проводника. После устранения причины окклюзии, для проверки проходимости уретры, в мочевой пузырь вводят некоторое количество жидкости и под контролем допплерографии наблюдают за ее выведением в амниотическую полость.
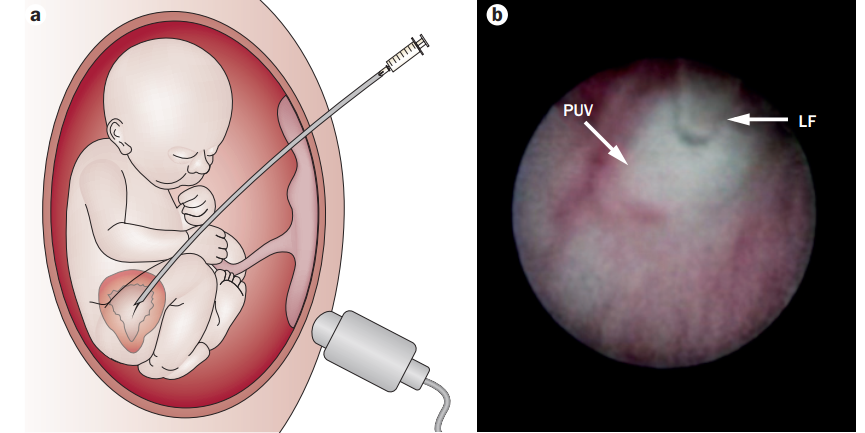
Рисунок 2 | Визуализация шейки мочевого пузыря с помощью цистоскопии. PUV – клапан задней уретры, LF – лазер.
Источники
- Ruano, R., Dunn, T., Braun, M. C., Angelo, J. R., & Safdar, A. Lower urinary tract obstruction: fetal intervention based on prenatal staging. Pediatric Nephrology, Vol.32, 2017.
- Agarwal, S. K., & Fisk, N. M. . In utero therapy for lower urinary tract obstruction. Prenatal Diagnosis, Vol. 21, 2001.
- Carroll, S. G. M., Soothill, P. W., Tizard, J., & Kyle, P. M. . Vesicocentesis at 10-14 weeks of gestation for treatment of fetal megacystis. Ultrasound in Obstetrics and Gynecology, Vol. 18, 2001.
- Mark D. Kilby & R. Katie Morris “Fetal therapy for the treatment of congenital bladder neck obstruction” Nature Reviews Urology Vol. 11, 2014
- Дерюгина Л. А., Горемыкин И. В., Краснова Е. И., Рожкова Дарья Владимировна Пренатальная диагностика синдрома мегацистис и его клиническое значение // Детская хирургия. 2015.
- Lower urinary tract obstruction https://www.fetalhealthfoundation.org/fetal-syndromes/lower-urinary-tract-obstruction/
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Последние эпидемиологические исследования показывают, что частота заболеваний органов мочевой системы среди детского населения колеблется от 5,4 до 34,2%, причем она значительно варьирует в различных группах детей и максимальна (до 74%) у детей, родившихся в семьях с нефропатиями.
При обнаружении тяжелых форм врожденных пороков развития органов мочевой системы у плода с родителями обсуждается вопрос о прерывании беременности до 22 нед. Результаты исследований показывают, что именно в пери- и неонатальном периодах формируются предпосылки для развития хронических заболеваний почек и дистальных отделов мочевой системы у детей раннего и старшего возраста. В современных условиях, владея методами пренатальной коррекции обструктивных поражений мочевыделительной системы, можно добиться улучшения перинатальных исходов при тяжелых дву- и односторонних поражениях мочевыделительной системы [1—7].
Одним из вариантов коррекции обструктивных уропатий является стентирование почек плода. За рубежом применяют шунтирование мочевого пузыря, авторы статьи [8] имеют опыт шунтирования почек плода. Данные фетальные операции проводят с целью сохранения почечной паренхимы у растущего плода при обструктивных уропатиях [9—12].
Наиболее часто устанавливается везикоамниальный шунт при синдроме задних уретральных клапанов (наличие клапанов в уретре, препятствующих оттоку мочи из мочевого пузыря у плодов мужского пола) и атрезии уретры. В 2007 г. в Европе было проведено многоцентровое рандомизированное контролируемое исследование (Percutaneous shunting for Lower Urinary Tract Obstruction randomized controlled trial [PLUTO]) [9], которое доказало, что пренатальное везикоамниальное шунтирование улучшает функцию почек и в конечном итоге перинатальные исходы. Тем не менее до сих пор данный вопрос является спорным, продолжается изучение процесса обструкции мочевыводящих путей у плода и механизмы его влияния на нефрогенез, и чем больше информации будет опубликовано по результатам пренатальных вмешательств, тем лучше мы будем представлять, какие именно пациенты нуждаются в этих вмешательствах [10].
В Уральском научно-исследовательском институте охраны материнства и младенчества (НИИ ОММ) начали внедряться методы пренатальной коррекции обструктивных уропатий посредством стентирования почек плода, так как нередко синдром задних уретральных клапанов сочетается с другой обструктивной патологией мочевыделительного тракта (стриктуры мочеточников, уретероцеле и др.) Двусторонний гидронефроз III—IV степени у плода так же, как и синдром задних уретральных клапанов и атрезий уретры, имеет неблагоприятный прогноз для жизни и здоровья новорожденного и может также являться показанием к внутриутробной коррекции [11—13]. В нашей практике часто происходила экспульсия установленного в почку плода стента фирмы «Cook» [8].
Цель исследования — разработка отечественного стента для внутриутробного нефроамниального шунтирования.
В качестве материала для разработанных нами стентов была выбрана силиконовая резиновая смесь серии МС и МС-Р-СТП МС № 1—93. Этот материал был выбран, так как уже используется для изготовления изделий аналогичного назначения и прошел все необходимые испытания. Как уже отмечалось, размеры всех элементов, входящих в комплект для стентирования, должны точно соответствовать друг другу, поэтому для изготовления стентов была экструзирована партия силиконовой трубки с наружным диаметром 1,05±0,03 мм и внутренним диаметром 0,55±0,03 мм.
Механические параметры стентов должны соответствовать ТУ 9398−041−18037666−2005, при этом прочность при растяжении стентов должна быть не менее 6Н. Стенты не должны распрямляться в свободном состоянии. Кондуктор должен свободно проходить внутри стентов.
Для оценки эффективности элемента фиксации стента в рабочем положении (например, «завитка») проводились испытания различных форм и размеров «завитков» на имитаторе Simulab производства «BOSS Instruments Ltd». Наилучшие показатели продемонстрировал элемент фиксации типа «спираль», поэтому он и был выбран в качестве основного.
На базе кафедры оперативной хирургии УрГМУ проводилось стентирование почек модифицированным стентом у плодов 5 беременных овец.
При морфологическом изучении почек экспериментальных животных был применен комплексный метод исследования, включающий органометрию, обзорное микроскопирование микропрепаратов, морфометрию.
Результаты, полученные на всех этапах исследования, вводились в электронную базу данных и подвергались статистической обработке. Для количественных параметров при помощи методов описательной статистики были определены медианы и стандартные отклонения. Определение достоверности параметров между группами осуществлялось при помощи U-теста Манна—Уитни. Корреляционный анализ с определением непараметрического коэффициента Спирмена позволил выявить наличие взаимосвязи между несколькими параметрами в группах, а также ее достоверность [14].
Изучение структурных компонентов почек в гистологических препаратах проводилось с помощью микроскопа Axio Scope А1, оснащенного цифровой фотокамерой Axio Cam 5S при увеличении (ок. 10, об. 20) с применением компьютерной программы AxioVision (Rel. 4.8.2).
Для формирования стента нужного размера и формы были разработаны техническое задание и технология термостатической формовки заготовки стента. В комплект по установке стента входят следующие элементы:
— интродьюсер (устройство для введения стента в почку). Представляет собой устройство, состоящее из троакара и стилета. При разработке конструкции необходимо было выбрать тип и оптимальные углы заточки стилета, а также размеры рукоятки стилета (рис. 1, 2);
 Рис. 1. Фото интродьюсера в сборе.
Рис. 1. Фото интродьюсера в сборе.
 Рис. 2. Заточка троакара и стилета.
Рис. 2. Заточка троакара и стилета.
— кондуктор. Служит для проведения стента через троакар в рабочую зону. Диаметр кондуктора должен быть несколько меньше внутреннего диаметра стента, чтобы стент мог свободно перемещаться по кондуктору;
— экструзор. Служит для перемещения стента по кондуктору через троакар в рабочую область. В отличие от известных аналогов экструзор целесообразно изготавливать из металлической трубочки, снабдив его ручкой в виде утолщенной части для облегчения процедуры «проталкивания» стента через троакар (рис. 3).
 Рис. 3.Экструзор.
Рис. 3.Экструзор.
Комплект инструментов для внутриутробного стентирования простерилизован и помещен в стерильную упаковку. В комплект входят стент, интродьюсер, кондуктор и экструзор.
Демонстрация этапов введения и установки стента на имитаторе. Извлекаем из стерильной упаковки стент-эндопротез (рис. 4), проверяем его целостность.
 Рис. 4.Общий вид стента.
Рис. 4.Общий вид стента.
Извлекаем из стерильной упаковки интродьюсер и вводим его в рабочую область. На практике это производится под контролем ультразвукового исследования (УЗИ). После этого извлекаем обтуратор. Фиксируем интродьюсер в рабочем положении пальцами свободной руки. Затем вводим кондуктор со стентом в трубку интродьюсера. Экструзор выдавливает стент в рабочую зону, спираль «завитка» (пигтейла) заворачивается, что обеспечивает его фиксацию в органе. Интродьюсер извлекается, стент находится в рабочем положении. Второй пигтейл ограничивает движение стента с наружной стороны (рис. 5).
 Рис. 5. Интродьюсер извлечен, стент находится в рабочем положении.
Рис. 5. Интродьюсер извлечен, стент находится в рабочем положении.
Авторами статьи [15] получен патент на полезную модель — стент почечный. В перспективе после регистрации медицинского изделия планируется применять разработанный нами стент в клинической практике.
Экспериментальная часть. Для апробации данного стента выполнено введение изделия 5 экспериментальным животным — основная группа. Общее число объектов исследования составило 10 плодов овец (из них 5 — контрольная группа — плоды, в почку которых вводился стент-эндопротез фирмы «Cook») с продолжительностью внутриутробной жизни от 75 до 98 дней.
Под контролем УЗИ плоду овцы основной группы в почку вводился стент, разработанный в НИИ ОММ. После проведения стентирующих манипуляций все овцы доставлялись обратно в фермерское хозяйство. Через месяц, после забоя овец, плоды доставлялись в НИИ ОММ в матке, проводилось вскрытие плодов, патоморфологическое исследование стентированных и контралатеральных почек (рис. 6).
 Рис. 6.Стент (указано стрелкой) в проекции почки плода (ягненка).
Рис. 6.Стент (указано стрелкой) в проекции почки плода (ягненка).
Плодам контрольной группы овец проводилось стентирование почек стандартными стентами — эндопротезами фирмы «Cook», в качестве проводника использовалась спинальная игла G16 B-Braun (с закругленным концом). В контрольной группе зарегистрировано 3 выкидыша, плоды доставлены для вскрытия в НИИ ОММ. У всех 5 плодов контрольной группы наблюдалась экспульсия стента.
В ходе эксперимента по результатам морфологического исследования почек плодов экспериментальных животных нами выявлено следующее.
При обзорном микроскопическом исследовании гистопрепаратов почек, стентированных стентами НИИ ОММ, выявлены незначительные очаговые склеротические изменения капсулы органа. Непосредственно в области фиброза капсулы визуализировалась воспалительная инфильтрация минимальной степени выраженности: от единичных до 10 клеток в поле зрения (×200). Воспалительный инфильтрат был представлен лимфоцитами, плазмацитами, гистиоцитами и нейрофильными лейкоцитами. В большинстве наблюдений (4) этой группы в почечной паренхиме области эндопротезирования не было выявлено воспалительных и склеротических изменений. Только в одном наблюдении в мозговом веществе почки визуализировалась очаговая воспалительная инфильтрация, представленная нейтрофильными лейкоцитами, лимфоцитами, плазмацитами. Как перифокально, так и на удалении от данного воспалительного очага поврежденных структур нефрона не визуализировалось.
Таким образом, в результате проведенного исследования доказано следующее:
1. При длительном (до 1 мес) нахождении разработанного авторами стента в почке формируются морфологические признаки воспалительной инфильтрации и репарации тканей только в области капсулы органа. В большинстве наблюдений в почечной паренхиме воспалительные изменения отсутствуют. Склеротических изменений в почечной паренхиме не выявлено.
2. Различная длительность пребывания стента в тканях органа обусловливает «компрессионное» повреждение структур паренхимы различной степени выраженности. Независимо от длительности пребывания стента в паренхиме органа не выявлено максимальной степени повреждения структур мозгового вещества почек, связанного с компрессией.
1. Проведена апробация стента на экспериментальных животных, которая показала его высокую надежность в применении.
2. Морфометрическая картина почек плодов экспериментальных животных после их внутриутробного стентирования доказала безопасность использования разработанного отечественного нефроамниального стента.
Источник

Мочевой пузырь начинает развиваться из зародышевого лепестка с 25 дня с момента зачатия и окончательно формируется к 22 неделе беременности. К этому сроку мочевой пузырь достигает размера 8 мм. При трансвагинальном УЗИ орган виден уже на 11 неделе, при трансабдоминальном — с 16-й недели.

Аномалии мочеполовой системы встречаются крайне редко. Часто они связаны с хромосомными нарушениями и сопровождаются целым спектром нарушений и синдромов.
Ультразвуковая диагностика на 2 триместре выявляет 85% патологий. Наиболее часто встречающиеся аномалии мочевого пузыря:
Патологии и аномалии мочевого пузыря у плода
- Мегацистис. Это увеличение мочевого пузыря свыше 8 мм в продольном срезе на УЗИ. Патология обнаруживается на 10-15 неделе беременности. Вместе с ней обычно выявляется нарушение соотношения мочевого пузыря к копчико-теменной зоне (10,4% вместо 5,4%). Мегацистис имеет хромосомную природу и выражается в нарушении уродинамики вследствие закупорки или сращения уретры.
- Обструкция детрузора. Выражается в отсутствии сократительной способности мышечного слоя мочевого пузыря, отвечающего за изгнание мочи. На УЗИ мочевой пузырь имеет грушевидную форму, стенки тонкие, а сам орган увеличен в размерах. В случае обнаружения эхографических признаков патологии плод исследуется методом везикоцентеза. Затем проводят кариотипирование плода, и в случае подтверждения хромосомных отклонений женщину отправляют на аборт. То же самое происходит и при увеличении органа до 20-30 мм вместо положенных 8 мм. Существует вероятность нормализации после 13 недели беременности.
- Экстрофия. Это отсутствие передней стенки мочевого пузыря. На УЗИ мочевой пузырь отсутствует вовсе, но при этом структура почек остаётся без изменений.
- Атрезия. Отсутствие мочевого канала приводит к увеличению мочевого пузыря до таких размеров, что у плода значительно увеличивается объём животика. Женщине рекомендуют прервать беременность, потому что малыш может родиться с тяжёлой гипоплазией лёгких или умереть внутриутробно.
- Задний уретральный клапан. Эта проблема встречается только у мальчиков. У девочек встречается синдром pmne-bUy, который имеет схожие симптомы. Аномалия заключается в том, что из-за внутриутробного нарушения нижняя часть мочеиспускательного канала, выходящая в мочевой пузырь, слишком узкая, из-за чего происходит обратный отток мочи в почку. В результате возникает гидронефроз — скопление в почках лишней жидкости. У плода на УЗИ будут увеличены почки, а мочевой пузырь будет маленьким. Патология исправляется сразу после рождения малыша методом иссечения места патологического сужения уретры. Существует высокий риск гибели младенца из-за гипоплазии лёгких на фоне почечной недостаточности.
- Пузырно-мочеточниковый рефлюкс. В норме мочеточник входит в мочевой пузырь таким образом, что мышечная стенка органа служит клапаном, препятствующим оттоку мочи обратно в почку.
Если мочеточник входит в мочевой пузырь неправильно, то возникает рефлюкс — забросе мочи обратно в мочеточник. Аномалия не является основанием для прерывания беременности, потому что исчезает сама собой в первые 2 года жизни малыша. В тяжёлых случаях проводится хирургическое вмешательство.
Выводы
Патологии мочевого пузыря у плода хорошо видны на скрининговом УЗИ, поэтому такое обследование нельзя игнорировать. Делать скрининговое УЗИ плода нужно только с помощью хорошего оборудования.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter
Поделиться ссылкой:
Источник
