Рак мочевого пузыря матвеев
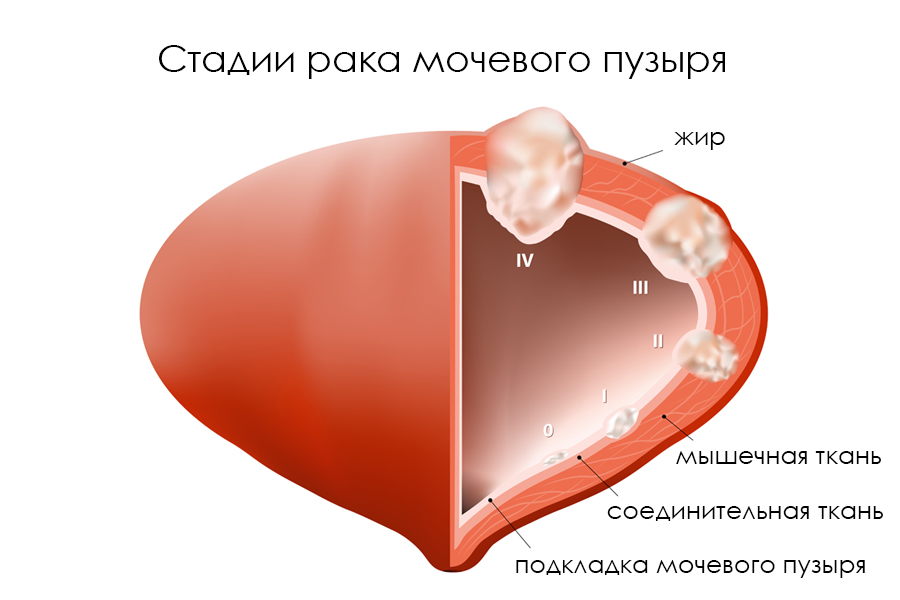
Рак мочевого пузыря – онкологическое поражение, характеризующееся злокачественными изменениями в клетках слизистой оболочки мочевого пузыря. По статистическим данным, в России заболевания занимает 8 место. Наиболее подвержены мужчины в возрасте 70-73 лет, у женщин рак мочевого пузыря диагностируется в 2 раза реже.
При своевременном обнаружении патология поддается лечению. Практически во всех случаях прогноз благоприятен для жизни. Поэтому необходимо ежегодно проходить осмотр у уролога.
Сервис «Русский Доктор» предлагает услуги лучших онкологов-урологов страны с многолетним стажем. Вы можете ознакомиться с отзывами пациентов о работе клиники и подобрать лучшее медицинское обслуживание на территории России.
Симптоматика
Признаки заболевания:
- Моча приобретает мутный, грязно-розовый или красный оттенок. Для рака характерна длительная макрогематурия, которая не поддается лечению.
- Жжение и боль при мочеиспускании.
- Постоянные позывы к посещению туалета.
- У мужчин жалобы на частое мочеиспускание в ночное время.
- Почечная колика. Большинство людей, не обращает на нее внимания, и просто заглушают боль спазмолитиками.
- Сгустки крови закупоривают мочеиспускательный канал.
- Болезненные ощущения в области поясницы, промежности и нижних конечностях, усиливающиеся при интенсивных движениях.
- Опухолевая интоксикация, сохраняющаяся несколько недель или месяцев: температура тела 37-37,6° С, снижение веса, бессонница и апатия.
На 3-4 стадии отмечают:
- Пораженные лимфоузлы провоцируют отек ног, мошонки (половых губ).
- Хронические боли в нижней части живота, усиливающиеся при физической активности или мочеиспускании.
- Свищи, провоцирующие тяжелые гнойные осложнения.
- Разрастание метастаз приводит к нарушениям в работе дыхательной системы, проблемам с сердцем и снижению иммунитета.
При дискомфортных ощущениях в малом тазу, следует незамедлительно обратиться за помощью в медицинское учреждение.
 Диагностика рака мочевого пузыря
Диагностика рака мочевого пузыря
Для точной постановки диагноза необходимо пройти:
- Консультация и осмотр у онколога-уролога.
- УЗИ мочевого пузыря и брюшной полости – высокоинформативный метод исследования мочевого пузыря и ближайших органов. Но данный тип диагностики не способен выявить опухоль очень маленького размера.
- Цистоскопия – в полость мочевого пузыря через уретру вводят цистоскоп. Цель процедуры – осмотр и забор из нескольких мест образцов пораженной ткани. В определенных случаях назначается обследование с контрастным препаратом (флюоресценция).
- Магниторезонансная томография (МРТ), компьютерная томография (КТ) и позитронно-эмиссионная томография (ПЭТ КТ) – назначается для оценки состояния ближайших тканей и органов.
- Исследования образцов крови и мочи в лабораторных условиях. Проводится с целью уточнения состояния пациента.
Для постановки точного диагноза специалистом, необходима комплексная диагностика.
Профессор Матвеев Всеволод Борисович
 Всеволод Борисович – заведующий отделением онкоурологии ФГБУ РОНЦ им. Н.Н. Блохина Минздрава России РФ, один из ведущих специалистов России по лечению онкологии мочевого пузыря. Был награжден почетным дипломом Европейской организации по исследованию и лечению рака (EORTC). Входит в группу по написанию стандартов Европейской Урологической Ассоциации (EAU).
Всеволод Борисович – заведующий отделением онкоурологии ФГБУ РОНЦ им. Н.Н. Блохина Минздрава России РФ, один из ведущих специалистов России по лечению онкологии мочевого пузыря. Был награжден почетным дипломом Европейской организации по исследованию и лечению рака (EORTC). Входит в группу по написанию стандартов Европейской Урологической Ассоциации (EAU).
Перейти в профиль врача ->
- Член корреспондент РАН.
- Президент Российского общества онкоурологов РООУ.
- Заместитель председателя правления Российского общества урологов.
Лечение
После получения полной картины заболевания, специалист может назначить:
- Трансуретральную резекцию опухоли (ТУР). В ходе операции злокачественное образование удаляется резектоскопом через мочеиспускательный канал. Атипичные клетки выжигаются током или высокоэнергетическим лазером. Дополняют лечение местной химиотерапией. Используется на первых стадиях заболевания.
- Лучевая терапия – радиоволнами разрушают раковые клетки, при этом на здоровые органы и ткани излучение действует минимально. Используется для ослабления признаков продвинутого опухолевого процесса или с целью полного выздоровления.
- Химиотерапия. Более детально о химиотерапии, пожалуйста, читайте здесь.
- Биологическая терапия – препарат БЦЖ вводится в мочевой пузырь и стимулирует защитные силы организма для уничтожения атипичных клеток. Данный метод выбирается в качестве профилактики, поскольку вакцина в 2 раза снижает риск повторного появления рака.
Как выбрать врача и клинику?
На портале russdoc вы можете ознакомиться с резюме лучших онкологов, урологов, андрологов России, а также клиник, которые располагают новейшим оборудованием. Помните, что благоприятные прогнозы лечения рака мочевого пузыря возможны при своевременном обращении к специалисту, который точно выявит диагноз заболевания и назначит правильный протокол лечения.
Источник
- Архив журнала /
- 2016 /
- №6 (supplement)
Рак мочевого пузыря
А.Д. Каприн, А.А. Костин, Л.М. Рапопорт, Д.Г. Цариченко, А.Н. Берников, Н.В. Воробьев, М.П. Головащенко
Литература
1. Болотина Л.В. Химиотерапия распространенного рака мочевого пузыря: дисс. канд. мед. наук. М., 2002.
2. Воробьев А.В. Классификация и диагностика рака мочевого пузыря, вопросы дифференциальной диагностики. Практическая онкология. 2003; 4(4): 200-201.
3. Злокачественные новообразования в России в 2014 г. (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2016.
4. Коган М.И., Перепечай В.А. Современная диагностика и хирургия рака мочевого пузыря. Ростов-на-Дону, 2002.
5. Лекции цикла «Онкоурология». Сост. И.Н. Денисов, А.Д. Каприн. М., 2008.
6. Матвеев Б.П., Фигурин К.М., Карякин О.Б. Pак мочевого пузыря. М., 2001.
7. Митина Л.А., Казакевич В.И., Степанов С.О. Ультразвуковая онкоурология. Под ред. В.И. Чиссова, И.Г. Русакова. М.: Медиа Сфера, 2005. 200 с.
8. Перепечай В.А. Обоснование ортотопической сигмопластики для восстановления мочевого пузыря: Дисс. канд. мед. наук. Ростов-на-Дону, 2000.
9. Сергеева Н.С., Маршутина Н.В. Новые серологические и уринологические опухолевые маркеры в уточняющей диагностике и мониторинге онкологических больных. Материалы VII Российской онкологической конференции. М., 2003.
10. Camey M., Botto H. The ileal neobladder: development and long-term experience, Carney I and II. Scand. J. Urol. Nephrol. (Suppl.). 1992; 142: 98-100.
11. Теплов А.А. Хирургическое и комплексное лечение больных раком мочевого пузыря: дисс. д-ра мед. наук. М., 2006.
12. Теплов А.А. Хирургическое и комплексное лечение больных инвазивным раком мочевого пузыря. Состояние проблемы. Выбор лечебной тактики. Материалы Международного научного форума «Онкология на рубеже XXI века. Возможности и перспективы». М., 1999. С. 382-383.
13. Урология: иллюстрированное руководство. От симптомов к диагнозу и лечению. Под ред. П.В. Глыбочко, Ю.Г. Аляева, Н.А. Григорьева. М.: ГЭОТАР-Медиа, 2014.
14. Урология. Под ред. П.В. Глыбочко, Ю.Г. Аляева. Ростов-на-Дону: Феникс, 2014.
15. Хинман Ф. Оперативная урология. М., 2003.
16. Чиссов В.И., Соколов В.В., Булгакова Н.Н., Филоненко Е.В. Флюоресцентная эндоскопия, дермаскопия, спектрофотометрия в диагностике злокачественных опухолей основных локализаций. Российский биотерапевтический журнал. 2003; 4 (2): 45-56.
17. Advanced Bladder Cancer Overview Collaboration. Neoadjuvant cisplatin for advanced bladder cancer. In: The Cochrane Library 2, 2004. Chichester, UK: John Wiley.
18. Bajorin D.F. Plenary debate of randomized phase III trial of neoadjuvant MVAC plus cystectomy versus cystectomy alone in patients with locally advanced bladder cancer. J. Clin. Oncol. 2001; 19: 17S.
19. Boffetta P., Silverman D.T. A analysis of bladder cancer and diesel exhaust exposure. Epidemiology. 2001; 12: 125.
20. Bohle A., Brandau S. Immune mechanisms in bacillus Calmette – Guerin immunotherapy for superficial bladder cancer. J. Urol. 2003; 170: 964.
21. Bono A.V., Benvenuti C., Reali L. et al. Adjuvant chemotherapy in advanced bladder cancer. Italian Uro-Oncologic Cooperative Group. Prog. Clin. Biol. Res. 1989; 303: 533.
22. Brennan P., Bogillot O., Cordier S. et al. Cigarette smoking and bladder cancer in men: a pooled analysis of 11 case-control studies. Int. J. Cancer. 2000; 86: 289.
23. Campbell’s Urology. Eds. P.C. Walsh et al. 8th edn. Philadelphia, 2002; 1-4.
24. Castelao J.E., Yuan J.M., Skipper P.L. et al. Gender- and smoking- bladder cancer risk. J. Natl. Cancer. Inst. 2001; 93: 538.
25. Cole C.J., Pollack A., Zagars G.K. et al. Local control of muscle-invasive bladder cancer: preoperative radiotherapy and cystectomy versus cystectomy alone. Int. J. Radiat. Oncol. Biol. Phys. 1995; 32: 331.
26. Cole P., Hoover R., Friedell G.H. Occupation and cancer of the lower urinary tract. Cancer. 1972; 29: 1250.
27. Cookson M.S., Chang S.S., Wells N., Parekh D.J. Complications of radical cystectomy for nonmuscle invasive disease: comparison with muscle invasive disease. J. Urol. 2003; 169: 101.
28. Cortesi E. Neoadjuvant treatment for locally advanced bladder cancer: A prospective randomized clinical trial. Proc. Am. Soc. Clin. Oncol. 1995; 14: 237.
29. Datta S.N., Allen G.M., Evans R. et al. Urinary tract ultrasonography in the evaluation of haematuria: A report of over 1,000 cases. Ann. R. Coll. Surg. Eng. 2002; 84: 203.
30. De Neve W., Lybeert M.L., Goor C. et al. Radiotherapy for T2 and T3 carcinoma of the bladder: The influence of overall treatment . Radiother. Oncol. 1995; 36: 183.
31. Delnay K.M., Stonehill W.H., Goldman H. et al. Bladder histological changes associated with chronic indwelling urinary catheter. J. Urol. 1999; 161: 1106.
32. Donat M.D., Herr H.W. Transitional cell carcinoma of the renal pelvis and ureter: diagnosis, staging, management, and prognosis. In: Urologic Oncology. Eds. J.E. Osterling, J.P. Richie. Philadelphia: WB Saunders Harcourt Brace & Co, 1997. P. 215.
33. Elmajian D.A., Stein J.P., Esrig D. et al. The Kock ileal neobladder: upd experience in 295 male patients. J. Urol. 1996; 156 (3): 920-925.
34. Freiha F., Reese J., Torti F. A randomized trial of radical cystectomy versus radical cystectomy plus cisplatin, vinblastine and methotrexate chemotherapy for muscle-invasive bladder cancer. J. Urol. 1996; 155: 495.
35. Gospodarowicz M.K., Quilty P.M., Scalliet P. et al. The place of radiation therapy as definitive treatment of bladder cancer. Int. J. Urol. 1995; 2 (Suppl. 2): 41.
36. Grossman H.B., Natale R.B., Tangen C.M. et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N. Eng. J. Med. 2003; 349: 859.
37. Guidelines. European Association of Urology. 2007.
38. Hall R.R. Upd results of a randomised controlled trial of neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer. Proc. Am. Soc. Clin. Oncol. 2002; 21: 178.
39. Herr H.W. Routine CT scan in cystectomy patients: does it change management? Urology. 1996; 47: 324.
40. Jemal A., Thomas A., Murray T., Thun M. Cancer istics. CA Cancer. J. Clin. 2002; 52: 23.
41. Jenkins B.J., Caulfield M.J., Fowler C.G. et al. Reappraisal of the role of radical radiotherapy and salvage cystectomy in the treatment of invasive bladder cancer. Br. J. Urol. 1988; 62: 343.
42. Jung I., Messing E. Molecular mechanisms and pathways in bladder cancer development and progression. Cancer Control. 2000; 7: 325.
43. Kaufman D., Raghavan D., Carducci M. et al. Phase II trial of gemcitabine plus cisplatin in patients with ic urothelial cancer. J. Clin. Oncol. 2000; 18: 1921.
44. Khadra M.H., Pickard R.S., Charlton M. et al. A prospective analysis of 1,930 patients with hematuria to evaluate current diagnostic practice. J. Urol. 2000; 163: 524.
45. Lerner S.P., Skinner D.G. Radical cystectomy for bladder cancer. Comprehensive textbook of genitourinary oncology. Baltimore: Williams and Wilkins, 1996. P. 442-463.
46. Light J.K., Engelmann U.H. Le bag: total replacement of the bladder using an ileocolonic pouch. J. Urol. 1986; 135: 27-31.
47. Loehrer P., Einhorn L.H., Elson P.J. et al. A randomized comparison of cisplatin alone or in combination with methotrexate, vinblastine, and doxorubicin in patients with ic urothelial carcinoma: A Cooperative Group Study. J. Clin. Oncol. 1992; 10: 1066.
48. Logothetis C.J., Dexeus F., Sella A. et al. A prospective randomized trial comparing CISCA to MVAC chemotherapy in advanced ic urothelial tumors. J. Clin. Oncol. 1990; 8: 1050.
49. Logsetty S. Screening for bladder cancer. In: Canadian Task Force on the Periodic Health Examination. Canadian Guide to Clinical Preventive Health Care. Ottawa: Health Canada, 1994. P. 826-836.
50. Lutzeyer W., Rubben H., Dahm H. Prognostic parameters in superficial bladder cancer: an analysis of 315 cases. J. Urol. 1982; 127: 250.
51. Mameghan H., Fisher R., Mameghan J. Analysis of failure following definitive radiotherapy for invasive transitional cell carcinoma of the bladder. Int. J. Radiat. Oncol. Biol. Phys. 1995; 31: 247.
52. Matsui U., Topoll B., Miller K., Hautmann R.E. bolic long-term follow up of the ideal neobladder. Eur. Urol. 1993; 24 (2): 197-200.
53. McDougal W.S. Use of intestinal segments and urinary diversion. In: P.C. Walsh, A.B. Retik, E.D. Vaughan et al. (eds.) Campbell’s Urology. Vol. 3. 7th edn. Philadelphia, Pa: W.B. Saunders, 1997. P. 3121-3161.
54. Mohr D.N. et al. Asymptomatic microhematuria and urologic disease. A population-based study. JAMA. 1986; 256: 224.
55. Moore M.J., Winquist E.W., Murray N. et al. Gemcitabine plus cisplatin, an active regimen in advanced urothelial cancer: A phase II trial of the National Cancer Institute of Canada Clinical Trials Group. J. Clin. Oncol. 1999; 17: 2876.
56. Nakamura I. Postoperative care of neobladder using a detubularized intestinal segment. Hinyokika Kiyo. 1995; 41 (11): 441-541.
57. Pfister C., Chautard D., Devonec M. et al. Immunocyt test improves the diagnostic accuracy of urinary cytology: results of a French multicenter study. J. Urol. 2003; 169: 921.
58. Piper J.M., Tonascia J., Matanoski G.M. Heavy phenacetin use and bladder cancer in women aged 20 to 49 years. N. Engl. J. Med. 1985; 313: 292.
59. Pollack A., Zagars G.Z. Radiotherapy for stage T3b transitional cell carcinoma of the bladder. Semin. Urol. Oncol. 1996; 14: 86.
60. Prescott S., Jackson A.M., Hawkyard S.J. et al. Mechanisms of action of intravesical bacille Calmette – Guerin: local immune mechanisms. Clin. Infect. Dis. 2000; 31 (Suppl. 3): 91.
61. Saxman S., Propert K., Einhorn L. et al. Long-term follow-up of a phase III intergroup study of cisplatin alone or in combination with methotrexate, vinblastine and doxorubicin in patients with staic urothelial cancer: A Cooperative Group Study. J. Clin. Oncol. 1997; 15: 2564.
62. Schatte E., Grunenfelder J., Fradet Y., Miles B.J. Epidemiology of bladder cancer. In: Comprehensive Textbook of Genitourinary Oncology. N.J. Vogelzang, P.T. Scardino, W.U. Shipley, D.S. Coffey (eds.). Lippincott, Williams, and Wilkins, Philadelphia, 2000. P. 283.
63. Sella A., Dexeus F.H., Chong C. et al. Radiation therapy associated invasive bladder tumors. Urology. 1989; 33: 185.
64. Shelley M.D., Court J.B., Kynaston H. et al. Intravesical bacillus Calmette – Guerin in Ta and T1 bladder cancer. Cochrane Database of Systematic Reviews. 2000. CD001986.
65. Skinner D.G., Daniels J.R., Russell C.A. et al. The role of adjuvant chemotherapy following cystectomy for invasive bladder cancer: A prospective comparative trial. J. Urol. 1991; 145: 459.
66. Solsona E., Iborra I., Ricos J.V. et al. Effectiveness of a imte mitomycin C instillation in patients with low risk superficial bladder cancer: short and long-term follow-up. J. Urol. 1999; 161: 1120.
67. Splinter T.A., Scher H.I., Denis L. et al. The prognostic value of the pathological response to combination chemotherapy before cystectomy in patients with invasive bladder cancer. European Organization for Re on Treatment of Cancer-Genitourinary Group. J. Urol. 1992; 147: 606.
68. Stadler W. Molecular events in the initiation and progression of bladder cancer. Int. J. Oncol. 1993; 3: 549.
69. Stein J.P., Lieskovsky G., Cote R. et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. J. Clin. Oncol. 2001; 19: 666.
70. Stockle M., Meyenburg W., Wellek S. et al. Advanced bladder cancer (stages pT3b, pT4a, pN1 and pN2): improved survival after radical cystectomy and 3 adjuvant cycles of chemotherapy. Results of a controlled prospective study. J. Urol. 1992; 148: 302.
71. Studer U., Bacchi M., Biederman C. et al. Adjuvant cisplatin chemotherapy following cystectomy for bladder cancer. Results of a prospective randomized trial. J. Urol. 1994; 152: 81.
72. Talar-Williams C., Hijazi Y.M., Walther M.M. et al. Cyclophosphamide induced cystitis and bladder cancer in patients with Wegener granulomatosis. Ann. Intern. Med. 1996; 124: 477.
73. Tekes A., Kamel I., Imam K. et al. Dynamic MRI of bladder cancer: evaluation of staging accuracy. AJR. 2005; 184: 121-127.
74. Travis L.B., Curtis R.E., Glimelius B. et al. Bladder and kidney cancer following cyclophosphamide therapy for non-Hodgkin’s lymphoma. J. Natl. Cancer. Inst. 1995; 87: 524.
75. U.S. Preventive Services Task Force. Screening for Bladder Cancer in Adults: ation ement. June 2004. Agency for Healthcare Re and Quality. Rockville, MD, 2004.
76. Vale C. Neoadjuvant chemotherapy in invasive bladder cancer: a systematic review and analysis. Lancet. 2003; 361: 1927.
77. von der Maase H., Hansen S.W., Robeerts J.T. et al. Gemcitabine and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advanced or ic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J. Clin. Oncol. 2000; 18: 3068.
78. Wright W. Geographical distribution of schistosomes and their interte hosts. In: Epidemiology and control of schistosomiasis (bilharziasis). N. Ansari (ed.). Karger S., Basel, 1973. P. 32.
79. Yaman O., Baltaci S., Arikan N. et al. Staging with computed tomography, transrectal ultrasonography and transurethral resection of bladder tumour: comparison with final pathological stage in invasive bladder carcinoma. Br. J. Urol. 1996; 78 (2): 197-200.
80. https://uroweb.org/fi leadmin/guidelines/Guidelines 2016.pdf.
Об авторах / Для корреспонденции
Каприн А.Д. – д.м.н, профессор, академик РАН, член-корр. РАО, заслуженный врач Российской Федерации, заведующий кафедрой урологии и оперативной нефрологии с курсoм онкоурологии ФГАОУ ВО «Российский Университет Дружбы Народов», генеральный директор ФГБУ «НМИРЦ» Минздрава России, главный уролог АН РФ
Костин А.А. – д.м.н., профессор кафедры урологии и оперативной нефрологии с курсом онкоурологии ФГАОУ ВО «Российский Университет Дружбы Народов», заведующий кафедрой урологии, онкологии и радиологии ФПК МР ФГАОУ ВО «Российский Университет Дружбы Народов», первый заместитель генерального директора ФГБУ «НМИРЦ» Минздрава России, эксперт РАН
Рапопорт Л.М. – д.м.н., профессор кафедры урологии, заместитель директора по лечебной работе НИИ уронефрологии и репродуктивного здоровья человека ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Цариченко Д.Г. – д.м.н., профессор кафедры урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Берников А.Н. – к.м.н., доцент кафедры урологии ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава Росси, заведующий отделением урологии КМЦ ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России
Воробьев Н.В. – к.м.н., руководитель отделения онкоурологии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИРЦ» Минздрава России
Головащенко М.П. – к.м.н., научный сотрудник отделения онкоурологии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИРЦ» Минздрава России
Источник
Рак мочевого пузыря входит в десятку наиболее распространенных в мире онкологических заболеваний, да и по частоте возникновения рецидивов – в 70-75% случаев – злокачественные новообразования этой локализации превосходят почти все прочие разновидности. Каждый год в России от этой болезни умирают более 8 тысяч онкоурологических пациентов. Vademecum разбирался, почему рак мочевого пузыря, уверенно диагностировать который клиницисты давно научились, по-прежнему остается фатальным для пациентов и дорогим для системы здравоохранения заболеванием.
По данным European Association of Urology, в мире насчитывается 2,7 млн человек, страдающих раком мочевого пузыря. Ежегодно онкологи и урологи впервые диагностируют около 430 тысяч новых случаев этого заболевания, каждый год рак мочевого пузыря уносит 165 тысяч жизней. В России в 2016 году было зарегистрировано 15 924 новых случая болезни (подробнее – в инфографике «Сфера внимания»), в общей сложности на учете по итогам прошлого года состояли 104 401 человек. «В структуре всех злокачественных новообразований рак мочевого пузыря занимает девятое место, он встречается чаще меланомы и рака печени, – замечает замдиректора по науке Национального медицинского исследовательского радиологического центра Борис Алексеев. – Но эта очень мучительная патология оказалась, если можно так выразиться, «на обочине» онкологии».
Низкую осведомленность о самом факте существования рака мочевого пузыря иллюстрирует резюме соцопроса, проведенного в январе 2017 года The European Cancer Patient Coalition в партнерстве с фармкомпанией Roche. В исследовании приняли участие 9 629 респондентов из шести стран. Результаты оказались плачевными: каждый десятый опрошенный в принципе не знал о существовании этого онкозаболевания, 62% респондентов не имели представления о признаках или симптомах заболевания. При этом 10% опрошенных сталкивались с наличием крови в моче; 20%, по их признанию, ощущали в течение трех или более месяцев абдоминальные боли; еще 25% на протяжении трех или более месяцев испытывали учащенные позывы к мочеиспусканию; 33% опрошенных в течение того же временного отрезка беспокоили боли в нижней части спины. Таким образом, у 88% участников опроса были зафиксированы симптомы, характерные в том числе и для рака мочевого пузыря. Но более половины респондентов (52%)при этом не обратились к врачу, поскольку «решили посмотреть, пройдут ли эти проявления сами по себе». В мае 2017‑го Roche опросила 466 российских онкологов и урологов, также подтвердивших низкую осведомленность граждан об этом заболевании: около 34% россиян с установленным диагнозом «рак мочевого пузыря» впервые обратились к врачу по прошествии более чем полугода с момента появления первых симптомов.
Нажмите, чтобы увеличить
КАНЦЕРОГЕНДЕРНЫЕ РАЗЛИЧИЯ
Онкозаболевания этой локализации в три раза чаще встречаются у мужчин, чем у женщин, рост заболеваемости в популяции начинается в среднем с 50 лет, но именно эта аудитория, по оценкам клиницистов, уделяет своему здоровью преступно незначительное внимание. «Основной симптом – наличие крови в моче, и, к счастью, он бывает и в самом начале – когда опухоль может быть поверхностной, излечиваемой. Любая примесь крови в моче – абсолютное показание к тщательному обследованию, проведению цистоскопии, если исключаются другие причины гематурии, например, мочекаменная болезнь, – объясняет Борис Алексеев. – Но мужчины не всегда настороженно относятся к этому симптому – могут мочиться кровью месяц, три и не ходить к урологу. Существенную роль играют психологические причины – люди просто стесняются обратиться к врачу».
Гематурия может быть симптомом цистита или аденомы простаты, но дифференцировать диагноз урологи способны очень быстро. «Уровень подготовки врачей первого звена определяет, насколько быстро будет поставлен диагноз. Часто путают рак мочевого пузыря с циститом – частые позывы к мочеиспусканию, рези. Но для профильных специалистов это не составляет труда, – считает заведующий урологическим отделением НМИЦ онкологии им. Н.Н. Блохина Всеволод Матвеев. – Самый быстрый, неинвазивный и относительно дешевый метод – УЗИ, после необходимо сделать цитологическое исследование мочи. Самый надежный метод, если он выполняется опытным урологом, – цистоскопия, но, поскольку процедура не очень приятная и инвазивная, начинают, как правило, с УЗИ». Впрочем, к услугам врачей – и возможности КТ, МРТ, последняя, по сути, позволяет поставить диагноз до гистологии и биопсии. «Самый точный метод – эндоскопический, плюс взятие биопсии с мышечным слоем, что дает правильную стадию заболевания, – подтверждает заведующий урологическим отделением ГКБ им. Д.Д. Плетнева, завкафедрой урологии и андрологии ИППОФМБЦ им. Бурназяна ФМБА Алексей Мартов. – С помощью эндоскопического же вмешательства, через уретру, лечатся и все поверхностные формы рака мочевого пузыря, кроме наивысшей степени злокачественности».
У этой коварной во многих смыслах болезни есть характерная особенность: онкологи и урологи, с которыми беседовал Vademecum, говоря о раке мочевого пузыря, замечают, что речь, по сути, идет о двух различных заболеваниях – поверхностном и инвазивном. Разница – в тактике лечения.
При поверхностных опухолях стандартом считается резекция опухоли и в дальнейшем, как правило, внутрипузырная химио- или иммунотерапия. «При поверхностном раке, когда поражается слизистая и максимум подслизистая, основной метод лечения – трансуретральная резекция стенки мочевого пузыря и введение каких‑либо лекарств непосредственно в мочевой пузырь», – поясняет главный уролог Минздрава РФ, руководитель Клиники урологии МГМСУ Дмитрий Пушкарь. Впрочем, по поводу основного метода лечения – резекции – идут дискуссии. «Я сторонник того, чтобы людям молодым, не отягощенным сопутствующей выраженной патологией, проводить открытые резекции, на Западе называемые парциальными цистэктомиями. Поскольку это уменьшает количество рецидивов, что доказано мировой статистикой, – говорит заведующий урологическим отделением МГОБ №62 Валерий Широкорад. – Почему? Потому что, когда мы делаем трансуретральную резекцию, мы дробно срезаем опухоль, получая в итоге «фарш», изучив который, морфологи должны сказать, есть или нет прорастание в мышечный слой. Даже при трансуретральных резекциях en block при средних и крупных размерах опухоли удалить ее через уретру без дробления невозможно. Но у меня всегда возникает вопрос: а можно ли в таком случае адекватно оценить наличие этого мышечного слоя и глубину инвазии опухоли в него? При открытых же резекциях мы удаляем все единым комплексом, на всю толщину стенки, и морфолог сам вырезает себе материал».
И тут есть нюансы, разделяющие клиницистов на два противоборствующих лагеря. После трансуретральной резекции больные находятся в отделении куда меньше, да и само вмешательство – эндоскопическое, несравнимое с открытым по степени травматичности. При открытой резекции пациенту на протяжении 8-10 дней приходится ходить с катетером, пока срастается место разреза мочевого пузыря. «Да, трансуретральные резекции, безусловно, нужны, особенно при рецидивных опухолях. Но и на Западе все чаще говорят, что при первичной опухоли правильнее делать открытые резекции и отходить от принятых ранее стандартов», – добавляет Широкорад.
Другая особенность болезни – анатомическая. Поскольку слизистая мочевого пузыря практически не имеет сосудов, всасываемость препаратов настолько низкая, что их дозировки, по определению самих врачей, «бешеные». «Если для внутривенных введений доза Митомицина‑С не превышает 12 мг, то для внутрипузырного введения мы используем дозу 40-50 мг. То же самое для вакцины БЦЖ: при реакции Манту вводится 2 мг полуживой вакцины, а в мочевой пузырь – шесть введений 150 мг, а затем – восемь введений 120 мг», – описывает медикаментозные схемы Валерий Широкорад. К счастью, химиотерапия рака мочевого пузыря – тот случай, когда препараты относительно недороги.
Но и здесь не обходится без проблем, если не финансовых, то административных. Туберкулезная вакцина применяется в терапии рака мочевого пузыря с конца 70‑х годов, но документального разрешения от санитарно‑эпидемиологической службы на ее использование фактически нет. «В Европе разрешено сливать в унитаз и смывать полуживую вакцину туберкулеза – там доказанным фактом считается, что канализационные системы, водоканалы и очистные сооружения совершенно спокойно с этим справляются. В России это официально не разрешено, но во многих центрах делается. Когда используется такая вакцина, в медучреждении должны применяться специальные емкости для противотуберкулезной обработки, куда больные должны мочиться, все эти склянки нужно обрабатывать и так далее, – поясняет на условиях анонимности интригу один из интервьюируемых Vademecum онкологов. – Лет семь назад немецкая компания Medac [производитель препарата для внутрипузырной БЦЖ‑терапии. – Vademecum] пыталась продавить этот вопрос в России, но с нашим тогда главным санитарным врачом господином Онищенко у них ничего не получилось».
Еще одна характерная черта рака мочевого пузыря – «привычка возвращаться»: до 70-75% больных сталкиваются с болезнью повторно. «Наверное, ни одна злокачественная опухоль в мире не имеет такого количества местных рецидивов, – рассказывает Валерий Широкорад из МГОБ №62. – Опухоль располагается на какой‑то стенке мочевого пузыря, когда человек мочится, пузырь сокращается – и все стенки «обнимают» эту опухоль. И так происходит пять – семь раз в день. То есть опухоль контактирует практически со всей слизистой и дает отсевы на любую другую стенку».
ТРУДОВЫЕ РЕЗЕРВУАРЫ
Если смотреть онкологическую статистику, то данные по злокачественным новообразованиям мочевого пузыря в сравнении с другими локализациями, на первый взгляд, выглядят очень даже неплохо. На больных с опухолевым процессом I‑II стадий пришлось 74% от общего числа впервые установленных в 2016 году диагнозов. Доля пациентов с заболеванием I стадии достигла почти 47%. Но у остальных пациентов, говорят онкоурологи, будут инвазивные раки, распространившиеся в мышечный слой и требующие иного – комбинированного, сочетающего внутривенную терапию с хирургией, – лечения. «Когда рак представлен инвазивной опухолью, речь идет не о трансуретральной резекции, а, к сожалению, об удалении мочевого пузыря. Пациент будет жить с выведенными в кожу мочеточниками или с искусственным мочевым пузырем. Эта ситуация более сложная, но и эти пациенты тоже имеют достойное качество жизни», – считает Дмитрий Пушкарь. После органоуносящего вмешательства таким больным формируют искусственные резервуары, сделанные из части тонкого кишечника, а затем системы отведения мочи – адаптация организма ко всем этим изменениям весьма продолжительна и мучительна. Кроме этого, у большинства пациентов после выполненной кишечной пластики начинаются проблемы с водно‑электролитным балансом. «Я уже не говорю об объеме и тяжести операции, о сложностях послеоперационного периода, но у пациентов начинается повышение шлаков в крови и пиелонефриты. Кишка же как вырабатывала свой сок, так и вырабатывает, а сок – это раздражитель, он все равно забрасывается в мочеточники, в лоханку, – объясняет Валерий Широкорад. – Основная причина смерти больных в течение первого года после удаления мочевого пузыря и формирования кишечных резервуаров – это не прогрессирование рака, а нарушения и воспалительные осложнения со стороны верхних мочевыводящих путей – мочеточников, лоханки, почек». По оценкам онкологов, на адаптацию пациента уходит от шести до 12 месяцев. В течение этого периода больным необходимы реабилитационные мероприятия – от инфузионной терапии и обучения использованию вновь сформированного мочевого резервуара до тщательных регулярных обследований, цель которых – удостовериться, что заболевание не прогрессировало и пациент не нуждается в химиотерапии. Очень долгое время пациенты с распространенным раком мочевого пузыря были лишены возможности получать комбинированную терапию. «Лет 30 в области лечения этой патологии фактически был застой – не было новых методов. Пятилетняя выживаемость при распространенном раке мочевого пузыря не превышала 6% случаев, – рассказывает Борис Алексеев. – Химиотерапия традиционно проводится на основе препаратов платины, а они очень токсичны в отношении почек. И половину больных – 48,4% – мы фактически ничем не могли лечить из‑за того, что у них почечная недостаточность, электролитные нарушения. Поэтому появление иммунотерапевтических препаратов стало определенным окном возможностей для этой группы больных». С тезисом о перспективе для пациентов, у которых невозможно проведение химиотерапии или переставших на нее отвечать, соглашается и Всеволод Матвеев из НМИЦ онкологии: «Это не универсальное лечение. Мы не знаем, сколько нужно проводить иммунотерапию и когда ее прекращать, подобных вопросов очень много, но очевидно, что это лечение – прорыв». Беда в том, что в России препараты для иммунотерапии рака мочевого пузыря пока не зарегистрированы, впрочем, и в США иммунотерапия для лечения этого онкозаболевания была одобрена FDA лишь в 2016 году.
Другая проблема, связанная с комбинированным лечением онкобольных, – междисциплинарная, состоящая в нарушении так называемой онкологической преемственности. Пациенты с онкоурологическими патологиями лечатся как в общих урологических отделениях, так и в онкоурологических. И такая схема частью профсообщества оценивается резко негативно. «Онкологических больных сейчас оперируют практически все, не имея при этом в штате ни химиотерапевтов, ни лучевых терапевтов. Но мочевой пузырь – одна из тех локализаций, при которых практически всегда, рано или поздно, мы применяем комбинированное лечение. Когда больных оперируют в урологических стационарах, им делают трансуретральные резекции и «пинают» -а теперь идите к онкологам по месту жительства, -описывает традиционную для страны практику Валерий Широкорад. – Но у поликлиник нет возможности делать какие‑то функциональные исследования, измерять давление в резервуаре, смотреть МРТ, КТ, цистоскопии, тем более прокапывать. Поэтому если вы прооперировали, то, пожалуйста, ведите этого больного до конца, выполняйте обследования с определенной регулярностью – проводите диспансерное наблюдение и адекватную реабилитацию». Еще один пример приводит Борис Алексеев: «Больных могут долго лечить эндоскопическими методами, невзирая на то, что им необходима радикальная цистэктомия. Это разные подходы – урологов и онкологов. Урологам важнее сохранить больному мочевой пузырь, и иногда они запускают пациентов, онкоурологи же подходят к делу более агрессивно, поэтому результаты лечения в специализированных онкоцентрах существенно лучше». Но контраргументы – как программные, таки лежащие исключительно в практической плоскости, – находятся и у второй стороны. «Споров здесь быть не может. Неважно, куда попадает пациент – большинство урологических отделений сегодня занимаются онкологией», – настаивает Дмитрий Пушкарь. Единственное, что тревожит в этом смысле урологов, так это нехватка в их клиниках онкологических коек. В возглавляемом Алексеем Мартовым урологическом отделении ГКБ им. Д.Д. Плетнева ежегодно проводится порядка 2 500 операций, около 25% из них – по онкопрофилю. «И слава богу, что сейчас больные могут попадать в общие урологические отделения, потому что если бы они не были распределены таким образом по больницам – все бы задохнулись, – убежден Мартов. – Должен быть системный подход, кто возражает? Онкозаболевания действительно требуют лучевой и химиотерапии. Но если госпитализация связана с экстренной ситуацией или «случайной находкой», то возможность для пациента получать адекватное лечение в урологических отделениях, имеющих высокие эндоскопические технологии и соответствующую компетенцию врачей, будет только в плюс. Мы применяем все это на потоке, а после операции оформляем больного в онкодиспансер, как и положено. Конечно, мы должны, кроме прочего, иметь сертификат онкологов». В пользу «урологической» схемы маршрутизации больных раком мочевого пузыря говорит тот факт, что онкоурологические подразделения (несмотря на то, что на онкоурологию приходится 15-20%всех злокачественных новообразований) организованы далеко не во всех диспансерах или крупных профильных больницах. «В Новосибирске, городе‑миллионнике, онкоурологии нет вообще. В Нижнем Новгороде только в прошлом году стали планировать открытие такого отделения на базе онкодиспансера, да и то – после войны и скандалов», – утверждает один из собеседников Vademecum.
УПАЛ-СЖАЛСЯ
Мерящиеся компетенциями урологи и онкологи мгновенно забывают о распрях, как только речь заходит о тарифах на терапию пациента с раком мочевого пузыря. Это заболевание, уступая по распространенности опухолям других локализаций, находится в группе лидеров по затратам на профильную помощь. «Это одно из самых дорогих заболеваний как в диагностике, так и в лечении, – говорит Алексей Мартов. – В первый год пациент должен быть обследован с помощью эндоскопии четыре раза: по меньшей мере это амбулаторный прием, а правильнее – стационар и наркоз. Во второй год – тоже не менее четырех раз. И если не будет рецидива, то затем раз в полгода на протяжении трех лет, затем – пожизненно раз в год. Все это – эндоскопические осмотры, что дорого, а у мужчин требует еще и наркоза, плюс химиотерапия и иммунотерапия». По оценкам клиницистов, открытая операция при неосложненном течении заболевания обходится как минимум в 350 тысяч рублей, к этой сумме нужно прибавить затраты на проведение исследований, количество которых переваливает за два десятка. Если говорить о лапароскопических операциях, то к цене прибавляются затраты на закупку используемых расходников и амортизацию оборудования. Действующие тарифы, даже на высокотехнологичную медпомощь вне базовой программы ОМС, и близко не покрывают расходы на операции – ни по профилю «Онкология», ни по профилю «Урология» (подробнее – в таблице «Ложные позывы»).«У онкологов, если метод идет с низкоинтенсивным лазерным облучением, которое у нас тоже есть, это еще как‑то оплачивается, а в обычных урологических отделениях за все эти продвинутые способы диагностики как за ВМП не платят, хотя это реально высокие технологии, – сокрушается Алексей Мартов. – У нас вообще перверсия с тарифами ВМП. Банальнейшая операция по установке петли при недержании мочи у женщин, которую у меня проводит ординатор второго года, включена в перечень, а тяжелейшее вмешательство по удалению коралловидных камней, когда нельзя сделать эндоскопическую операцию, а нужно делать открытую, – не входит. А чтобы сделать такую операцию, хирургу нужно учиться 20 лет».
Но тарифы – болезнь административно‑финансовая и, в общем‑то, излечимая. Тогда как рак мочевого пузыря остается единственным в мире онкоурологическим заболеванием, которое медицине пока не удается победить. Несмотря на всевозможные сложности, выявленный на ранней стадии рак мочевого пузыря имеет благоприятный прогноз: по данным американского National Cancer Institute, 96% пациентов после грамотной терапии живут дольше пяти лет. «Вопрос – что нужно сделать, чтобы диагностировать опухоль на ранних стадиях, – рассуждает главный уролог Минздрава Дмитрий Пушкарь. – Пойдет ли речь где-либо в мире о скрининге рака мочевого пузыря – например, специальном анализе мочи, ДНК‑анализе?» Однако пока пилотные проекты не запущены ни в одной стране, и даже самые авторитетные специалисты пока лишь осторожно обсуждают возможность такого начинания.
Источник
