Рак мочевого пузыря in situ лечение
© И. А. Корнеев, Д. Б. Батмаев
Кафедра урологии Санкт-Петербургского государственного медицинского университета имени акад. И. П. Павлова
Карцинома in situ мочевого пузыря – это распространенное заболевание с вариабельным клиническим течением и прогнозом. Продолжают развиваться методы диагностики, лечебные подходы и режим динамического наблюдения после лечения стандартизированы.
Ключевые слова: карцинома in situ; мочевой пузырь; диагностика; лечение.
Введение
Несмотря на то что рак мочевого пузыря является широко распространенным заболеванием, проблема карциномы in situ, которая встречается у 5-10 % пациентов с поверхностными формами этого заболевания, изучена недостаточно полно. Известно, что поверхностные формы рака мочевого пузыря в основном представлены высокодифференцированными, прогностически благоприятными новообразованиями, однако карцинома in situ имеет высокий потенциал злокачественного роста и прогрессирует чаще (54 %), чем новообразования категории Та и Т1 [13] (level 2).
Макроскопически карцинома in situ может быть не различима при цистоскопии и ее нередко принимают за воспалительные изменения уротелия. Она часто развивается мультифокально, в том числе и в верхних мочевых путях, мочеиспускательном канале и протоках предстательной железы [15]. Принято выделять три типа карциномы in situ [14]: 1) первичную, без предшествующих или сопутствующих папиллярных опухолей мочевого пузыря, 2) вторичную, которую выявляют при диспансерном наблюдении в связи с ранее выявленной папиллярной опухолью мочевого пузыря и 3) сопутствующую, обнаруженную одновременно с папиллярным новообразованием мочевого пузыря.
Классификация
Наибольшее распространение получила классификация по системе TNM, предложенная Международным противораковым союзом и принятая в большинстве стран мира в редакции 2009 г. Карцинома in situ обозначена категорией Tis: Carcinoma in situ.
В 1998 г. консенсус между ВОЗ и Международным обществом урологических патологов предложил следующее описание карциномы in situ [8]: «Новообразование характеризуется наличием клеток с большими, неправильной формы и с повышенным содержанием хроматина ядрами, которые могут встречаться как на всем протяжении всей толщи эпителия, так и на ее части». Часто наблюдается митотическая активность. Категория карцинома in situ в настоящее время включает в себя поражения эпителия, которые ранее описывали как выраженную атипию или дисплазию тяжелой степени. Несмотря на разнообразие морфологических форм карциномы in situ, в ней не выделяют различные степени дифференцировки.
Диагностика
Диагностика карциномы in situ в большинстве случаев построена на комбинировании цистоскопии, цитологического исследования мочи и множественных биопсий мочевого пузыря [12]. Окончательная верификация диагноза производится по результатам гистологического заключения биоптатов. При стандартной цистоскопии в белом свете карцинома in situ обычно представлена бархатистыми красными образованиями, однако более чем у половины больных может быть и невидим вообще [25]. Флуоресцентная цистоскопия с использованием 5-АЛК позволяет выявить незаметные при стандартном освещении образования, подозрительные на карциному in situ в 95 % случаев [7]. Перспективным методом диагностики является оптико-когерентная томография [4].
Несмотря на то что карцинома in situ представляет собой низкодифференцированную опухоль, в 22 -30 % случаев могут наблюдаться разногласия в интерпретации операционных биоптатов патологоанатомами [20]. Цитологическое исследование осадка мочи позволяет диагностировать рак in situ с чувствительностью и специфичностью, превышающими 90 % [3]. В последнее время появились сообщения о диагностической ценности в выявлении карциномы in situ новых маркеров рака мочевого пузыря – NMP22, Immunocyt, BTA , теломеразы, UroVysion, HA-HAase, BLCA-4, однако их специфичность невысока [9]. Анализ пролиферативной активности клеток осадка мочи также позволяет диагностировать поверхностные карциномы мочевого пузыря.
В тех случаях, когда низкодифференцированные клетки рака мочевого пузыря выявляют при цитологическом исследовании, а по результатам исследования резецированных фрагментов простатического отдела уретры и стенок мочевого пузыря опухоль не обнаружена, следует предполагать наличие карциномы in situ мочевых путей [22]. Для подтверждения диагноза следует получить порции мочи раздельно после катетеризации правого и левого мочеточника.
Рекомендации
Целесообразно проводить флуоресцентную цистоскопию ввиду ее более высокой специфичности по сравнению с цистоскопией в белом свете [1]. Следует выполнить биопсию всех подозрительных участков в мочевом пузыре. У больных с карциномой in situ и сопутствующими низкодифференцированными папиллярными опухолями Та и Т1 рекомендовано выполнять повторную ТУР. Выявление опухолевых клеток при цитологическом исследовании является показанием к проведению рандомизированной биопсии мочевого пузыря и простатического отдела уретры с использованием диаграммы мочевого пузыря. Правильная интерпретация результатов патологоанатомического исследования подразумевает раздельное направление патологоанатому в изолированных и соответствующим образом маркированных контейнерах [17]. Методом выбора для диагностики карциномы in situ мочевого пузыря является цитологическое исследование мочи до тех пор, пока не будет выполнено исследование смыва со стенок мочевого пузыря при цистоскопии.
Лечение
Если карцинома in situ сопровождает инвазивную опухоль мочевого пузыря, то лечение проводится в соответствии с тактикой, которая выбрана в связи с наличием инвазивной опухоли. Если карцинома in situ наблюдается при наличии опухоли Та или Т1, необходимо выполнить ТУР этих новообразований для уточнения стадии. В настоящее время не произведено рандомизированных исследований и не существует консенсуса о том, следует ли в этих случаях дальше лечить пациентов консервативно при помощи внутрипузырных инстилляций или использовать более агрессивный подход и произвести радикальную цистэктомию [24]. Специфичная для опухоли выживаемость после цистэктомии, выполненной по поводу карциномы in situ, высока, однако, такое лечение является избыточным для 40-50 % больных. Лучевую терапию не применяют [14].
Эффективность внутрипузырной терапии химиопрепаратами варьирует от 38 % до 53 %, что существенно ниже, чем эффективность внутрипузырного применения вакцины БЦЖ (72-93 %) [10]. Стандартный индукционный курс БЦЖ состоит из 6 еженедельных инстилляций, однако, у 40-60 % больных требуется проведение повторного курса [6]. Эффект от терапии должен быть достигнут в течение 3-6 месяцев. Сравнительные исследования применения монотерапии БЦЖ и комбинации БЦЖ с химиопрепаратами, в частности с митомицином С, не показали преимуществ комбинированного подхода [11]. Установлено, что у больных с карциномой in situ применение БЦЖ снижает риск прогрессирования на 35 % по сравнению с использованием химиопрепаратов или иммунотерапии [2]. Если через 6 месяцев консервативного лечения излечения не наступило, показана радикальная цистэктомия, так как установлено, что отсутствие ответа на БЦЖ-терапию является прогностически неблагоприятным фактором [21].
Токсичность БЦЖ
Несмотря на то что по сравнению с химиотерапевтическими средствами вакцина БЦЖ сопровождается более выраженными побочными эффектами, опыт, накопленный в настоящее время, позволяет минимизировать риски, и серьезные реакции наблюдают менее, чем в 5 % случаев [16].
Лечение при неудачной БЦЖ-терапии
Большинству пациентов, у которых не получилось добиться эффекта при помощи БЦЖ-терапии, выполняют радикальную цистэктомию. Если радикальное хирургическое вмешательство невозможно, используют консервативный подход: валрубицин [23], интерферон-альфа [18], бропиримин [19] или фотодинамическую терапию [5]. Диспансерное наблюдение за больными, получавшими лечение по поводу карциномы in situ, должно быть пожизненным.
Список литературы
1. Аль-Шукри С. Х., Данильченко Д. И., Корнеев И. А., Аль-Шукри А. С. Прогностическая ценность флуоресцентной цистоскопии с использованием 5-аминолевулиновой кислоты у больных раком мочевого пузыря // Нефрология. 2005. Т. 9. № 4. С. 80-84.
2. Аль-Шукри С. Х., Корнеев И. А., Кассем А. М., Козлов В. В. Применение адъювантной внутрипузырной иммунотерапии вакциной БЦЖ «Имурон» и прогноз у больных с поверхностными переходноклеточными карциномами мочевого пузыря // Тезисы докладов четвертого международного урологического симпозиума «Диагностика и лечение рака мочевого пузыря». Нижний Новгород. 2005. C. 10.
3. Аль-Шукри С. Х., Эмануэль В. Л., Корнеев И. А. и др. Прогностическая ценность цитологического исследования осадка мочи у больных раком мочевого пузыря // Нефрология. 2006. № 10 (2). C. 101-104.
4. Ткачук В. Н., Данильченко Д. И., Аль-Шукри А. С. Место оптикокогерентной томографии в диагностике рака мочевого пузыря // Урология. 2009. № 2 C.42-44.
5. Berger A. P., Steiner H., Stenzl A. et al. Photodynamic therapy with intravesical instillation of 5-aminolevulinic acid for patients with recurrent superficial bladder cancer: a -center study // Urology. 2003. № 61. P. 338-341.
6. De Reijke T. M., Kurth K. H., Sylvester R. J. et al. Bacillus Calmette-Guerin versus epirubicin for primary, secondary or concurrent carcinoma in situ of the bladder: results of a European Organization for the Re and Treatment of Cancer Genito-Urinary Group phase III trial (30906) // J. Urol. 2005. № 173. P. 405-409.
7. D’Hallewin M. A., Bezdetnaya L., Guillemin F. Fluorescence detection of bladder cancer: a review // Eur. Urol. 2002. № 42. P. 417-425.
8. Epstein J. I., Amin M. B., Reuter V. R., Mostofi F. K., the Bladder Consensus Conference Committee. The World Health Organization / International Society of Urological Pathology consensus classification of urothelial (transitional cell) neoplasms of the urinary bladder // Am. J. Surg. Path. 1998. № 22. P. 1435-1448.
9. Glas A. S., Roos D., Deutekom M., Zwinderman A. H., Bossuyt P. M. M., Kurth K. H. Tumor markers in the diagnosis of primary bladder cancer. A systematic review // J. Urol. 2003. № 169. P. 1975-1982.
10. Jakse G. et al., members of the EORTC GU Group. Intravesical BCG in patients with carcinoma in situ of the urinary bladder: long-term results of EORTC GU Group phase II protocol 30861 // Eur. Urol. 2001. № 40. P. 144-150.
11. Kaasinen E., Wijkstrom H., Malmstrom P. U. et al. Alternating mitomycin C and BCG instillations versus BCG alone in treatment of carcinoma in situ of the urinary bladder: a Nordic study // Eur. Urol. 2003. № 43 P. 637-645.
12. Kurth K. H., Schellhammer P. F., Okajima E. et al. Current methods of assessing and treating carcinoma in situ of the bladder with or without involvement of the proic urethra // Int. J. Urol. 1995. № 2 (Suppl 2). P. 8-22.
13. Lamm D. L. Carcinoma in situ // Urol. Clin. N. Am. 1992. № 19. P. 499-508.
14. Lamm D. L., Herr H. W., Jakse G. et al. Upd concepts and treatment of carcinoma in situ // Urol Oncol. 1998. № 4. P. 130-138.
15. Lamm D. L., van der Meijden A. P. M., Akaza H. et al. Intravesical chemotherapy and immunotherapy: how do we assess their effectiveness and what are their limitations and uses? // Int. J. Urol. 1995. № 2 (Suppl 2). P. 23-25.
16. Lamm D. L., van der Meijden A. P. M., Morales A. et al. Incidence and treatment of complications of bacillus Calmette-Guerin intravesical therapy in superficial bladder cancer // J. Urol. 1992. № 147. P. 596-600.
17. Lopez-Beltran A., Bassi P. F., Pavone-Macaluso M., Montironi R.. Handling and pathology reporting of specimens with carcinoma of the urinary bladder, ureter, and renal pelvis // Eur. Urol. 2004. № 45. P. 257-266.
18. O’Donnell M. A. et al., the National Bacillus Calmette-Guerin / Interferon phase 2 Investigator Group. Interim results from a national multicenter phase II trial of combination bacillus Calmette-Guerin plus interferon alpha-2b for superficial bladder cancer // J. Urol. 2004. № 172. P. 888-893.
19. Sarosdy M. F., Manyak M. J., Sagalowsky A. I. et al. Oral bropirimine immunotherapy of bladder carcinoma in situ after prior intravesical bacille Calmette-Guerin // Urology. 1998. № 51. P. 226-231.
20. Sharkey F. E., Sarosdy M. F. The ificance of central pathology review in clinical studies of transitional cell carcinoma in situ // J. Urol. 1997. № 157. P. 68-70.
21. Solsona E., Iborra I., Dumont R. et al. The 3-month clinical response to intravesical therapy as a predictive factor for progression in patients with high risk superficial bladder cancer // J. Urol. 2000. № 164. P. 685-689.
22. Solsona E., Iborra I., Ricos J. V. et al. Upper urinary tract involvement in patients with bladder carcinoma in situ (Tis): its impact on management // Urology. 1997. № 49. P. 347-352.
23. Steinberg G., Bahnson R., Brosman S. et al. Efficacy and safety of valrubicin for the treatment of bacillus Calmette-Guerin refractory carcinoma in situ of the bladder // J. Urol. 2000. № 163. P. 761-767.
24. Witjes J. A. Bladder carcinoma in situ in 2003: e of the art // Eur. Urol. 2004. № 45. P. 142-146.
25. Zaak D., Hungerhuber E., Schneede P. et al. Role of 5-aminolevulinic acid in the detection of urothelial premalignant lesions // Cancer. 2002. № 95. P. 1234-1238.
Carcinoma in situ of the urinary bladder
Korneyev I. A., Batmaev D. B.
Summary. Carcinoma in situ of the urinary bladder is a wide spread urological malignancy with unpredictable clinical course and prognosis. While diagnostic modalities develop the treatment and follow-up regimen ed have been standardized.
Key words: carcinoma in situ; urinary bladder; diagnostics; treatment.
Источник
Рак мочевого пузыря входит в число наиболее распространенных онкологических заболеваний. В России он составляет 4,5% от всех злокачественных опухолей, ежегодно диагностируются более 10 тысяч новых случаев. Наиболее распространено заболевание среди людей старше 67 лет, мужчины болеют примерно в 4,5 раза чаще по сравнению с женщинами.
В Европейской клинике можно получить лечение при раке мочевого пузыря по современным международным стандартам. Наши врачи выполняют хирургические вмешательства любой сложности, применяют противоопухолевые препараты последнего поколения с доказанной эффективностью.
Классификация и стадии рака мочевого пузыря
Подавляющее большинство злокачественных опухолей мочевого пузыря представлено уротелиальным раком (другое название – переходно-клеточный рак). Он развивается из клеток, которые образуют слизистую оболочку органа – уротелий (переходно-клеточный эпителий). Также уротелием выстлан мочеиспускательный канал, мочеточники, почечные лоханки, поэтому здесь могут встречаться такие же опухоли.
В 1-2% случаев (по данным Американского онкологического сообщества – American Cancer Society) в мочевом пузыре встречается плоскоклеточный рак (состоит из плоских клеток, напоминающих те, что входят в состав эпидермиса кожи), в 1% случаев – аденокарциномы (злокачественные опухоли из железистых клеток), менее чем в 1% случаев – мелкоклеточный рак (из нейроэндокринных клеток). Крайне редко в мочевом пузыре обнаруживают саркомы – злокачественные опухоли из соединительной ткани.
Классификация рака мочевого пузыря по стадиям осуществляется в соответствии с общепринятой системой TNM. Буквой T обозначают характеристики первичной опухоли, N – наличие очагов поражения в регионарных лимфоузлах, M – наличие отдаленных метастазов в других органах.

В упрощенном варианте, в зависимости от характеристик T, N и M, выделяют пять основных стадий рака мочевого пузыря:
- Стадия 0 – неинвазивная карцинома, она находится только в пределах слизистой оболочки и не прорастает глубже в стенку органа. Это так называемый рак на месте. Все остальные стадии – это инвазивный рак.
- Стадия I – опухоль углубилась в стенку мочевого пузыря, но не достигла мышечного слоя (T1). Нет очагов поражения в регионарных узлах (N0) и отдаленных метастазов (M0).
- Стадия II – опухоль проросла в мышечный слой органа (T2), но не проросла сквозь него. N0, M0.
- Стадия III – злокачественная опухоль проросла сквозь стенку мочевого пузыря и распространилась на окружающую его жировую клетчатку (T3) или в соседние органы (T4a). Опухолевые клетки на этой стадии могут распространяться в регионарные лимфоузлы (N1-3), отдаленных метастазов нет (M0).
- Стадия IV – злокачественная опухоль проросла в стенку таза или живота (IVA), либо имеются метастазы в отдаленных лимфоузлах, других органах (IVB). При этом первичная опухоль может иметь любые размеры, распространяться или не распространяться в регионарные лимфатические узлы.
Методы диагностики
К сожалению, не существует эффективных методов скрининга, которые можно было бы регулярно проводить у всех людей с целью ранней диагностики рака мочевого пузыря. Симптомы заболевания неспецифичны и могут напоминать проявления других патологий, например, цистита, аденомы простаты. Из-за этого злокачественные опухоли нередко диагностируют на поздних стадиях, когда лечить их уже намного сложнее.
Важно внимательно относиться к своему здоровью, обращать внимание на любые симптомы, которые сохраняются в течение длительного времени, и при их возникновении сразу обращаться к врачу.
При подозрении на рак мочевого пузыря применяют следующие виды диагностики:
- Цитологическое исследование мочи – её изучение под микроскопом на предмет наличия опухолевых клеток. Этот анализ иногда помогает диагностировать рак на ранних стадиях, но он не идеален.
- Исследование мочи на онкомаркеры – вещества, повышение уровней которых может свидетельствовать о злокачественной опухоли. Это также не совсем надежный тест.
- Цистоскопия – эндоскопическое исследование мочевого пузыря, когда в орган вводят специальный инструмент – цистоскоп – с видеокамерой. Наиболее информативна так называемая цистоскопия с синим светом. В мочевой пузырь вводят специальный препарат, который накапливается в опухолевых клетках и заставляет их флуоресцировать («светиться») в лучах синего света.
- Биопсия – исследование, во время которого получают фрагмент патологически измененной ткани и изучают в лаборатории под микроскопом. Это самый надежный способ разобраться, присутствуют ли в патологическом образовании раковые клетки, и является ли оно злокачественным. Материал для биопсии можно получить во время цистоскопии.
- Внутривенная пиелография. Пациенту внутривенно вводят раствор рентгеноконтрастного препарата, который затем начинает выводиться почками и «прокрашивает» мочевыводящие пути на рентгеновских снимках. Это помогает обнаружить опухоли.
- Ретроградная пиелография – исследование, во время которого рентгеноконтрастный раствор вводят через катетер, установленный в мочевом пузыре или мочеточнике.
- Ультразвуковое исследование помогает оценить размеры опухоли, выяснить, не распространилась ли она за пределы мочевого пузыря, проверить состояние почек. Под контролем УЗИ в обнаруженную опухоль можно ввести иглу и провести биопсию.
- Компьютерная томография и МРТ помогают оценить размеры, расположение, количество опухолевых очагов, обнаружить распространение рака на соседние органы, в лимфатические узлы, выявить метастазы. Под контролем КТ также можно провести биопсию с помощью иглы.
- Рентгенографию применяют для поиска метастазов в легких, костях.
Лечение рака мочевого пузыря
Тактику лечения при раке мочевого пузыря составляет команда врачей, в которую входят клинические онкологи, хирурги, урологи, химиотерапевты, радиотерапевты и другие специалисты.
Как выбирают лечение при раке мочевого пузыря?
Тактика лечения рака мочевого пузыря зависит от многих факторов: стадии опухоли, ее типа и молекулярно-генетических характеристик, общего состояния здоровья пациента, его возраста, наличия у него сопутствующих заболеваний. Прибегают к различным видам хирургических вмешательств, пациенту может быть назначена лучевая терапия, химиотерапия, иммунотерапия (в том числе введение препаратов внутрь мочевого пузыря).
Хирургическое лечение
В большинстве случаев злокачественную опухоль мочевого пузыря удается удалить хирургически. Есть разные виды операций, врач выбирает подходящую, в зависимости от стадии рака.
Иногда можно прибегнуть к трансуретральной резекции опухоли. Во время этого вмешательства не нужно делать разрез. Через мочеиспускательный канал (чаще всего пациент находится под общим наркозом) вводят специальный инструмент – резектоскоп. Он представляет собой петлю, которую накидывают на опухоль и отсекают ее. Для того чтобы уничтожить оставшиеся раковые клетки, прибегают к фульгурации (прижиганию током высокой частоты) или используют лазер.
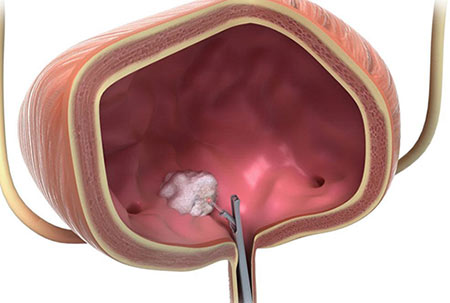
Трансуретральная резекция для лечения рака мочевого пузыря показана в двух случаях:
- Для того чтобы удалить поверхностно расположенные опухоли на ранних стадиях.
- Для того чтобы диагностировать рак, разобраться, насколько глубоко он прорастает в стенку мочевого пузыря.
Если опухоль проросла в мышечный слой стенки органа, но имеет небольшие размеры, можно выполнить резекцию – удалить только часть мочевого пузыря. На оставшуюся часть накладывают швы, и она продолжает выполнять свои функции, но в ней не может поместиться прежний объем мочи, и человеку приходится чаще посещать туалет. У резекции есть один большой недостаток: высок риск рецидива.

Большинству больных приходится выполнять цистэктомию – полностью удалять мочевой пузырь. Вместе с ним удаляют близлежащие лимфоузлы, у мужчин – семенные пузырьки и простату, у женщин – матку с шейкой и придатками, верхнюю часть влагалища. Операцию выполняют разными способами: через разрез, лапароскопически, в некоторых клиниках прибегают к роботизированной хирургии. После цистэктомии пациент остается без мочевого пузыря. Для того чтобы восстановить отток мочи, прибегают к разным вариантам реконструктивных операций:
- Врач может удалить часть сигмовидной кишки, сформировать из нее новый мочевой пузырь и соединить его с мочеточниками. Из участка кишки на поверхность кожи выводят отверстие: через него оттекает моча. При этом на коже постоянно придется носить мешочек для сбора мочи и периодически опорожнять его.
- Более совершенный вариант оперативного лечения – когда хирург формирует в кишке специальный клапан. Этот клапан перекрывает отверстие и не дает моче вытекать. Когда пациент хочет помочиться, он вставляет в отверстие катетер, клапан открывается, и моча вытекает по катетеру.
- Наиболее современная операция – когда хирург подсоединяет к одному концу кишки мочеточники, а к другому – мочеиспускательный канал. У большинства пациентов в течение нескольких месяцев восстанавливается способность к самостоятельным мочеиспусканиям, но зачастую остается недержание мочи по ночам.
Иногда запущенный рак, который не может быть удален хирургически, приводит к недержанию мочи или, напротив, создает препятствие для ее оттока. В таких случаях прибегают к паллиативным хирургическим вмешательствам.
Химиотерапия
Химиопрепараты при злокачественных опухолях мочевого пузыря могут решать разные задачи:
- Неоадъювантную химиотерапию проводят до хирургического вмешательства. Благодаря препаратам опухоль уменьшается, и ее становится проще удалить.
- Адъювантная химиотерапия применяется после операции. Если в организме пациента остались раковые клетки, химиопрепараты их уничтожают, за счет этого снижается риск рецидива.
- Химиолучевая терапия – когда химиопрепараты назначают «в помощь» лучевой терапии. За счет этого повышается эффективность лечения рака.
- Паллиативная химиотерапия – один из основных методов лечения на поздних стадиях, когда опухоль неоперабельна, имеются отдаленные метастазы. Химиопрепараты помогают продлить жизнь пациента и избавить от некоторых симптомов.
Злокачественные новообразования мочевого пузыря лечат цисплатином, гемцитабином, винбластином, метотрексатом, доксорубицином, карбоплатином, доцетакселом, паклитакселом. Эти препараты назначают в различных сочетаниях. Если пациент не может переносить два и более препарата из-за побочных эффектов, назначают один препарат, чаще всего цисплатин или гемцитабин.
На ранних стадиях проводят внутрипузырную химиотерапию: химиопрепарат вводят внутрь мочевого пузыря через мочеиспускательный канал.
Лучевая терапия
Показания к лечению лучевой терапией при злокачественных опухолях мочевого пузыря:
- Лечение опухоли на ранних стадиях, если пациенту противопоказана операция, либо если во время хирургического вмешательства удален не весь мочевой пузырь.
- Для борьбы с симптомами, вызванными злокачественной опухолью.
Иммунотерапия рака мочевого пузыря
Иммунитет человека умеет уничтожать не только болезнетворные микроорганизмы, проникшие извне, но и собственные клетки, в генах которых возникли «ошибки». Именно из-за таких «ошибок» нормальная клетка превращается в раковую. Однако, опухолевые клетки умеют «обманывать» иммунитет, и используют для этого сложные молекулярные механизмы.
Так, иммунная система использует некоторые молекулы (они называются контрольными точками), чтобы подавлять собственную активность и не атаковать нормальные ткани организма. На поверхности иммунных клеток находится белок PD-1, который, взаимодействуя с белком PD-L1 на поверхности других клеток, подавляет иммунную реакцию. Для того чтобы снять блок с иммунной системы, для лечения применяют две группы иммунопрепаратов:
- Блокаторы PD-1: пембролизумаб (Кейтруда), ниволумаб (Опдиво).
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенцио), дурвалумаб (Имфинци).
Все эти препараты вводят внутривенно через каждые 2-3 недели. Обычно их назначают пациентам, у которых опухоль не реагирует на химиотерапию и продолжает прогрессировать.
Спустя несколько недель после трансуретральной резекции могут быть назначены внутрипузырные введения вакцины БЦЖ. Она стимулирует местные иммунные механизмы, которые уничтожают оставшиеся опухолевые клетки. БЦЖ вводят в мочевой пузырь через мочеиспускательный канал, обычно раз в неделю в течение шести недель.
Каким будет план лечения на разных стадиях рака мочевого пузыря?
Лечебная тактика на разных стадиях выглядит примерно следующим образом:
- На стадии 0 (когда опухоль находится в верхнем слое слизистой оболочки): трансуретральная резекция с последующим введением в мочевой пузырь вакцины БЦЖ или химиопрепаратов.
- На стадии I (опухоль в слизистой оболочке, которая не вросла в мышечный слой стенки) лечение начинают с трансуретральной резекции, но ее проводят не для того, чтобы вылечить пациента, а чтобы определить стадию рака. Далее может быть проведена повторная трансуретральная резекция с последующим введением в мочевой пузырь БЦЖ или химиопрепаратов. При больших, множественных и агрессивных опухолях рекомендуется удалить мочевой пузырь. Если операция противопоказана из-за слабого здоровья пациента, назначают лучевую или химиолучевую терапию, но шансы на успешное лечение в таком случае ниже.
- На стадии II (опухоль проросла в мышечный слой) удаляют мочевой пузырь, до или после операции проводят курс лечения химиотерапией. У немногих пациентов удается удалить только часть мочевого пузыря. Иногда при небольших опухолях проводят трансуретральную резекцию с последующей химиотерапией и лучевой терапией, но это сомнительный подход, не все врачи с ним согласны.
- На стадии III (опухоль распространяется за пределы мочевого пузыря) выполняют цистэктомию, проводят курс адъювантной или неоадъювантной химиотерапии. Если пациент не может перенести операцию, врач может назначить трансуретральную резекцию, химиотерапию, лучевую терапию, иммунотерапию.
- На стадии IVA (опухоль прорастает в стенку брюшной полости, таза) лечение начинают с курса химиотерапии или химиолучевой терапии. Когда опухоль уменьшается в размерах, может быть проведено хирургическое вмешательство. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты.
- На стадии IVB (имеются отдаленные метастазы) лечение начинается с химиотерапии или химиолучевой терапии. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты. Проводят паллиативные хирургические вмешательства, направленные на восстановление оттока мочи или борьбу с недержанием.
Как лечить опухоли мочевого пузыря с метастазами?
На момент постановки диагноза у 10-15% больных со злокачественными новообразованиями мочевого пузыря уже имеются отдаленные метастазы. У 30% пациентов после радикального лечения (полного удаления опухоли) происходит рецидив в мочевом пузыре или в виде метастазов.
Бороться с метастазировавшим раком сложно. Обычно радикальное хирургическое лечение и наступление ремиссии невозможно. Лечение начинают с химиотерапии. Учитывают состояние здоровья пациента и молекулярно-генетические характеристики опухолевых клеток:
- Если больному не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин или DDMVAC (уплотненная доза MVAC): метотрексат + винбластин + доксорубицин (адриамицин) + цисплатин.
- Больному противопоказан цисплатин, но не противопоказан карбоплатин: гемцитабин (Гемзар) + карбоплатин.
- Больному противопоказан цисплатин, и в опухолевых клетках обнаружен маркер PD-L1: гемцитабин (Гемзар) + карбоплатин, атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
- Больному противопоказаны все препараты платины: атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
Если на фоне применения препаратов первой линии заболевание продолжает прогрессировать, назначают препараты второй линии:
- После лечения препаратами платины: пембролизумаб (Кейтруда), атезолизумаб (Тецентрик), ниволумаб (Опдиво), дурвалумаб (Имфинзи), авелумаб (Бавенцио), эрдафитиниб (Балверса – для пациентов, у которых обнаружены мутации FGFR2 и FGFR3).
- После лечения ингибиторами контрольных точек, если пациенту противопоказан цисплатин: гемцитабин (Гемзар) + карбоплатин.
- После лечения ингибиторами контрольных точек, если пациенту не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин, DDMVAC.
Параллельно с противоопухолевыми препаратами может применяться лучевая терапия.
Какие методы лечения рака мочевого пузыря наиболее эффективны?
На этот вопрос нет однозначного ответа. Всё зависит от стадии, типа, молекулярно-генетических характеристик опухоли, состояния здоровья пациента, наличия и отсутствия у него противопоказаний.
Оптимальные методы лечения злокачественных опухолей мочевого пузыря прописаны в специальных документах – протоколах. Они составлены на основе результатов многочисленных клинических исследований с участием тысяч пациентов по всему миру и регулярно пересматриваются, обновляются.
Врачи в Европейской клинике руководствуются последними версиями американских, европейских, израильских протоколов лечения.
Насколько эффективны современные методы лечения, каков прогноз?
В среднем в течение 5 лет остаются в живых 77% пациентов, в течение 10 лет – 70%, в течение 15 лет – 65%. Пятилетняя выживаемость при злокачественных опухолях мочевого пузыря зависит от стадии:
- Стадия 0-98%.
- Стадия I-88%.
- Стадия II-63%.
- Стадия III-46%.
- Стадия IV-15%.
В настоящее время проводятся клинические исследования, врачи ищут более эффективные способы борьбы с заболеванием, а значит, есть надежда, что в ближайшем будущем эти показатели улучшатся.
Источник
