Рак мочевого пузыря гены
Рак мочевого пузыря (РМП) одна из актуальных проблем в онкоурологии. По данным ВОЗ, около 3% всех злокачественных заболеваний составляет рак мочевого пузыря. В 19982008 гг. заболеваемость раком мочевого пузыря на 100 000 населения в РФ возросла с 7,90 до 9,16 (+ 15,9%). В структуре онкологической заболеваемости в 2008 г. доля злокачественных новообразований мочевого пузыря составила 4,5% [1,2]. У мужчин опухоли мочевого пузыря отмечают значительно чаще, чем у женщин (4:1). Большую часть опухолей мочевого пузыря у мужчин объясняют более частым контактом с канцерогенными веществами и более длительной задержкой мочи в пузыре.
Общепризнано, что РМП онкологическое заболевание с широким разнообразием факторов риска. Известно, что пусковым механизмом развития большинства онкологических заболеваний является индивидуальная генетическая предрасположенность, провоцируемая разнообразными внешнесредовыми факторами, прежде всего химической природы. По данным литературы к факторам риска РМП относятся канцерогены табачного дыма [3, 4, 5], полиароматические углеводороды (ПАУ) [6], некоторые лекарственные препараты и другие, объединенные общим названием ксенобиотики [7, 8]. Необходимым условием проявления действия ксенобиотиков является повышенная чувствительность организма, которая формируется при наличии определенного генетического фона. Канцерогены, попадая в организм, подвергаются биотрансформации под воздействием ферментов, активность которых контролируется генами системы детоксикации ксенобиотиков. При неблагоприятных комбинациях генотипов возрастает риск развития рака мочевого пузыря. В этой связи представляется важным изучение особенностей генетических систем, участвующих в детоксикации ксенобиотиков у больных раком мочевого пузыря. Биотрансформация ксенобиотиков состоит из 2 фаз. В 1 фазе, контролируемой ферментами цитохромов P450 и др., происходит активация ксенобиотиков с образованием активных промежуточных метаболитов, которые под воздействием ферментов 2 фазы (глутатионS-трансферазы и др.) преобразуются в водорастворимые нетоксичные компоненты и выводятся из организма [7, 8, 9].
Еще одним фактором риска развития рака мочевого пузыря является ионизирующее излучение. Сообщалось о дву, четырехкратном увеличении риска развития вторичных злокачественных опухолей мочевого пузыря после применения дистанционной лучевой терапии при гинекологических злокачественных опухолях [10]. У пациентов, получавших лечение по поводу рака предстательной железы, заболеваемость раком мочевого пузыря была статистически значимо ниже у больных после радикальной простатэктомии, чем у подвергнутых дистанционной лучевой терапии [11].
Однако не все случаи взаимодействия организма с химическими и физическими (ионизирующее облучение) канцерогенами запускают канцерогенез. Существуют многочисленные механизмы репарации поврежденной ДНК. Идентифицировано более 100 генов, регулирующих процессы репарации. Одним из наиболее изучаемых генов системы репарации ДНК является ген XRCC1. Но ассоциации полиморфных вариантов этого гена с развитием РМП еще не достаточно широко изучены. Белок, кодированный геном XRCC1, является важным компонентом эксцизионной репарации оснований, исправляя поврежденные основания и одноцепочечные разрывы, вызванные ионизирующей радиацией и алкилирующими агентами. Наиболее часто встречающимся полиморфным вариантом является Arg280His [12, 13, 14]. Также Arg280His аллель связан с постоянным повреждением ДНК, появлением мутаций, остановкой клеточного цикла, вызванной ионизирующей радиацией [12]. Эти исследования предполагают, что индивиды с аллелью Arg280His обладают меньшей способностью к репарации повреждений ДНК [13]. Функциональная значимость полиморфного варианта Arg280His не установлена, однако известно, что аллель 280His расположен в регионе пролиферирующего антигенсвязывающего ядерного фактора, ассоциированного с чувствительностью к блеомицину [15].
Цель работы: исследование ассоциации полиморфных вариантов генов цитохрома Р450 (CYP1А1), глутатион-8-трансфераз (GSTM1, GSTP1) и гена репарации ДНК (XRCC1) с риском развития рака мочевого пузыря.
МАТЕРИАЛЫ И МЕТОДЫ
Основную группу составили 146 пациентов с гистологически верифицированным диагнозом рак мочевого пузыря, находившихся на стационарном лечении в Республиканском онкологическом диспансере и Республиканской клинической больнице г. Уфы (РБ) за период с 2005 по 2009 гг. Средний возраст больных составил 61,23 ± 11,22 лет.
В группу сравнения вошел 241 пациент без выявленных онкологических заболеваний. Средний возраст: 59,38 ± 10,38 лет.
ДНК выделяли из лимфоцитов периферической венозной крови методом фенольно-хлороформной экстракции. Анализ полиморфных локусов генов CYP^1 (Ile462Val), GSTP1 (Ile105Val) и XRCC1 (Arg280His) проводили методом полимеразной цепной реакции (ПЦР) с последующей рестрикцией амплифицированных фрагментов, соответствующими эндонуклеазами: HindII, BsoMAI («Сибэнзим», Россия). Делеционный полиморфизм гена GSTM1 (del) исследовали в стандартных условиях по ранее описанной методике [11]. Результаты амплификации и рестрикции оценивали при помощи вертикального электрофореза в 7% полиакриламидном геле при напряжении 200-300В (10 В/см). В качестве буфера использовали трис-боратный буфер (ТВЕ). По окончании электрофореза гель окрашивали раствором бромистого этидия (0,1мкг/мл) в течение 10 минут и визуализировали в проходящем ультрафиолетовом свете.
Математическую обработку результатов исследования проводили на IBM-Pentium IV с использованием статистических программ BIOSTAT (Primer of Biostatistics, 4th Edition, S.A.Glantz, McGraw-Hill), а также в программах Statistica, Microsoft Excel и Microsoft Access.
Достоверность различий в распределении частот аллелей и генотипов между группами и ассоциацию с клиническим течением заболевания выявляли, сравнивая выборки с использованием критерия %2 с поправкой Иэйтса с помощью программы BIOSTAT. Статистически значимыми считали различия при p <0.05. Относительный риск заболевания по конкретному признаку вычисляли как соотношение шансов, доверительный интервал для относительного риска рассчитывали по стандартным формулам, расчеты проводили в программе Statistica v. 6.0 [16].
Силу ассоциации генетических маркеров с риском развития РМП оценивали по значениям показателя отношения шансов (odds ratio, OR). OR > 1,5 рассматривали как положительную ассоциацию заболевания с генотипом или аллелем (фактор риска), OR < 0,5 как отрицательную ассоциацию (фактор устойчивости).
РЕЗУЛЬТАТЫ
Данные по распределению частот генотипов и аллелей полиморфизмов генов детоксикации ксенобиотиков (CYP1А1, GSTM1 и GSTP1) и гена репарации ДНК (XRCC1) в группах больных РМП и здоровых представлены в таблице
Сравнительный анализ распределения генотипов и аллелей полиморфного варианта Ile462Val гена CYP1A1 общей выборки больных РМП и контрольной группы выявил статистически значимые результаты (X2 = 71,37; р = 0,0001 и X2 = 74,8; р = 0,0005 соответственно). У больных РМП по сравнению с контрольной группой обнаружено статистически значимое повышение гетерозигот Ile/Val (35% и 6% соответственно, х2 = 53,4, р = 0,0005) и гомозигот по мутантному гену Val/Val (7% и 1% соответственно, %2 = 9,4, р = 0,003). Одновременно, генотип Ile/Ile достоверно чаще встречался в группе здоровых индивидов 93%, тогда как в группе больных его частота оказалась меньше и составила 59% (х2 = 69,0, р = 0,0005). Частота S аллеля *Val полиморфного локуса Ile462Val гена CYP1А1 у больных РМП оказалась повышенной почти в 8,4 раза (OR = 8,4, 95% CI 4.7715.07).
Таблица 1. Распределение частот генотипов и аллелей полиморфных локусов генов цитохрома P450, глутатион^-трансфераз и репарации ДНК у больных РМП и в контрольной группе
| Генотипы и аллели | РМП | Контроль | х | р | OR (95% CI) | ||
| Абс. | Частота | Абс. | Частота | ||||
| Полиморфный локус Ile462Val гена CYP1A1 | |||||||
| Ile/Ile | 82 | 0,59 | 225 | 0,93 | 69,0 | 0,0005 | 0,1 (0,05-0,19) |
| Ile/Val | 50 | 0,35 | 14 | 0,06 | 53,4 | 0,0005 | 8,8 (4,46-17,62) |
| Val/Val | 10 | 0,07 | 2 | 0,01 | 9,4 | 0,003 | 9,1 (1,83-60,65) |
| N = 142 | N = 241 | ||||||
| Val | 70 | 0,25 | 18 | 0,03 | 74,8 | 0,0005 | 8.4 (4,77-15,07) |
| Ile | 214 | 0,75 | 464 | 0,96 | |||
| Делеционный полиморфизм гена GSTM1 | |||||||
| Норма (GSTM1*N) | 93 | 0,64 | 140 | 0,59 | 0,9 | 0,36 | 1,4 (0,80-1,96) |
| Делеция (GSTM1*0) | 52 | 0,36 | 98 | 0,41 | |||
| N = 145 | N = 238 | ||||||
| Полиморфный локус Ile105Val гена GSTP1 | |||||||
| Ile/Ile | 80 | 0,55 | 150 | 0,63 | 2,5 | 0,12 | 0,7 (0,45-1,09) |
| Ile/Val | 54 | 0,37 | 81 | 0,34 | 0,2 | 0,67 | 1,1 (0,72-1,77) |
| Val/Val | 12 | 0,08 | 7 | 0,03 | 4,3 | 0,04 | 3,0 (1,05-8,53) |
| N=146 | N=238 | ||||||
| Val | 78 | 0,26 | 90 | 0.19 | 6,5 | 0,01 | 1,6 (1,11-2,28) |
| Ile | 214 | 0,75 | 392 | 0,84 | |||
| Полиморфный локус Arq280His гена XRCC1 | |||||||
| Arq/Arq | 53 | 0,51 | 80 | 0,68 | 5,84 | 0,02 | 0,5 (0,28-0,88) |
| Arq/His | 29 | 0,28 | 30 | 0,29 | 0,07 | 0,79 | 1,13 (0,60-2,15) |
| His/His | 22 | 0,21 | 8 | 0,08 | 8,58 | 0,004 | 3,7 (1,47-9,54) |
| N=104 | N=118 | ||||||
| *His | 73 | 0,35 | 46 | 0,19 | 12,94 | 0,001 | 2,2 (1,42-3,51) |
| *Arq | 135 | 0,65 | 190 | 0,81 | |||
| Примечание: жирным шрифтом выделены значения, демонстрирующие достоверные различия между группами. | |||||||
Проведенный анализ частоты делеции гена GSTM1 достоверных различий между группами не выявил (х = 0,85; p = 0,36).
Сравнительный анализ распределения частот генотипов и аллелей маркера Ile105Val гена GSTP1 выявил статистически достоверные различия между группой больных РМП и здоровыми индивидами (х2 = 6,34, р = 0,042 и х2 = 6,5, р = 0,01 соответственно). Частота генотипа Val/ Val у больных РМП увеличена до 8,0%, в то время как у здоровых индивидов данный генотип встречался с частотой 3,0% (%2 = 4,3, р = 0,04). С другой стороны, генотип Ile/Ile встречается чаще в группе здоровых индивидов (63,0%) по сравнению с больными РМП (55,0%), однако данный результат не достиг статистической значимости (х2 = 2,45; р = 0,12). Показано, что аллель Val повышает риск развития РМП в 1,6 раза (OR = 1,6, 95%CI 1.19-1.99).
Анализ распределения частот генотипов и аллелей полиморфного локуса Arg280His гена XRCC1 выявил статистически значимые различия между группами больных РМП и здоровых индивидов (Х2 = 11,19, р = 0,004 и х2 = 12,94, р = 0,001 соответственно). Выявлено, что частота встречаемости генотипа His/His у больных РМП выше (21%), чем в контрольной группе (8%) (х2 = 8,58, р = 0,004). Одновременно было показано, что в группе здоровых частота генотипа Arg/Arg увеличена до 68% по сравнению с группой больных РМП (51%) (х2 = 5,84, р = 0,02).
Вместе с тем, частота аллеля *His увеличена почти в 2,2 раза у больных РМП по сравнению со здоровыми индивидами (OR = 2,23 95% CI 1.42-3.51).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящее время многими учеными мира ведутся исследования по выяснению роли генетической предрасположенности факторов среды в формировании мультифакториальных заболеваний, к которым можно отнести и РМП. Известно, что большинство чужеродных веществ (ксенобиотиков), попадая в организм человека, не оказывает прямого биологического эффекта, а вначале подвергается различным превращениям биотрансформации. Основные фазы обезвреживания ксенобиотиков функционируют как единый четко скоординированный комплекс, и любые отклонения в его работе сопровождаются нарушением процессов обезвреживания с непредсказуемыми, зачастую вредными последствиями для организма.
Доказано, что у человека существует генетический контроль метаболизма, поэтому в зависимости от особенностей генома различные индивидуумы могут либо сохранять устойчивость или, наоборот, обнаруживать повышенную чувствительность к повреждающим агентам. Предполагается, что индивидуальная предрасположенность к онкологическим заболеваниям также обусловлена различиями в детоксикации ксенобиотиков.
Реактивные метаболиты проканцерогенов, образовавшиеся в процессе метаболизма, способны прочно связываться с участками молекулы ДНК, образуя так называемые аддукты, нарушающие ее нормальную структуру и функции. Количество аддуктов в той или иной ткани и длительность их существования могут служить одним из показателей индивидуальной чувствительности к канцерогенам. У курящих женщин уровень аддуктов более высокий, чем у мужчин, и это соответствует предварительным эпидемиологическим наблюдениям о большей чувствительности женщин к канцерогенному действию табачного дыма. Индивидуальные различия здесь таковы, что разница в уровне аддуктов бенз(а)пирена с ДНК в стенке мочевого пузыря 70 раз, в пищеводе 100 раз [17].
Активность систем распознавания аддуктов, их удаления и восстановления первичной структуры ДНК значительно варьируют. Крайние формы известны в качестве наследственных заболеваний. Наследственные заболевания, предрасполагающие к канцерогенезу, касаются не только систем репарации ДНК, но и определенные гены нормальных клеток обладают особой чувствительностью к действию химических канцерогенов. Это так называемые онкогены. По-видимому, их функция состоит в регуляции клеточного роста и дифференциации клеток. Химические мутации именно этих генов активно трансформируют клетку в сторону неопластических процессов. В клетках существуют гены, ответственные за синтез белков, и так называемые гены-супрессоры клеточного роста. Если ген-супрессор мутировал, то в клетке не синтезируются белки, тормозящие ее размножение, создаются условия для канцерогенеза. Механизмы репарации генома замещают поврежденный участок молекулы ДНК с восстановлением ее нормальных функций, поэтому далеко не любое взаимодействие нуклеиновой кислоты и ксенобиотика завершается канцерогенезом.
Полученные нами результаты позволяют считать генотипы Ile/ Val (OR= 8,8, 95% CI 4,46-17,62), Val/ Val (OR = 9,1, 95% CI 1,83-60,65) и аллель Val (OR = 8,4, 95% CI 4,7715,07) полиморфного варианта Ile462Val гена CYP1А1; генотип Val/ Val (OR = 3,0; 95% CI 1,058,53) и аллель Val (OR = 2,2, 95% CI 1,422,28) полиморфного локуса Ile105Val гена GSTP1; а также генотип His/His (OR = 3,7, 95% CI 1,47-9,54) и аллель His (OR = 1,6, 95% CI 1,42-3,51) полиморфного локуса Arg280His гена XRCC1 генетическими маркерами повышенного риска развития РМП.
Генотипы Ile/Ile (OR = 0,1, 95% CI 0,05-0,19) и аллель Ile (OR = 0,1, 95% CI 0,07-0,2) полиморфного локуса Ile462Val гена CYP1A1; генотип Arg/Arg (OR = 0,5, 95% CI 0,280,88) и аллель *Arg (OR = 0,45, 95% CI 0,29-0,70) полиморфного локуса Arg280His гена XRCC1 являются факторами устойчивости к развитию злокачественных новообразований мочевого пузыря.
ЗАКЛЮЧЕНИЕ
Приведенные данные свидетельствует о важной роли ферментов детоксикации ксенобиотиков и репарации ДНК в развитии РМП. Учитывая то, что повышенный риск развития РМП связан с наличием определенных аллельных вариантов генов ферментов прооксидантов и антиоксидантов, можно предположить, что цитохромы P450 и глутатионзависимые ферменты, а также гены репарации ДНК могут быть важной составной частью генетической структуры подверженности развития РМП.
Ключевые слова: Рак мочевого пузыря, генетические маркеры, полиморфизм. Keywords: Bladder cancer, genetic markers, polymorphism.
ЛИТЕРАТУРА
P.1496-1501.
- Chrouser K., Leibovich B. et al. Bladder cancer risk following primary and adjuvant external beam radiation for prostate cancer // J Urol. 2006. Vol. 174, № 1. P. 107-110.
- Boorjian S., Cowan J.E., Konety B.R., DuChane J., Tewari A., Carroll P.R., Kane C.J. Cancer of the Prostate Strategic Urologic Research Endeavor Investigators. Bladder cancer incidence and risk factors in men with prostate cancer: results from Cancer of the Prostate Strategic Urologic Research Endeavor // J Urol. 2007. Vol.177, № 3. P. 883-887.
- Moullan N., Cox D. G., Angele S., Romestaing P., Gerard J.-P., Hall J. Polymorphisms in the DNA repair gene XRCC1, breast cancer risk and response to radiotherapy // Cancer epidemiology, biomarkers & prevention. 2003. Vol. 12. P. 1168.
- Park J. Y., Lee S. Y., Jeon H.-S., Bae N. C., Chae S. C. Polymorphism of the DNA repair gene XRCC1 and risk of primary lung cancer // Cancer epidemiology, biomarkers & prevention. 2002. Vol. 11. P. 23-27.
- Shen M., Hung R.J., Brennan P. Polymorphisms of the DNA repair genes XRCC1, XRCC3, XPD interaction with environmental exposures and bladder cancer risk in a case-control study in Northern Italy // Cancer epidemiology, biomarkers & prevention. 2003. Vol. 12. P. 1234-1240.
- Duell E.J., Wiencke J.K., Cheng T.J., Varkonyi A., Zuo Z.F., Ashok T.D., Mark E.J., Wain J.C., Christiani D.C., Kelsey K.T. Polymorphisms in the DNA repair genes XRCC1 and ERCC2 and biomarkers of DNA damage in human blood mononuclear cells // Carcinogenesis. 2000. Vol. 21, № 5. P. 965-71.
- www.statistica.com StatSoft Inc.-USA.Statistica v.6.0
- Белицкий Г.А. Прогноз канцерогенности фармакологических средств и воспомогательных веществ в краткосрочных тестах // Ведомости фармкомитета. 1999. № 1. С. 18-31.
Источник

Создание генетических классификаций — приоритетное направление в онкологии. С распространением методов секвенирования нового поколения стал возможен крупномасштабный анализ генетического разнообразия опухолей.
Показателен с этих позиций рак мочевого пузыря — наиболее частая злокачественная опухоль мочевыводящих путей. Это заболевание имеет выраженную склонность к рецидивированию и прогрессированию, отличается тяжелым течением и высокой степенью инвалидизации. Традиционно выделяют поверхностные и мышечно-инвазивные новообразования мочевого пузыря, которые имеют выраженную биологическую неоднородность. Эти различия определяются не только морфологическим вариантом и степенью инвазии опухоли, но и молекулярным профилем, а также генетическими аберрациями.
Данные масштабных исследований Пекинского института геномики [1] и Атласа ракового генома (The Cancer Genome Atlas, TCGA) [2] позволили расширить представления о генетической основе мышечно-инвазивных карцином мочевого пузыря. В ходе канцерогенеза подвергаются мутациям в основном те гены, продукты которых регулируют клеточный цикл: TP53 (как же без вовлечения «хранителя генома») и RB1 (ген, кодирующий онкосупрессорный белок ретинобластомы), CDKN1A, CDKN2A (продукты этих генов — белки-ингибиторы циклинзависимых киназ 1А и 2А), CCND1 (кодирует циклин D1, регулятор клеточного цикла в период перехода от G1 к S-фазе), MDM2 (его продукт является р53-специфичной Е3-лигазой, осуществляющей негативную регуляцию р53 путем его протеасомной деградации и снижения транскрипционной активности) [1, 2]. Согласно данным TCGA, гены-«контролеры» клеточного цикла повреждаются в 93 % случаев опухолей этой локализации. Чаще всего под удар попадают TP53 и CDKN2A [2].
Обнаружена важная роль эффекта эпистаза (влияния мутаций друг на друга). В отсутствии эпистаза накопление канцерогенных мутаций напоминало бы собирательство по принципу «чем больше, тем лучше»: значимость новой мутации не зависит от уже присутствующих в геноме, так что порядок их возникновения не важен. При выраженном эпистазе роль каждой новой мутации определяется тем, какие мутации уже закрепились в геноме ранее. Новые аберрации идут по пути «разрешенных» траекторий, что повышает вероятность их предсказания. Некоторые генетические изменения оказались взаимоисключающими. Например, мутации генов CDKN2A и TP53, CDKN2A и RB1, TP53 и MDM2 [3].
Определенные участки генов характеризуются крайне высокой мутабельностью. При раке мочевого пузыря такие «горячие точки» выявляются в генах PIK3CA (фосфатидилинозитол-3-киназа) в 25 % случаев, EGFR (рецептор эпителиального фактора роста) в 9 %, HRAS в 6 % и NRAS в 2,4 % (гены семейства Retrovirus Associated DNA Sequences, кодируют белки суперсемейства малых гуанозинтрифосфатаз), PTEN (ген-супрессор опухолевого роста, его продукт — фермент липидная фосфатаза) в 6 % и FGFR3 (кодирует рецептор фактора роста фибробластов 3) в 19 %. Мутации FGFR3 часто регистрируются в мышечно-инвазивных карциномах мочевого пузыря на более ранних стадиях (21 % при pT2 (р — патологоанатомическая классификация) по сравнению с 10 % при pT3-T4) и ассоциированы с увеличением выживаемости пациентов [3].
Мутации и гиперэкспрессия онкогена ERBB2 (HER2/neu), кодирующего тирозинкиназный рецептор, обнаружены с высокой частотой (14 %).
Профиль мутационных изменений может стать основой для формирования принципов терапии. Например, чувствительность к терапии цисплатином увеличивается в опухолях с аберрантным ERBB2, а также при повреждении генов системы репарации ДНК, включая ген эксцизионной репарации ERCC2. Применение цисплатин-содержащих схем терапии позволит достичь лучшего лечебного патоморфоза опухоли и даже снизить частоту проведения радикальной цистэктомии у данной группы пациентов [4, 5].
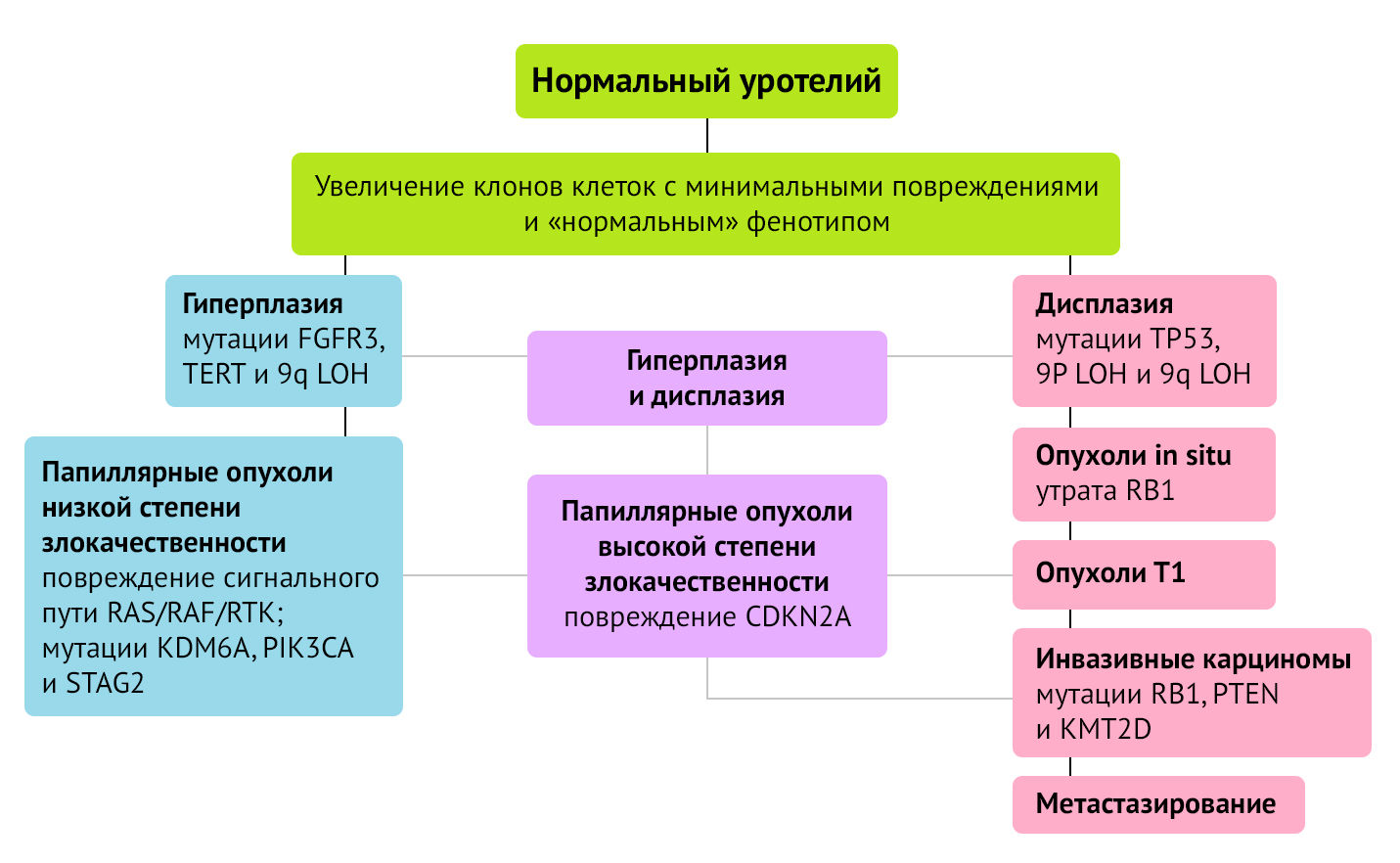
Классические мутации в TP53 отмечены при мышечно-инвазивном раке и метастатическом процессе, в то время как мутации в FGFR3 чаще встречаются при поверхностных формах рака мочевого пузыря. При обнаружении обоих типов мутаций закономерно предположить, что такие опухоли прогрессировали от неинвазивного к инвазивному раку, приобретая в процессе развития новые генетические аберрации (рис.1) [6, 7].
.

Рисунок 1. Пути канцерогенеза рака мочевого пузыря
Неинвазивный рак мочевого пузыря — поверхностные опухоли слизистой оболочки мочевого пузыря с возможным прорастанием в подслизистый слой, но без мышечной инвазии (рТа и рТ1).
Инвазивный рак мочевого пузыря — с прорастанием в мышечный слой (≥рТ2).
При неинвазивных опухолях отмечена высокая частота мутаций FGFR3 и генов семейства RAS:
FGFR3 (fibroblast growth factor receptor 3) — ген, кодирующий рецептор фактора роста фибробластов 3. Его гиперэкспрессия при неинвазивном типе рака мочевого пузыря обеспечивает активность каскада RAS/RTK/RAF с усилением митогенных сигналов и пролиферацией клона клеток.
TERT — ген, кодирующий теломеразную обратную транскриптазу (TERT, telomerase reverse transcriptase), которая входит в состав фермента теломеразы. Высокая теломеразная активность приводит к стойкому выживанию клеток.
Потеря гетерозиготности (loss of heterozygosity — LOH) хромосомного района 9q. Суть LOH заключается в утрате (структурной или функциональной) одного из аллелей гетерозиготного генотипа. Потеря аллеля позволяет проявиться фатальным рецессивным мутациям в оставшемся аллеле.
RAS/RAF/RTK сигнальный путь — цепь протеинов и киназ: белок саркомы крыс (RAS), митоген активированная протеинкиназа (RAF), тирозинкиназные рецепторы ростовых факторов (RTK). Этот каскад контролирует клеточную пролиферацию, клеточный цикл и способность к миграции.
KDM6A — ген, кодирующий фермент — гистоновую деметилазу, которая отщепляет метильные группы у триметилированного и диметилированного лизина.
PIK3CA — фосфатидилинозитол-3-киназа, способствующая передаче AKT-сигналов (сигнальный путь клеточного выживания), усилению роста, белок-синтетической активности и устойчивости к апоптозу.
STAG2 — ген, кодирующий стромальный антиген 2 или субъединицу комплекса когезина. Он контролирует процесс разделения сестринских хроматид при клеточном делении.
CDKN2A — ингибитор циклин-зависимой киназы 2A.
TP53 — ген транскрипционного фактора TP53 с онкосупрессорной активностью.
Потеря гетерозиготности (loss of heterozygosity — LOH) хромосомного района 9p.
RB1 — ген, кодирующий белок ретинобластомы (онкосупрессор).
PTEN (гомолог фосфатазы и тензина) — ген, кодирующий супрессор опухолей. Его активность ингибирует путь клеточного выживания АКТ за счет дефосфорилирования сигнальных молекул.
KMT2D — ген, продуктом которого является гистоновая лизин N-метилтрансфераза 2D. Функция — эпигенетическая активация транскрипции [7, 8].
Источники:
- Guo G.et al. Whole-genome and whole-exome sequencing of bladder cancer identifies frequent alterations in genes involved in sister chromatid cohesion and segregation. Nat Genet. 2013; 45:1459–63.
- The Cancer Genome Atlas Research Network: Comprehensive molecular characterization of urothelial bladder carcinoma. Nature. 2014; 507: 315–22.
- Robertson A.G. et al. Comprehensive molecular characterization of muscle-invasive bladder cancer. Cell .2017: 1–43.
- Plimack E.R.et al. Defects in DNA repair genes predict response to neoadjuvant cisplatin-based chemotherapy in muscle-invasive bladder cancer. Eur Urol. 2015; 68:959–67.
- Van Allen E.M.et al. Somatic ERCC2 mutations correlate with cisplatin sensitivity in muscle-invasive urothelial carcinoma. Cancer Discov. 2014; 4:1140–53.
- Li H.T., Duymich C.E., Weisenberger D.J., Liang G. Genetic and Epigenetic Alterations in Bladder Cancer. Int Neurourol J. 2016; 20 (Suppl 2): S84–S94.
- Audenet F., Attalla K., Sfakianos J.P. The evolution of bladder cancer genomics: What have we learned and how can we use it? Urol Oncol. 2018 Jul; 36(7): 313-320.
- Tan T.Z et al. Molecular Subtypes of Urothelial Bladder Cancer: Results from a Meta-cohort Analysis of 2411 Tumors.Eur Urol. 2019; 75(3): 423-432.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
