Радиология лечение мочевого пузыря
Рак мочевого пузыря входит в число наиболее распространенных онкологических заболеваний. В России он составляет 4,5% от всех злокачественных опухолей, ежегодно диагностируются более 10 тысяч новых случаев. Наиболее распространено заболевание среди людей старше 67 лет, мужчины болеют примерно в 4,5 раза чаще по сравнению с женщинами.
В Европейской клинике можно получить лечение при раке мочевого пузыря по современным международным стандартам. Наши врачи выполняют хирургические вмешательства любой сложности, применяют противоопухолевые препараты последнего поколения с доказанной эффективностью.
Классификация и стадии рака мочевого пузыря
Подавляющее большинство злокачественных опухолей мочевого пузыря представлено уротелиальным раком (другое название – переходно-клеточный рак). Он развивается из клеток, которые образуют слизистую оболочку органа – уротелий (переходно-клеточный эпителий). Также уротелием выстлан мочеиспускательный канал, мочеточники, почечные лоханки, поэтому здесь могут встречаться такие же опухоли.
В 1-2% случаев (по данным Американского онкологического сообщества – American Cancer Society) в мочевом пузыре встречается плоскоклеточный рак (состоит из плоских клеток, напоминающих те, что входят в состав эпидермиса кожи), в 1% случаев – аденокарциномы (злокачественные опухоли из железистых клеток), менее чем в 1% случаев – мелкоклеточный рак (из нейроэндокринных клеток). Крайне редко в мочевом пузыре обнаруживают саркомы – злокачественные опухоли из соединительной ткани.
Классификация рака мочевого пузыря по стадиям осуществляется в соответствии с общепринятой системой TNM. Буквой T обозначают характеристики первичной опухоли, N – наличие очагов поражения в регионарных лимфоузлах, M – наличие отдаленных метастазов в других органах.

В упрощенном варианте, в зависимости от характеристик T, N и M, выделяют пять основных стадий рака мочевого пузыря:
- Стадия 0 – неинвазивная карцинома, она находится только в пределах слизистой оболочки и не прорастает глубже в стенку органа. Это так называемый рак на месте. Все остальные стадии – это инвазивный рак.
- Стадия I – опухоль углубилась в стенку мочевого пузыря, но не достигла мышечного слоя (T1). Нет очагов поражения в регионарных узлах (N0) и отдаленных метастазов (M0).
- Стадия II – опухоль проросла в мышечный слой органа (T2), но не проросла сквозь него. N0, M0.
- Стадия III – злокачественная опухоль проросла сквозь стенку мочевого пузыря и распространилась на окружающую его жировую клетчатку (T3) или в соседние органы (T4a). Опухолевые клетки на этой стадии могут распространяться в регионарные лимфоузлы (N1-3), отдаленных метастазов нет (M0).
- Стадия IV – злокачественная опухоль проросла в стенку таза или живота (IVA), либо имеются метастазы в отдаленных лимфоузлах, других органах (IVB). При этом первичная опухоль может иметь любые размеры, распространяться или не распространяться в регионарные лимфатические узлы.
Методы диагностики
К сожалению, не существует эффективных методов скрининга, которые можно было бы регулярно проводить у всех людей с целью ранней диагностики рака мочевого пузыря. Симптомы заболевания неспецифичны и могут напоминать проявления других патологий, например, цистита, аденомы простаты. Из-за этого злокачественные опухоли нередко диагностируют на поздних стадиях, когда лечить их уже намного сложнее.
Важно внимательно относиться к своему здоровью, обращать внимание на любые симптомы, которые сохраняются в течение длительного времени, и при их возникновении сразу обращаться к врачу.
При подозрении на рак мочевого пузыря применяют следующие виды диагностики:
- Цитологическое исследование мочи – её изучение под микроскопом на предмет наличия опухолевых клеток. Этот анализ иногда помогает диагностировать рак на ранних стадиях, но он не идеален.
- Исследование мочи на онкомаркеры – вещества, повышение уровней которых может свидетельствовать о злокачественной опухоли. Это также не совсем надежный тест.
- Цистоскопия – эндоскопическое исследование мочевого пузыря, когда в орган вводят специальный инструмент – цистоскоп – с видеокамерой. Наиболее информативна так называемая цистоскопия с синим светом. В мочевой пузырь вводят специальный препарат, который накапливается в опухолевых клетках и заставляет их флуоресцировать («светиться») в лучах синего света.
- Биопсия – исследование, во время которого получают фрагмент патологически измененной ткани и изучают в лаборатории под микроскопом. Это самый надежный способ разобраться, присутствуют ли в патологическом образовании раковые клетки, и является ли оно злокачественным. Материал для биопсии можно получить во время цистоскопии.
- Внутривенная пиелография. Пациенту внутривенно вводят раствор рентгеноконтрастного препарата, который затем начинает выводиться почками и «прокрашивает» мочевыводящие пути на рентгеновских снимках. Это помогает обнаружить опухоли.
- Ретроградная пиелография – исследование, во время которого рентгеноконтрастный раствор вводят через катетер, установленный в мочевом пузыре или мочеточнике.
- Ультразвуковое исследование помогает оценить размеры опухоли, выяснить, не распространилась ли она за пределы мочевого пузыря, проверить состояние почек. Под контролем УЗИ в обнаруженную опухоль можно ввести иглу и провести биопсию.
- Компьютерная томография и МРТ помогают оценить размеры, расположение, количество опухолевых очагов, обнаружить распространение рака на соседние органы, в лимфатические узлы, выявить метастазы. Под контролем КТ также можно провести биопсию с помощью иглы.
- Рентгенографию применяют для поиска метастазов в легких, костях.
Лечение рака мочевого пузыря
Тактику лечения при раке мочевого пузыря составляет команда врачей, в которую входят клинические онкологи, хирурги, урологи, химиотерапевты, радиотерапевты и другие специалисты.
Как выбирают лечение при раке мочевого пузыря?
Тактика лечения рака мочевого пузыря зависит от многих факторов: стадии опухоли, ее типа и молекулярно-генетических характеристик, общего состояния здоровья пациента, его возраста, наличия у него сопутствующих заболеваний. Прибегают к различным видам хирургических вмешательств, пациенту может быть назначена лучевая терапия, химиотерапия, иммунотерапия (в том числе введение препаратов внутрь мочевого пузыря).
Хирургическое лечение
В большинстве случаев злокачественную опухоль мочевого пузыря удается удалить хирургически. Есть разные виды операций, врач выбирает подходящую, в зависимости от стадии рака.
Иногда можно прибегнуть к трансуретральной резекции опухоли. Во время этого вмешательства не нужно делать разрез. Через мочеиспускательный канал (чаще всего пациент находится под общим наркозом) вводят специальный инструмент – резектоскоп. Он представляет собой петлю, которую накидывают на опухоль и отсекают ее. Для того чтобы уничтожить оставшиеся раковые клетки, прибегают к фульгурации (прижиганию током высокой частоты) или используют лазер.
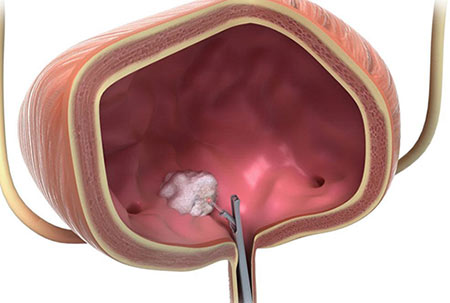
Трансуретральная резекция для лечения рака мочевого пузыря показана в двух случаях:
- Для того чтобы удалить поверхностно расположенные опухоли на ранних стадиях.
- Для того чтобы диагностировать рак, разобраться, насколько глубоко он прорастает в стенку мочевого пузыря.
Если опухоль проросла в мышечный слой стенки органа, но имеет небольшие размеры, можно выполнить резекцию – удалить только часть мочевого пузыря. На оставшуюся часть накладывают швы, и она продолжает выполнять свои функции, но в ней не может поместиться прежний объем мочи, и человеку приходится чаще посещать туалет. У резекции есть один большой недостаток: высок риск рецидива.
Большинству больных приходится выполнять цистэктомию – полностью удалять мочевой пузырь. Вместе с ним удаляют близлежащие лимфоузлы, у мужчин – семенные пузырьки и простату, у женщин – матку с шейкой и придатками, верхнюю часть влагалища. Операцию выполняют разными способами: через разрез, лапароскопически, в некоторых клиниках прибегают к роботизированной хирургии. После цистэктомии пациент остается без мочевого пузыря. Для того чтобы восстановить отток мочи, прибегают к разным вариантам реконструктивных операций:
- Врач может удалить часть сигмовидной кишки, сформировать из нее новый мочевой пузырь и соединить его с мочеточниками. Из участка кишки на поверхность кожи выводят отверстие: через него оттекает моча. При этом на коже постоянно придется носить мешочек для сбора мочи и периодически опорожнять его.
- Более совершенный вариант оперативного лечения – когда хирург формирует в кишке специальный клапан. Этот клапан перекрывает отверстие и не дает моче вытекать. Когда пациент хочет помочиться, он вставляет в отверстие катетер, клапан открывается, и моча вытекает по катетеру.
- Наиболее современная операция – когда хирург подсоединяет к одному концу кишки мочеточники, а к другому – мочеиспускательный канал. У большинства пациентов в течение нескольких месяцев восстанавливается способность к самостоятельным мочеиспусканиям, но зачастую остается недержание мочи по ночам.
Иногда запущенный рак, который не может быть удален хирургически, приводит к недержанию мочи или, напротив, создает препятствие для ее оттока. В таких случаях прибегают к паллиативным хирургическим вмешательствам.
Химиотерапия
Химиопрепараты при злокачественных опухолях мочевого пузыря могут решать разные задачи:
- Неоадъювантную химиотерапию проводят до хирургического вмешательства. Благодаря препаратам опухоль уменьшается, и ее становится проще удалить.
- Адъювантная химиотерапия применяется после операции. Если в организме пациента остались раковые клетки, химиопрепараты их уничтожают, за счет этого снижается риск рецидива.
- Химиолучевая терапия – когда химиопрепараты назначают «в помощь» лучевой терапии. За счет этого повышается эффективность лечения рака.
- Паллиативная химиотерапия – один из основных методов лечения на поздних стадиях, когда опухоль неоперабельна, имеются отдаленные метастазы. Химиопрепараты помогают продлить жизнь пациента и избавить от некоторых симптомов.
Злокачественные новообразования мочевого пузыря лечат цисплатином, гемцитабином, винбластином, метотрексатом, доксорубицином, карбоплатином, доцетакселом, паклитакселом. Эти препараты назначают в различных сочетаниях. Если пациент не может переносить два и более препарата из-за побочных эффектов, назначают один препарат, чаще всего цисплатин или гемцитабин.
На ранних стадиях проводят внутрипузырную химиотерапию: химиопрепарат вводят внутрь мочевого пузыря через мочеиспускательный канал.

Лучевая терапия
Показания к лечению лучевой терапией при злокачественных опухолях мочевого пузыря:
- Лечение опухоли на ранних стадиях, если пациенту противопоказана операция, либо если во время хирургического вмешательства удален не весь мочевой пузырь.
- Для борьбы с симптомами, вызванными злокачественной опухолью.
Иммунотерапия рака мочевого пузыря
Иммунитет человека умеет уничтожать не только болезнетворные микроорганизмы, проникшие извне, но и собственные клетки, в генах которых возникли «ошибки». Именно из-за таких «ошибок» нормальная клетка превращается в раковую. Однако, опухолевые клетки умеют «обманывать» иммунитет, и используют для этого сложные молекулярные механизмы.
Так, иммунная система использует некоторые молекулы (они называются контрольными точками), чтобы подавлять собственную активность и не атаковать нормальные ткани организма. На поверхности иммунных клеток находится белок PD-1, который, взаимодействуя с белком PD-L1 на поверхности других клеток, подавляет иммунную реакцию. Для того чтобы снять блок с иммунной системы, для лечения применяют две группы иммунопрепаратов:
- Блокаторы PD-1: пембролизумаб (Кейтруда), ниволумаб (Опдиво).
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенцио), дурвалумаб (Имфинци).
Все эти препараты вводят внутривенно через каждые 2-3 недели. Обычно их назначают пациентам, у которых опухоль не реагирует на химиотерапию и продолжает прогрессировать.
Спустя несколько недель после трансуретральной резекции могут быть назначены внутрипузырные введения вакцины БЦЖ. Она стимулирует местные иммунные механизмы, которые уничтожают оставшиеся опухолевые клетки. БЦЖ вводят в мочевой пузырь через мочеиспускательный канал, обычно раз в неделю в течение шести недель.
Каким будет план лечения на разных стадиях рака мочевого пузыря?
Лечебная тактика на разных стадиях выглядит примерно следующим образом:
- На стадии 0 (когда опухоль находится в верхнем слое слизистой оболочки): трансуретральная резекция с последующим введением в мочевой пузырь вакцины БЦЖ или химиопрепаратов.
- На стадии I (опухоль в слизистой оболочке, которая не вросла в мышечный слой стенки) лечение начинают с трансуретральной резекции, но ее проводят не для того, чтобы вылечить пациента, а чтобы определить стадию рака. Далее может быть проведена повторная трансуретральная резекция с последующим введением в мочевой пузырь БЦЖ или химиопрепаратов. При больших, множественных и агрессивных опухолях рекомендуется удалить мочевой пузырь. Если операция противопоказана из-за слабого здоровья пациента, назначают лучевую или химиолучевую терапию, но шансы на успешное лечение в таком случае ниже.
- На стадии II (опухоль проросла в мышечный слой) удаляют мочевой пузырь, до или после операции проводят курс лечения химиотерапией. У немногих пациентов удается удалить только часть мочевого пузыря. Иногда при небольших опухолях проводят трансуретральную резекцию с последующей химиотерапией и лучевой терапией, но это сомнительный подход, не все врачи с ним согласны.
- На стадии III (опухоль распространяется за пределы мочевого пузыря) выполняют цистэктомию, проводят курс адъювантной или неоадъювантной химиотерапии. Если пациент не может перенести операцию, врач может назначить трансуретральную резекцию, химиотерапию, лучевую терапию, иммунотерапию.
- На стадии IVA (опухоль прорастает в стенку брюшной полости, таза) лечение начинают с курса химиотерапии или химиолучевой терапии. Когда опухоль уменьшается в размерах, может быть проведено хирургическое вмешательство. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты.
- На стадии IVB (имеются отдаленные метастазы) лечение начинается с химиотерапии или химиолучевой терапии. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты. Проводят паллиативные хирургические вмешательства, направленные на восстановление оттока мочи или борьбу с недержанием.
Как лечить опухоли мочевого пузыря с метастазами?
На момент постановки диагноза у 10-15% больных со злокачественными новообразованиями мочевого пузыря уже имеются отдаленные метастазы. У 30% пациентов после радикального лечения (полного удаления опухоли) происходит рецидив в мочевом пузыре или в виде метастазов.
Бороться с метастазировавшим раком сложно. Обычно радикальное хирургическое лечение и наступление ремиссии невозможно. Лечение начинают с химиотерапии. Учитывают состояние здоровья пациента и молекулярно-генетические характеристики опухолевых клеток:
- Если больному не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин или DDMVAC (уплотненная доза MVAC): метотрексат + винбластин + доксорубицин (адриамицин) + цисплатин.
- Больному противопоказан цисплатин, но не противопоказан карбоплатин: гемцитабин (Гемзар) + карбоплатин.
- Больному противопоказан цисплатин, и в опухолевых клетках обнаружен маркер PD-L1: гемцитабин (Гемзар) + карбоплатин, атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
- Больному противопоказаны все препараты платины: атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
Если на фоне применения препаратов первой линии заболевание продолжает прогрессировать, назначают препараты второй линии:
- После лечения препаратами платины: пембролизумаб (Кейтруда), атезолизумаб (Тецентрик), ниволумаб (Опдиво), дурвалумаб (Имфинзи), авелумаб (Бавенцио), эрдафитиниб (Балверса – для пациентов, у которых обнаружены мутации FGFR2 и FGFR3).
- После лечения ингибиторами контрольных точек, если пациенту противопоказан цисплатин: гемцитабин (Гемзар) + карбоплатин.
- После лечения ингибиторами контрольных точек, если пациенту не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин, DDMVAC.
Параллельно с противоопухолевыми препаратами может применяться лучевая терапия.
Какие методы лечения рака мочевого пузыря наиболее эффективны?
На этот вопрос нет однозначного ответа. Всё зависит от стадии, типа, молекулярно-генетических характеристик опухоли, состояния здоровья пациента, наличия и отсутствия у него противопоказаний.
Оптимальные методы лечения злокачественных опухолей мочевого пузыря прописаны в специальных документах – протоколах. Они составлены на основе результатов многочисленных клинических исследований с участием тысяч пациентов по всему миру и регулярно пересматриваются, обновляются.
Врачи в Европейской клинике руководствуются последними версиями американских, европейских, израильских протоколов лечения.
Насколько эффективны современные методы лечения, каков прогноз?
В среднем в течение 5 лет остаются в живых 77% пациентов, в течение 10 лет – 70%, в течение 15 лет – 65%. Пятилетняя выживаемость при злокачественных опухолях мочевого пузыря зависит от стадии:
- Стадия 0-98%.
- Стадия I-88%.
- Стадия II-63%.
- Стадия III-46%.
- Стадия IV-15%.
В настоящее время проводятся клинические исследования, врачи ищут более эффективные способы борьбы с заболеванием, а значит, есть надежда, что в ближайшем будущем эти показатели улучшатся.
Источник
В статье проанализированы результаты лечения больных с поздними лучевыми повреждениями мочевого пузыря (осложненными и неосложненными циститами). Отмечается, что выбор метода лечения должен основываться на данных субъективных жалоб и объективных методов исследования. Так, при выраженном болевом синдроме и инкрустированной форме лучевого цистита наилучшие результаты отмечались на фоне внутрипузырного применения Димексида. При выраженном воспалительном процессе, сопровождающемся поверхностным нарушением слизистой мочевого пузыря, а также атрофии слизистой предпочтение следует отдать инстилляциям УРО-ГИАЛА. Рексод продемонстрировал эффективность у больных с геморрагическим синдромом, при язвенном лучевом цистите и сниженном объеме мочевого пузыря.
Таблица 1. Сравнительная характеристика результатов лечения больных первой группы до и после внутрипузырного применения Димексида
Таблица 2. Сравнительная характеристика цистоскопических признаков лучевых циститов у больных первой группы до и после внутрипузырного применения Димексида
Таблица 3. Сравнительная характеристика больных второй группы до и после внутрипузырного применения УРО-ГИАЛА
Таблица 4. Сравнительная характеристика цистоскопических признаков лучевых циститов у больных второй группы до и после внутрипузырного применения УРО-ГИАЛА
Таблица 5. Сравнительная характеристика больных третьей группы до и после внутрипузырного применения Рексода
Таблица 6. Сравнительная характеристика цистоскопических признаков лучевых циститов у больных третьей группы до и после внутрипузырного применения Рексода
Введение
В настоящее время лучевая терапия является одним из основных методов лечения злокачественных новообразований органов малого таза. При отсутствии метастазов в регионарные лимфоузлы применение лучевой терапии позволяет добиться полной или частичной регрессии опухоли (рак тела и шейки матки, рак предстательной железы, в меньшей степени рак мочевого пузыря и прямой кишки) в среднем в 70-75% случаев. При этом продолжительность жизни после окончания курса лечебных мероприятий остается относительно высокой и составляет около четырех-пяти лет [1-3].
К сожалению, у части таких больных (10-15%) формируются лучевые повреждения органов малого таза: мочевого пузыря, прямой кишки и внутритазовой клетчатки [4, 5]. Оценивая данные литературы, можно констатировать неудовлетворительные результаты диагностики и лечения лучевых повреждений органов малого таза. Это выражается в частых рецидивах цистита с исходом в сморщивание мочевого пузыря, внутритазовом лучевом фиброзе со сдавлением интрамурального и юкставезикального отделов мочеточников и развитии хронической почечной недостаточности [7-8].
Проведение лучевой терапии может осложниться развитием радиационно-индуцированного фиброза, выраженность которого прямо пропорциональна величине суммарной поглощенной дозы, режиму фракционирования и времени после проведения лучевой терапии. Микроскопическое исследование тканей с радиационно-индуцированным фиброзом показало, что его формирование сопровождается развитием каркаса в подслизистом слое стенки мочевого пузыря, в сетях которого фиксируются стенки мелких артерий и вен. Происходит лучевое повреждение и самой сосудистой стенки, особенно ее адвентиции, что приводит к потере сосудами эластичности и появлению ломкости. Клинически это обнаруживается различной степенью гематурии, вплоть до профузного кровотечения. Развитие в последующем лучевого фиброза всей стенки мочевого пузыря значительно отягощает клинические симптомы и выраженность лучевого цистита [9-11].
В диагностике лучевых циститов важное значение имеют общеклинические, рентгенологические и инструментальные методы исследования. Ведущим методом исследования мочевого пузыря остается цистоскопия, позволяющая достоверно установить локализацию и степень выраженности лучевого повреждения, то есть выявить органические изменения слизистой оболочки, наличие камней и видимых опухолевых элементов, оценить состояние устьев мочеточников.
Материал и методы
В настоящей работе проведено исследование эффективности новых методов местного лечения осложненных и неосложненных лучевых циститов. 139 больных были разделены на три группы. Первую группу составили 49 пациентов (17 с неосложненными циститами и 32 – с осложненными). Они получали традиционное местное лечение: Димексид, Колларгол, синтезоновая эмульсия и облепиховое масло. Во вторую группу вошли 52 больных (26 с неосложненными циститами и 26 – с осложненными), у которых для местного лечения использовался препарат УРО-ГИАЛ. В местной терапии третьей группы – 38 пациентов (13 с неосложненными циститами и 25 – с осложненными) – применялась супероксиддисмутаза (препарат Рексод). Кроме того, всем пациентам была назначена антибактериальная, антикоагулянтная, вазоактивная, симптоматическая и иммунная терапия.
Местное лечение больных первой группы начиналось с инстилляций 10%-ного Димексида в объеме 20 мл. Применение этого препарата патогенетически обосновано, поскольку он обладает выраженным противовоспалительным, противоотечным и обезболивающим эффектом. В связи с тем что Димексид является органическим растворителем и легко проникает в ткани, в раствор добавлялись антибиотики (гентамицин, амикацин), фибролизирующие (Лидаза) и противовоспалительные препараты (преднизолон). Инстилляции проводились ежедневно по 20 мл (от 10 до 15 процедур). У больных с микрогематурией или неинтенсивной примесью крови в моче для инстилляций мочевого пузыря дополнительно применялся 3%-ный Колларгол 20 мл на одно введение. При неэффективности монотерапии Колларголом для усиления гемостатического эффекта его чередовали с охлажденной аминокапроновой кислотой. После стихания воспалительных процессов внутрипузырно в подогретом виде один раз в сутки в течение 10-15 дней вводились синтезоновая эмульсия и облепиховое масло. Действие этих препаратов направлено на усиление репараторных процессов в стенке мочевого пузыря. Благодаря жировой основе они оказывают выраженное обволакивающее и обезболивающее действие.
Местное лечение больных второй группы подразумевало применение препарата на основе гиалуроновой кислоты УРО-ГИАЛ. УРО-ГИАЛ – вязкоэластичный протектор межклеточного вещества уротелия мочевого пузыря и уретры. УРО-ГИАЛ позволяет создать вязкоэластичную пленку на слизистой, тем самым защищая ее от агрессивного воздействия мочи и препятствуя адгезии микробов к поврежденной поверхности. Инстилляции УРО-ГИАЛА проводились через день в течение 12-15 дней, затем в режиме одно введение в неделю.
В третьей группе пациентам назначался препарат супероксиддисмутазы Рексод. Рексод прямо инактивирует свободные радикалы, блокирует реакцию перекисных радикалов с арахидоновой кислотой, ослабляет активное действие лейкотриена В4, ингибирует хемотаксис лейкоцитов, значительно уменьшает синтез коллагена фибробластами (способствует регрессии радиационно-индуцированного фиброза). Рексод вводился внутрь мочевого пузыря, при этом содержимое флакона растворяли непосредственно перед введением в 10 мл стерильного физиологического раствора. Инстилляции проводились один раз в сутки на протяжении 15-20 дней.
Результаты и обсуждение
Результаты лечения больных первой группы представлены в таблице 1. Приведенные данные свидетельствуют о значительном уменьшении частоты ночного мочеиспускания и снижении бактериурии у большинства больных как с осложненными, так и с неосложненными циститами. Несмотря на по-прежнему высокий уровень лейкоцитурии, она носила менее выраженный характер. Макрогематурия после лечения не выявлялась у пациентов с неосложненными циститами, но сохранялась у 18% пациентов с осложненными циститами.
Сравнительный анализ УЗИ-признаков лучевых циститов у больных первой группы продемонстрировал, что внутрипузырное применение Димексида позволило очистить мочевой пузырь от солевой инкрустации более чем в 50% случаев. К сожалению, основные УЗИ-признаки воспаления (взвесь в просвете мочевого пузыря и утолщение его стенок) были купированы у незначительного числа пациентов.
Динамика выраженности цистоскопических признаков лучевых циститов у больных первой группы до и после лечения продемонстрирована в таблице 2. У пациентов как с неосложненными, так и осложненными циститами сохранялись воспаление (гиперемия и отек) и телеангиоэктазии. Таким образом, внутрипузырное применение Димексида было наиболее эффективным у пациентов с выраженным болевым синдромом и инкрустированной формой лучевого цистита.
Результаты лечения больных второй группы представлены в таблице 3. Следует отметить выраженное противовоспалительное действие УРО-ГИАЛА. Так, частота ночного мочеиспускания сократилась в два раза более чем у 56% пациентов с неосложненными циститами и у 59% с осложненными циститами. Лейкоцитурия уменьшилась в два раза у больных с осложненными циститами и практически не выявлялась у пациентов с неосложненными циститами (12%), а бактериурия сохранилась только у 27 и 25% больных в обеих подгруппах соответственно.
Основные УЗИ-признаки воспаления (взвесь в просвете мочевого пузыря и утолщение его стенок) исчезли у подавляющего числа больных. Однако УРО-ГИАЛ практически не оказал действия на инкрустированные циститы, особенно у больных со сниженным объемом мочевого пузыря.
Характеристика цистоскопических признаков лучевых циститов у больных второй группы до и после лечения продемонстрирована в таблице 4. Гиперемия и отек беспокоили менее чем 25% больных как с неосложненной, так и осложненной формой цистита. Частота эрозии у пациентов с неосложненными циститами уменьшилась в четыре раза. Однако более чем у 70% пациентов сохранились телеангиоэктазии. Язва мочевого пузыря у больных с осложненными циститами уменьшилась в размерах и очистилась от фибрина.
Можно сделать вывод, что применяемая схема лечения – инстилляции УРО-ГИАЛА – наиболее эффективна у пациентов с выраженным воспалительным процессом и болевым синдромом, связанным с воспалением стенок мочевого пузыря, и может применяться у больных с любой формой лучевого цистита, осложненного бактериальной инфекцией.
Результаты лечения больных третьей группы представлены в таблице 5. Почти у половины больных с неосложненными и осложненными циститами в два раза уменьшилась частота ночного мочеиспускания. У 75 и 90% пациентов соответственно сохранилась лейкоцитурия. Однако бактериурия почти у половины больных в обеих подгруппах не определялась, а макрогематурия исчезла у всех пациентов.
Сравнительная характеристика УЗИ-признаков лучевых циститов у больных третьей группы продемонстрировала достоверное увеличение объема мочевого пузыря у пациентов с микроцистисом, однако в меньшей степени Рексод оказал положительное действие на инкрустацию стенок мочевого пузыря и наличие взвеси в его просвете.
Что касается выраженности цистоскопических признаков лучевых циститов у больных третьей группы (табл. 6), то в результате лечения язва мочевого пузыря исчезла у всех больных, однако более чем у 60% пациентов с осложненными циститами сохранялись признаки воспаления (гиперемия и отек). Таким образом, Рексод можно рекомендовать больным с геморрагическим синдромом, при язвенном лучевом цистите и сниженном объеме мочевого пузыря.
Заключение
Следует отметить, что используемые препараты (Димексид, УРО-ГИАЛ и Рексод) имеют разную направленность действия. В частности, при выраженном фиброзе стенки мочевого пузыря предпочтение следует отдавать применению инстилляций раствора Димексида. При выраженном воспалительном процессе, сопровождающемся поверхностным нарушением слизистой мочевого пузыря, а также атрофии слизистой наиболее эффективным оказалось применение УРО-ГИАЛА. У больных с гематурией и глубокими нарушениями целостности слизистой мочевого пузыря (язвенно-некротический цистит) наиболее высокие результаты продемонстрировало применение супероксиддисмутазы. Выбор метода лечения должен основываться на данных субъективных жалоб и объективных методов исследования.
Источник
