Постлучевой фиброз мочевого пузыря
Лучевой цистит – это реакция тканей мочевого пузыря на ионизирующее облучение, проводимое в рамках лечения злокачественных опухолей малого таза. Симптомы зависят от полученной лучевой нагрузки, варьируются от незначительного дискомфорта при мочеиспускании, частых позывов и микрогематурии до выраженных болей, появления рецидивирующего кровотечения, угрожающего жизни. Диагноз подтверждают с помощью общего анализа мочи, цистоскопии. Лечение пострадиационного цистита определяется степенью выраженности поражения, может быть консервативным или оперативным с выполнением цистэктомии, решением вопроса с отведением мочи.
Общие сведения
Лучевой цистит регистрируют у 5-21% пациентов как осложнение лучевой терапии. Наиболее часто симптомы появляются после лечения рака мочевого пузыря (18%), простаты (14%), шейки матки (5%). Патология развивается в среднем через 32 недели после лечения, у мужчин чаще, чем у женщин (2,8:1). Конформная лучевая терапия, брахитерапия сопряжены с меньшей вероятностью возникновения пострадиационного цистита по сравнению с обычной. Но даже при таком лечении случайное облучение близлежащих тканей неизбежно из-за проникновения новообразования в окружающие органы или из-за близости рака к соседним структурам таза.

Лучевой цистит
Причины
Во время лучевой терапии происходит передача энергии ионизирующего излучения молекулам опухолевых клеток и тканям соседних органов, в частности – мочевому пузырю, прямой кишке. В результате альтерации нарушается трофика, кровоснабжение, позднее развиваются фиброзно-склерозирующие изменения. Пострадиационный цистит вызывает прохождение лучевой терапии по поводу опухолей:
- предстательной железы;
- влагалища, матки, ее шейки, яичников;
- мочевого пузыря;
- толстой, прямой кишки.
Определенное значение имеют локализация новообразования, стадия болезни, ежедневная и суммарная доза облучения (количество сеансов), тип лучевой терапии. К способствующим циститу факторам относятся:
- общее снижение иммунной реактивности организма на фоне злокачественного новообразования;
- выполненное оперативное вмешательство, например, трансуретральная резекция (ТУР) простаты или стенки пузыря с опухолью;
- одновременное прохождение химиотерапии;
- урологические заболевания: сопутствующий воспалительный процесс, цистолитиаз, дивертикулы;
- патологии, предрасполагающие к плохому заживлению, локальной ишемии: СПИД, сахарный диабет, болезни сосудов;
- ожирение (ИМТ >30 кг/м2);
- проведение гормонального лечения по поводу рака простаты;
- хроническая никотиновая интоксикация (≥1 пачки в день).
Патогенез
Радиация взаимодействует с внутриклеточной жидкостью, в результате высвобождаются свободные радикалы, нарушающие синтез ДНК, что приводит к гибели клеток. На фоне терапии повреждаются мембраны как раковых, так и здоровых клеток, изменения затрагивают сосуды. Субэндотелиальная пролиферация, отек постепенно истощают кровоснабжение облученной зоны. Неоваскуляризация, неадекватная регенерация провоцируют формирование хрупких поверхностных сосудов, ответственных за макрогематурию при геморрагическом цистите.
Отложение коллагена запускает процессы рубцевания, способствует дальнейшей облитерации кровеносных сосудов, вследствие чего развивается гипоксия, некроз. В мочевом пузыре на фоне ишемии слизистой оболочки повреждается уротелий, что вызывает подслизистый фиброз, поскольку субэпителиальные ткани подвергаются едкому воздействию мочи. Образование язв, поражение нервов, пострадиационный фиброз обеспечивают появление развернутой клинической симптоматики.
Классификация
Лучевой цистит может быть ранним, возникающим в течение 4 недель или 6-12 месяцев после терапии, и поздним, с появлением симптомов спустя год или позже. Выделяют острое и хроническое течение пострадиационного воспаления. Специалисты в сфере онкоурологии используют в работе специальную шкалу для оценки степени выраженности изменений мочевого пузыря, подвергшегося лучевому воздействию:
- 1 степень подразумевает незначительную эпителиальную атрофию и расширение сосудов, обнаружение единичных эритроцитов в моче. Клинические проявления чаще отсутствуют.
- 2 степень характеризуется обнаружением множественных телеангиэктазий, эпизодами макрогематурии. Мочеиспускание учащено, появляются жалобы на недержание урины.
- 3 степень представлена видоизменением сосудов по всей поверхности, формированием микроциста (уменьшением емкости органа), стойким недержанием мочи, изнурительными позывами на мочевыделение до 40 эпизодов в сутки, включая ноктурию, рецидивирующей макрогематурией.
- 4 степень при цистоскопии обнаруживаются участки некротизации, признаки тотального геморрагического цистита с участками петехий, емкость пузыря при тугом наполнении менее 100 мл, отмечается полная утрата контроля над мочевыделением, требующая вспомогательных мер (катетеризации или цистэктомии). В моче постоянно присутствует кровь, белок, слущенный эпителий.
- 5 степень наиболее неблагоприятна в прогностическом плане, гематурия приводит к развитию угрожающей жизни анемии, формированию свищей. Определяется максимально выраженный болевой синдром, высокий риск летального исхода.
Симптомы лучевого цистита
Сразу или через несколько недель после одномоментного получения значительной дозы радиации развивается острый воспалительный процесс. Как правило, ранний цистит является самоограниченным, симптомы аналогичны острому инфекционному воспалению, включают рези при учащенном мочеиспускании и после, боли внизу живота, ургентные позывы на мочевыделение. Может присутствовать кровь в моче, но более типична микрогематурия. Отмечается хороший ответ на терапию.
Лучевой цистит, возникший спустя несколько месяцев либо лет после лечения, может проявляться постоянной дизурией, сильной болью, позывами к мочеиспусканию через каждые 10-15 минут из-за формирования микроциста, выделением урины с кровью, стойкой инконтиненцией. Макрогематурия приобретает рецидивирующий характер, обнаруживается значительная кровопотеря. Повышение температуры свидетельствует о вторичном бактериальном инфицировании.
Осложнения
Лучевой цистит осложняется присоединением инфекции с развитием бактериального воспалительного процесса в почках (пиелонефрит в 20%), прогрессирующим уменьшением емкости или рубцовым сморщиванием органа и неоплазией (менее 2%), образованием свища (2%), контрактуры шейки (3-5%). При выраженном пострадиационном воспалении возникает некупируемый хронический болевой синдром, значительно ухудшающий качество жизни.
Кровотечению из видоизмененных сосудов (геморрагический цистит в 3-5%) нередко сопутствует анемия, иногда частота и выраженность кровотечения настолько значительна, что требуется проведение цистэктомии, поскольку неоднократные коагуляции лишь усугубляют фиброзно-склеротический процесс. Гематурия может сопровождаться образованием сгустков, которые приводят к острой задержке мочеиспускания за счет гемотампонады уретры.
Диагностика
Прохождение лечения с использованием ионизирующего облучения с отсроченным появлением типичных жалоб – основной критерий, на основании которого врач-уролог выставляет предварительный диагноз лучевого цистита. Учитывая то, что данные симптомы могут свидетельствовать о ряде других патологических процессов, показано прохождение углубленного клинико-урологического обследования, которое включает:
- Лабораторные анализы. В ОАМ обнаруживают микро- или макрогематурию, белок, эпителий, иногда бактерии, лейкоциты. Бакпосев производят для исключения инфекции мочевыводящих путей. Цитология мочи обоснована при подозрении на рак мочевого пузыря. В результатах анализа крови обращают внимание на гемоглобин, гематокрит, уровень тромбоцитов. Коагулограмма позволяет исключить нарушения в работе свертывающей системы.
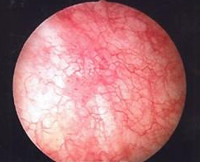
- Инструментальную диагностику. Основным исследованием является цистоскопия, которая позволяет исключить другие причины жалоб, например, камень или мочепузырную опухоль. Типичная картина – множественные телеангиэктазии на фоне отечной слизистой, на продвинутой стадии – множественные эрозии. Прочие методы визуализации (МРТ, КТ, экскреторную урографию) назначают для исключения свищей, других причин гематурии.
- Биопсию стенки пузыря. Морфологическое исследование проводят после получения неоднозначных результатов УЗИ, цистоскопии и КТ или МРТ при высокой вероятности опухолевого процесса. Перед выполнением биопсии учитывают потенциальный риск кровотечения из поверхностных сосудов в результате травматизации.
Дифференциацию осуществляют между уроцистолитиазом, распространением опухоли из малого таза в пузырь, прогрессированием рака, сопровождающегося кровотечением, болевым синдромом. КТ и МРТ становятся основными диагностическими процедурами в данной клинической ситуации.
Лечение лучевого цистита
Терапевтические мероприятия зависят от выраженности процесса, в каждом случае определяются индивидуально. Первая и вторая степени цистита после облучения требуют активной тактики только при наличии жалоб. Цистэктомия рассматривается как крайний вариант для лечения постлучевого цистита, выполняется при безуспешности консервативной терапии.
Медикаментозное лечение
Радиационно-индуцированная гематурия может быть легкой или опасной для жизни, во втором случае прибегают к реанимационным мероприятиям, переливанию компонентов крови. Перечень препаратов для лечения включает:
- антихолинергические средства;
- обезболивающие агенты;
- фибринолитики;
- лекарства, улучшающие кровообращение;
- альфа-1-адреноблокаторы.
Инстилляции в мочевой пузырь
Вливание растворов – следующий этап лечения при неэффективности пероральной терапии лучевого цистита и налаженной системы орошения. Используют следующие препараты:
- Гиалуроновая кислота. Мукополисахарид, присутствующий в соединительной и эпителиальной тканях, ингибирует образование иммунных комплексов, нейтрализует функции нейтрофилов при регуляции пролиферации фибробластов, эндотелиальных клеток. Аналогичным действием обладает хондроитин-сульфат.
- Аминокапроновая кислота. Стабилизирует процесс свертывания крови путем фибринолиза.
- Формалин. 1% раствор является тканевым фиксатором, который денатурирует поверхностный слой уротелия, обеспечивая гемостаз. Лечение сопровождается сильной болью, что требует назначения анальгетиков. Высок риск побочных эффектов.
- Соли алюминия. 1% сульфат алюминия-аммония или сульфат алюминия-калия вызывают осаждение белка на поверхности клеток и в интерстициальных пространствах, что позволяет прекратить кровоточивость.
- Плацентарный экстракт. Эффективен в эпителизации эрозий, язв.
Хирургическое лечение
Если консервативная терапия и внутрипузырные инстилляции не могут остановить кровотечение, прибегают к различным эндоскопическим или чрескожным вмешательствам. Цистоскопия с фульгурацией проблемных участков, эвакуация кровяного сгустка, выполнение электрокоагуляции являются разумными шагами в дальнейшей тактике. Виды вмешательств при лучевом цистите:
- Введение ботулинического токсина А. Препарат вводится в стенку мочевого пузыря при отсутствии эффекта от антихолинергических средств. Лечение направлено на увеличение емкости пузыря, снижение частоты мочеиспускания, купирование ургентных позывов.
- Наложение чрескожного нефростомического дренажа. Отведение мочи из ЧЛС почек способствует регенерации уротелия нижних отделов мочевого тракта. Через 3-6 месяцев восстанавливают анатомически правильный отток урины.
- Эндоскопическая склеротерапия. Введение склерозанта в кровоточащие области эффективно не в 100% случаев, но у большинства пациентов с трудноизлечимым геморрагическим циститом обеспечивает снижение выраженности симптоматики, гемостаз.
- Эмболизация сосудов. Помогает остановить кровотечение при рефрактерном пострадиационном геморрагическом цистите.
- Паллиативная цистэктомия. Органоуносящая операция показана при рецидивирующей гематурии при безуспешности всех видов лечения, формировании свища, микроцисте (объем менее 200 мл) с изнуряющими позывами на мочеиспускание, стойком болевом синдроме. Урину отводят путем создания кондуита толстой кишки или выполнения двусторонней транскутанеостомии.
Физиотерапия
Гипербарическая кислородная терапия (оксигенация) способствует нормализации ангиогенеза, мобилизации стволовых клеток, остановке кровотечения за счет активации процессов фибринолиза, разрешению ишемии. Используется как дополнительный способ лечения лучевого цистита. Проведение оксигенобаротерапии не имеет каких-либо неблагоприятных последствий.
Прогноз и профилактика
Лучевой цистит, развившийся через 4-6 недель от начала сеансов ЛТ, имеет более благоприятный прогноз. Улучшение наступает примерно через 1,5 месяца, но у 5-20% процесс переходит в стойкую форму с рецидивирующими клиническими проявлениями через несколько месяцев или даже 10-20 лет. Хронические формы менее благоприятны.
Профилактика подразумевает выбор типа лучевой терапии с максимальным воздействием на опухоль, но не на соседние ткани, выполнение инстилляций на основе гиалуроновой кислоты с превентивной целью, прием растительных диуретиков. Исследования показали уменьшение симптомов цистита при использовании добавок, содержащих клюквенный экстракт.
Источник
Урологические осложнения при облучении половых органов: лучевые стенозы мочеточников, лучевые мочеполовые свищи.
- Лучевые стенозы мочеточников.
- Лучевые мочеполовые свищи.
Лучевой терапии принадлежит ведущее место в лечении злокачественных
опухолей гениталий. Ее можно применять как самостоятельный метод или
как этап комбинированного или комплексного лечения. Рентгеновские и
Y-лучи не ограничиваются разрушением раковых клеток. Ионизирующая
радиация поглощается также мочевой системой, что обусловлено тесной
топографоанатомической связью и восприимчивостью к энергии высоких
облучений. Изменения в мочевой системе зависят от дозы и времени
облучения. Риск лучевых осложнений больше при внутриполостном
использовании радия. Он увеличивается, когда смещаются введенные во
влагалище радионуклидные препараты, во время повторных курсов
облучения, а также при хирургическом лечении после лучевой терапии. Не
случайно вопрос о влиянии лучевой терапии на органы мочевой системы был
программным на XII конгрессе международного общества урологов
(Рио-де-Жанейро, 1961).
Оптимальной курсовой дозой облучения при раке женских половых органов
считают 30—40 Гр (3000—4000 рад). В результате этой
дозы
раковые клетки теряют способность активно пролиферировать (Павлов А.
С., 1970; Переслегин И. А., 1970; Бырзу И., Григореску Шт., 1981, и
др.). При увеличении дозы до 60 Гр (6000 рад) и недоучете поперечных
размеров таза поглощаемость лучей мочевыми органами повышается на
4—10% и наступают изменения в мочевой системе. В отдельных
случаях мочевые органы страдают и после оптимальных доз, что связано с
повышенным фиброзом тканей.
Первые работы о лучевых поражениях мочевой системы были опубликованы
еще в 20-х годах нашего столетия (Бергман Г. Г., 1926; Heyneman, 1914;
Smidt W., 1926). В настоящее время накопилось значительное количество
работ, посвященных этому вопросу.
Пострадиационные повреждения мочевых органов развиваются в процессе
лечения или непосредственно после него. Однако чаще они наступают в
более поздний период—от полугода до нескольких лет.
Изменения в мочевой системе могут быть функциональными или
морфологическими. К последним относят пиелонефрит, фиброз мочеточников,
цистит, мочеточниковые фистулы и др. Диапазон частоты послелучевых
поражений мочевых органов очень широк: от 2,4 до 20% (Горожанкина Г.
С., 1971; ЗадеринВ.П., 1981; Lenz P. et al., 1974).
При этом характер их может быть различным: от частичной обструкции
мочеточников до полной непроходимости или от умеренно выраженного
цистита до глубоких, деструктивных изменений, сопровождающихся потерей
емкости мочевого пузыря и образования фистул.
A. Hittmar и J. Flick (1967) обследовали 262 больных раком шейки матки.
До лечения патологические изменения со стороны верхних мочевых путей
— пиелонефрит, гидроуретер, конкременты и др. —
были
выявлены у 28 (10,6%). После лучевого лечения обследована 141 больная,
у 26 (18,4%) из них обнаружены изменения в почках и верхних мочевых
путях.
Е. Schmiedt (1970) сообщил о 242 больных, которым по поводу
новообразований внутренних половых органов была проведена лучевая
терапия. Урологические осложнения отмечены у 167 (69%).
G. Bolland и J. J. Carol (1972) обследовали 100 больных через
1—5
лет после лучевой терапии рака матки и обнаружили у 29% больных
уретерогидронефроз, а у 50%—цистит L. Bergonzini и соавт.
(1972)
зарегистрировали пострадиационные осложнения (свищи, стенозы
мочеточников, циститы) у 118 (18,7%) из 599 больных раком шейки матки.
Почти у всех больных этой группы была III—IV стадия
заболевания и
они получали высокие дозы облучения. И. Ф. Алексеев и соавт. (1982)
наблюдали 273 больных. Из них у 112 больных был рак шейки матки, у 161
— рак тела матки. У 82,3% больных выявили урологические
осложнения в первые 2 года после лучевой терапии. Следовательно, под
влиянием лучевой терапии наступают серьезные нарушения в мочевых
органах. Невозможно соизмерить степень страдания этих больных.
Поражения почечной ткани встречаются крайне редко. Это бывает только
при очень больших дозах ионизирующего воздействия (Багдасаров М. Б.,
1968; Полубояринова 3. И., 1971, и др.).
Лучевые стенозы мочеточников.
Относительно резистентны к лучевой терапии и мочеточники. И все же
предшествующие операции и лучевая терапия в 0,5— 2,9% случаев
вызывает склероз клетчатки таза. Последняя перерождается в единый
конгломерат с окруженными ее органами, представляя состояние так
называемого замерзшего таза, что ведет к обструкции тазового отдела
мочеточника. По данным А. П. Городецкого (1976), И. М. Деревянко
(1979), Shingleton и соавт. (1969), Bolland и Carol (1972), A. Aldridge
и S. Masson (1972), С. Perri и соавт. (1975), P. Kaplan (1977) и др.,
рубцовые сужения мочеточников определяются у 23—29% женщин,
подвергшихся лучевой терапии.
R. Schoonees и соавт. (1969) на основании большого клинического опыта
пришли к выводу, что изменения в верхних мочевых путях развиваются у
больных раком шейки матки даже при I стадии болезни, но значительно
чаще при III—IV стадиях. Авторы представили следующие данные:
I
стадия—1,8%;
II стадия—10%;
III стадия —
38,1%;
IV
стадия —52,6%.
В начале лучевого лечения развивается отек
слизистой оболочки мочеточников, вызывающий боли в поясничной области.
Интенсивность болей различна: от тупых, ноющих до приступов почечной
колики. Наступает умеренное расширение чашечно-лоханочной системы, что
отчетливо видно на так называемых отсроченных снимках, которые
выполняют через 60 и 90 мин. Ретенция верхних мочевых путей проходит
спустя 3—4 мес. Уретерогидронефроз в результате
склеротических
изменений клетчатки малого таза появляется в среднем через
2—2/2
года. Стойкое затруднение оттока мочи может закончиться гибелью почки.
Если гидроуретеронефроз развивается в течение первого полугодия после
начала лечения, тогда имеются веские основания думать о
прогрессировании основного процесса. Риск повреждения увеличивается при
влагалищном и шеечном применении радия или рентгеновском облучении
влагалища. В таких случаях поражаются главным образом юкставезикальные
и тазовые отделы мочеточников. В 2 раза чаще верхние мочевые
пути страдают после лучевого, нежели после комбинированного лечения.
В крайне редких случаях под воздействием только лучевой терапии
развиваются мочеточниково-влагалищные и мочеточниково-абдоминальные
свищи (Пашкова Л. М., 1976; Kaser et al., 1973).
Такие осложнения обычно возникают у больных, которые ранее лечились по
поводу воспалительных заболеваний органов малого таза.
Одностороннее поражение мочеточника может протекать без выраженных
клинических симптомов, изменений мочи и крови и выявляются специальными
методами обследования.
В некоторых случаях развивается обструкция мочеточников, в результате
которой нарушается гемодинамика почки, усиливаются процессы воспаления
и склероза, атрофируются клубочки и канальцы, угнетаются обменные
процессы в почке. Наиболее серьезным осложнением обструкции
мочеточников является почечная недостаточность, обусловленная
вовлечением тазовых отделов мочеточников в послелучевой склеротический
процесс. Почечная недостаточность в основном встречается у больных
раком шейки матки. Как правило, развивается она постепенно и нередко
является причиной смерти больных. Впервые описал это осложнение W.
Schmitz в 1920 г.
Наблюдения F. Skjorten (1959), S. Jahrgang (1965), Н. Janisch (1968),
Н. Schrejer и соавт. (1975) и др. свидетельствуют о том, что почечная
недостаточность проявляется в среднем через 2 года после лучевой
терапии. Buchman (1956), изучивший причины смерти 78 больных раком
матки, установил, что 48 (61,5%) погибли от почечной недостаточности.
При вскрытии метастазов и рецидивов опухоли у них не обнаружено.
Н. В. Свечникова (1954) сообщила, что у 10 из 12 женщин, больных раком
половых органов, непосредственной причиной смерти была почечная
недостаточность. По данным Н. Ganson (1960), эта причина привела к
гибели 43 из 70 (61%) онкологических больных. Частота этого осложнения
по данным Н. Boeckler и D. Prinz (1958), Е. Schewe и J. Sala (1959), J.
Warren и соавт. (1970), Sklarof (1978) и др., колеблется от 34 до 80%.
Прогноз при действии на верхние мочевые пути массивной лучевой терапии
в основном неблагоприятен. Летальные исходы составляют 87—89%
(Phleiderer, 1971). Такой прогноз во многом определяется стертой
симптоматикой. Больные обращаются к врачу в основном по поводу болевого
синдрома, инфекции мочевых путей и гипертензии. При клиническом
исследовании обнаруживается почечная недостаточность.
Лабораторными методами исследуют содержание остаточного азота,
мочевины, креатинина крови и др.
Среди рентгенорадиологических методик наибольшее значение имеют
экскреторная урография, изотопная ренография и сканирование
(сцинтиграфия) почек.
Внедрение в клиническую практику рентгенотелевидения и
рентгенокинематографии создало условия для объективной оценки состояния
почек и верхних мочевых путей у этих больных. Обструкция мочеточников,
вызванная послелучевым склеротическим процессом, может быть устранена
только оперативным методом. При почечной недостаточности сначала
осуществляют деривацию мочи путем нефростомии. После ликвидации
обструкции возникает полиурия. Как правило, она выражена умеренно,
существует длительно, коррекция ее не представляет значительных
трудностей. После нормализации функции почек восстанавливают пассаж
мочи естественным путем.
Дилатация мочеточников неэффективна. N. К. Lang и соавт. (1979)
бужировали мочеточники, оставляя “шины” в течение
нескольких недель. Вскоре после их удаления вновь появлялась ретенция
верхних мочевых путей. Не добились положительных результатов I. С.
Smith и соавт. (1979), рассекая интрамуральный отдел мочеточника и
устанавливая “шину” через чрескожную нефростому.
Редко у
этих больных применяют уретероцистонеостомию, так как обструкция
мочеточника находится в месте пересечения широкой связки матки.
Так как мочеточники окружены толстым периуретеральным чехлом и спаяны с
окружающими тканями, восстановить пассаж мочи естественным путем можно
операцией Боари, перекрестным мочеточниково-мочеточниковым анастомозом
или изолированной кишечной петлей.
Для облегчения выделения мочеточников L. H. Greenberg и соавт. (1981)
рекомендуют их катетеризировать антеградным путем под контролем
рентгеновского экрана. Это производят в тех случаях, когда ретроградная
катетеризация невозможна.
Ценность этих операций в реконструктивной хирургии мочеточников
доказана многими клиницистами (Поляничко М. Ф. и др., 1980; Пытель Ю.
А. и др., 1980). В крайне редких случаях восстанавливают уродинамику
верхних мочевых путей химически инертными и термостойкими протезами из
силикона.
В случаях позднего фиброза околомочеточниковой клетчатки вследствие
лучевой терапии, а также при сложных мочеполовых свищах можно
рекомендовать операцию Бриккера, уретероили нефростомию.
Обобщая собственные материалы, можно утверждать, что около 30% женщин с
первичным раком шейки матки умирают от урологических осложнений, но
излеченные от основного заболевания. Между тем хирургическая коррекция
пострадиационных обструкций мочеточников представляет серьезные
затруднения. Примерно в 70—75% случаев операции заканчиваются
успешно. Отрицательные исходы в основном наступают из-за фиброза стенки
мочеточника.
Лучевые мочеполовые свищи.
Особенно тяжелым осложнением в онкогинекологической практике считаются
мочеполовые свищи. Формируются они в 0,5— 10% случаев после
комбинированного и лучевого лечения рака шейки матки (Евсеенко Л. С.,
1961; Серебров А. И., 1968; Мин-газов М. В., 1975; Городецкий А. Г.,
1976; Киселева И. М., 1982; Bokonow, Tutledge, 1971; Obrink A. etal.,
1978; Dean A. L., Lytton S., 1978; Currera, 1980, и др.). Большинство
фистул возникают в течение 1 1/2—2 лет после завершения курса
облучения. Н. L. Kottmeier (1964) наблюдал больную, у которой свищ
образовался через 28 лет, a J. Kindt (1981) — через 38 лет
после
радикального лечения рака шейки матки. У 38 больных свищи развились в
течение первого года болезни, а у 6 — в период от 2 до 18 лет (Кан Д. В. и др., 1981).
В результате лучевой терапии нарушается крово- и лимфообращение
маточно-влагалищного, мочепузырного и обоих подчревных сплетений,
происходит атрофия эпителия с изъязвлением и образованием фистул. Имеет
значение индивидуальная чувствительность организма к радиации. Однако
чаще свищи возникают вследствие превышения дозы облучения.
U. Niemineu и соавт. (1970) 461 больной провели лучевую терапию по
поводу рака шейки матки. У 44 (7,8%) из них образовались мочеполовые
свищи. В 6 случаях была превышена максимальная доза облучения. 17
больным в связи с рецидивом опухоли лучевую терапию неоднократно
повторяли.
По данным J. Massel с соавт. (1974), после лучевого лечения рака шейки
матки свищи образовались в 3,2% случаев, а после комбинированного
лечения — в 11,9%. Следовательно, фистулы чаще образуются
после
радикальной гистерэктомии. Оперативному лечению предшествует лучевая
терапия. Об этих осложнениях у больных раком шейки матки впервые
сообщил W. Weibel (1919). По сравнению с мочеполовыми свищами другой
этиологии они составили 8,1% (Кан Д. В. и др., 1981).
Совершенно иные данные представлены из онкологических клиник. М. Ф.
Поляничко (1968) наблюдал 80 больных с мочеполовыми свищами, причем у
60 (75%) женщин они образовались после лучевой терапии. Rahriedt (1970)
сообщил о 242 больных с мочеполовыми свищами, из них 167 (69%) получали
лучевую терапию.
После радикального лечения рака шейки матки в 1,9—12,3%
случаев
формируются мочеточниково-влагалищные свищи (Вехова Л. И., 1970;
Деревянко И. М., 1974; Awad S. et al., 1978, и др.). Заметим, что
только облучение почти никогда не вызывает мочеточниковые фистулы.
Развиваются они преимущественно в результате ишемического некроза.
Образованию фистул предшествуют боли и температура. Основная жалоба
— непроизвольное выделение мочи. Часто таких больных
беспокоят
боли в мочевом пузыре и в промежности, вызванные инкрустацией слизистой
оболочки солями.
Ткани, окружающие фистулу, как правило, чрезвычайно плотны и
кровоточат. Под действием инфицированной мочи на их поверхности оседают
соли. Даже при легком прикосновении больные испытывают сильную боль.
Слизистая оболочка мочевого пузыря отечна, отдельные участки изъязвлены
и инкрустированы солями. В такой ситуации вряд ли можно рассчитывать на
успех пластической операции. Нередко имеются признаки хронической и
даже острой почечной недостаточности.
“Руководство по
акушерской и гинекологической урологии” Д.В.Кан – конспект.
Оглавление
Источник
