Послеоперационное заживление мочевого пузыря

Решение проблемы заживления ран после операции в урологии (в т.ч. на мочевом пузыре)
Медленное заживление послеоперационных ран является актуальной проблемой в урологии. Почему такие раны заживают дольше других? Дело в том, что в урологической практике изначально высока вероятность послеоперационных воспалительных осложнений. Это связано со следующими особенностями:
Края такой раны постоянно находятся в мокнущем состоянии, вынужденном сдавлении со стороны дренажных трубок, катетеров, быстро воспаляются и нагнаиваются. Действие перечисленных факторов длительно сохраняется, что значительно тормозит процесс заживления раны. Обычные ранозаживляющие препараты в этом случае не помогают, т.к. они не могут противодействовать торможению деления клеток кожного покрова. Регенерационные процессы остаются угнетёнными. Совместно с учёными Российской академии наук и Института хирургии им. Вишневского (г.Москва) разработан Инновационный подход к лечению сложных ран, который реализован в оригинальном препарате «СТЕЛЛАНИН». Для создания препарата были привлечены одни из лучших специалистов страны и использованы новейшие достижения молекулярной биологии.
Стелланин особенно проявляет себя у лиц с угнетённым метаболизмом. Он способствует делению клеток кожного покрова в ране, активно стимулирует ранее УГНЕТЕННЫЕ процессы регенерации. Стелланин в 7,5 раз увеличивает число фибробластов в ране – основных клеток, участвующих в восстановлении повреждённого кожного покрова. Эффективность препарата была подтверждена ведущими учёными России: “Уже в первые сутки лечения ран мазью Стелланином-ПЭГ отмечается положительная динамика в процессе заживления, уменьшается воспаление… В ране появляются молодые клетки с высоким уровнем обменных процессов”. Из Отчета, утвержденного Директором Института хирургии им. А.В.Вишневского академиком РАМН В.Д.Федоровым. Вывод: Препарат обладает отличным регенерирующим, антибактериальным, противовоспалительным и противоотечным действием. Эффекты препарата СТЕЛЛАНИН®:
1. Узнайте цену в аптеках Вашего города: С помощью этого сервиса также можно заказать доставку Стелланина как в крупные города, так и в удаленные населенные пункты России (к сервису подключено более 14000 аптек). Заказ и доставка бесплатны. Оплата самого препарата осуществляется в аптеке при получении товара. 2. Перечень аптек Вашего города, имеющих Стелланин в наличии КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ СТЕЛЛАНИНА подтверждена специалистами ведущих научных центров России: |
Источник
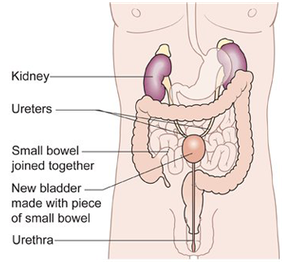 После удаления мочевого пузыря пациента переводят в палату интенсивной терапии, где он приходит в себя, и его состояние нормализуется.
После удаления мочевого пузыря пациента переводят в палату интенсивной терапии, где он приходит в себя, и его состояние нормализуется.
Послеоперационный период при цистэктомии (уход за больным)
Боль или дискомфорт врачи устраняют с помощью лекарств. Для многих больных применяют эпидуральную анестезию, другим – дают лекарства по мере необходимости. В некоторых случаях пациент более продолжительное время находится в отделении интенсивной терапии.
К больному после цитэктомии подключают мониторы, дренажи. Примерный список:
- Кислород. Подача кислорода длится 1-2 дня, зависит от состояния человека. Медсестра проверяет уровень кислорода и жизненно важные показатели каждые 4 часа.
- Назогастральный зонд. Его помещают во время операции через нос в желудок. С помощью зонда сливают содержимое желудка для излечения и восстановления кишечника. Зонд находится внутри 5-7 дней. Иногда наблюдается боль в горле и сухость во рту. В это время пациент ничего не есть и не пьет. Зонд удаляют, когда кишечник восстанавливает работу.
- Центральный венозный катетер. Внутривенное вливание питает организм в этот период. Жидкость поступает в крупную вену, часто в области шеи-груди через катетер. Его размещают во время операции и применяют для капельницы, введения лекарств, переливания крови, взятия проб крови.
- Контролируемая пациентом анальгезия. Небольшой насос (помпу) с запасом обезболивающего препарата, который назначил врач, прикрепляют к капельнице. Помпу настраивают так, чтобы пациент при ощущении боли мог нажимать кнопку. Для быстрого снятия симптома небольшое количество лекарства поступает в кровоток.
- Последовательные компрессионные устройства. Рукав размещают вокруг каждой ноги. Он соединен с насосом, который прокачивает воздух через разные части рукава, создавая давление вокруг икр. Давление ускоряет движение крови по сосудам, предотвращая образование тромбов. Эти устройства надевают ночью, в течение дня, исключая случаи, когда больной покидает кровать и начинает ходить.
- Стимулирующий спирометр – устройство для сохранения здоровья легких после операции. Медсестра обучает, как его использовать. В итоге снижается риск инфекции легких и/или затрудненное дыхание.
- Дренирующее устройство Hemovacs ускоряет заживление раны, удаляя избыточную жидкость. Дренажную трубку помещают во время цистэктомии, закрепляют с помощью стежков. В основном применяют две трубки, которые удаляют перед выпиской.
Обильное питье будет возможно, когда восстановится работа кишечника. Ранее возвращение к приему пищи и жидкости может привести к тошноте и рвоте. Испражнение кишечника будет возможно через несколько дней, когда работа органа восстановится.
Важно начать сидеть и ходить уже на следующий день после операции. Это предотвращает серьезные осложнения – развитие пневмонии и образование тромбов в ногах. Медсестры и физиотерапевты помогают пациентам.
Перед выпиской больным назначают анальгетики и препараты для профилактики запоров – побочный эффект обезболивающих средств. Некоторым пациентам предписывают антибиотики.
Через пять дней после хирургии приходят результаты гистологии, пациент почти всегда находится в это время в больнице. На базе полученных итогов обсуждаются варианты дальнейшего лечения.
Спустя 2-3 недели после выписки больной посещает клинику для послеоперационной проверки. Даже после хирургического вмешательства требуется наблюдение на постоянной основе, чтобы удостовериться, что болезнь не вернулась.
Однако если возникают следующие симптомы, нужно неотложно обратиться к врачу:
- Возникла боль или припухлость в ногах, внезапная боль в груди или одышка.
- В месте разреза появилось покраснение, болезненность, ощущение жара.
- Лихорадка.
- Сильная тошнота или рвота.
Исследования показали, что применение некоторых трав может вызывать осложнения у людей после хирургического вмешательства. Важно обратить внимание на следующие виды растений:
- Хвойник.
- Эхинацея.
- Пиретрум девичий.
- Чеснок.
- Имбирь.
- Женьшень.
- Голднесил.
- Гинкго билоба.
- Кава-кава.
- Лакрица.
- Зверобой.
- Валериана.
- Витамин Е.
- Со Пальметто.
Травы могут оказать следующие действия:
- изменить или удлинить эффекты лекарственных средств, применяемых при анестезии;
- повлиять на кровотечение или свертывание;
- оказать воздействие на кровяное давление или взаимодействовать с лекарствами, используемыми во время операции.
Во многих случаях прием фитопрепаратов лучше прекратить за 2-3 недели до хирургии.
Возможные осложнения после удаления мочевого пузыря при раке
Это серьезная операция. Из перечисленных ниже осложнений у пациента может не наблюдаться ни единой проблемы. Следует знать, что во всем мире при выполнении радикальной цистэктомии существует 60% вероятность, что возникнет одно из указанных ниже последствий. Врачи клиники Ассута прилагают все усилия, чтобы снизить риск осложнений.
Общие последствия удаления мочевого пузыря у мужчин и женщин:
- Толстый кишечник будет очень медленно возвращаться к нормальному состоянию после хирургии, что потребует временного введения назогастрального зонда. Иногда это продолжается несколько месяцев.
- Потеря эректильной функции у мужчин. Часто в ходе цистэктомии удаляют нервы, которые необходимы для эрекции.
- Сухая эякуляция у мужчин, которая не означает утрату оргазма.
- Уменьшение размеров влагалища у женщин, что затруднит половой акт. Снизит вероятность достижения оргазма.
- Рак могут не вылечить с помощью удаления только мочевого пузыря.
- Развитие инфекции в кишечнике или ране.
- Потеря крови.
Редкие осложнения после удаления мочевого пузыря при раке:
- Проблемы с анестезией, легкими и сердцем, что потребует пребывания в интенсивной терапии (инфекции дыхательных путей, сердечный приступ, инсульт).
- Тромбы в ногах или легких.
- Снижение функции печени со временем.
- Диарея.
- Сужение мочеточника на месте соединения с кишечником.
- Рецидив рака в сохраненной уретре.
- Повышенное содержание кислоты в крови, что потребует лечения.
- Дефицит витаминов.
Очень редкие последствия операции по удалению мочевого пузыря:
- Необходимость проведения еще одного хирургического вмешательства.
- Утечка мочи.
- Повреждение кишечника, крупных кровеносных сосудов и нервов.
- Травма кишечника, требующая создания обходного пути.
Реабилитация после удаления мочевого пузыря
Важно оставаться физически активным даже во время восстановления. Ежедневные прогулки ускорят выздоровление, уменьшат депрессию, повысят мышечный тонус. Примерно шесть недель нужно для полного заживления оперируемой области. В этот период противопоказаны тяжелые и напряженные упражнения, чрезмерное хождение по лестнице. Можно будет водить машину спустя 3-4 недели после цистэктомии, если пациент себя хорошо чувствует и не принимает без рецепта какие-либо обезболивающие препараты.
Требуется ли специальная диета после удаления мочевого пузыря?
Конкретные рекомендации врачи дают во время выписки. Большинство пациентов вернутся к обычному рациону. Но специалисты советуют есть маленькими и частыми порциями и употреблять много жидкости.
На какую помощь и поддержку может рассчитывать пациент в Ассуте?
В клинике больному дадут инструкции по уходу за катетерами и стентами. Если создается стома, медсестра проведет инструктаж и обучение.
Радикальная цистэктомия и реконструктивная операция – серьезное испытание. В клинике доступна поддержка, чтобы помочь человеку справиться с ситуацией, ее влиянием на жизнь. Психолог – часть команды врачей, работающей с пациентом.
Вопросы к врачу
Эти вопросы полезны при беседе со специалистом о заболевании – раке мочевого пузыря и радикальной цистэктомии:
- После операции будет продолжено лечение?
- Каковы риски хирургии?
- Есть ли побочные эффекты оперативного вмешательства?
Рекомендации для общения с врачом
Эти советы помогут следить за информацией, которая обсуждается в ходе визитов:
- Нужно составить список вопросов, которые пациент хочет задать специалисту.
- Можно пригласить друга или члена семьи, который будет сопровождать больного и оказывать моральную поддержку.
- Пациенту или сопровождающему стоит делать заметки во время визита к врачу.
Источник
Комяков Б.К., Очеленко В.А., Т.Х. Ал. – Аттар
В настоящее время для замещения мочеточника и мочевого пузыря предложено и используется на практике более 80 различных вариантов восстановительных операций [1, 2]. Наибольшее распространение среди них нашли реконструктивные вмешательства, основанные на использовании собственных неизмененных тканей мочевых путей (уретероуретероанастомоз, различные варианты перекрестных анастомозов, операции Боари, Демеля и psoas-hith), а также операции с применением в качестве трансплантатов различных сегментов желудочно-кишечного тракта (ЖКТ), в том числе и червеобразного отростка [3]. По мнению многих авторов, функциональные и органические расстройства нижних мочевыводящих путей (НМП) могут являться если не абсолютными, то, во всяком случае, относительными противопоказаниями к кишечной реконструкции мочеточников [8-11]. Поэтому перед восстановительной операцией следует убедиться в наличии или отсутствии расстройств НМП, а при их обнаружении постараться таковые полностью устранить [13, 14].
В данной работе мы решили сравнить функциональное состояние нижних мочевых путей у пациентов с протяженными сужениями мочеточников, которым произведена кишечная и аппендикулярная уретеропластика или пластика с использованием собственных неизмененных тканей мочевых путей.
МАТЕРИАЛ И МЕТОДЫ
Для проведения сравнительного исследования нами были отобраны 175 больных с протяженными сужениями тазовых отделов мочеточников, которые оперированы и наблюдались в нашей клинике с 1998 по 2014 г. Возраст обследуемых колебался от 18 до 69 лет и в среднем составил 45,3±8,7 года. Мужчин было 79 (45,2%), а женщин 96 (54,8%). Все пациенты были разделены на три группы. Первую группу составили 102 (58,3%) больных, которым произведена пластика протяженных дефектов мочеточников с использованием неизмененных тканей мочевыводящих путей (операция Боари и ее модификации); вторую – 54 (30,1%) больных, которым произведена кишечная пластика мочеточников и третью – 19 (10,9%) пациентов, которым выполнена аппендикоуретеропластика. Сравниваемые группы не имели статистически значимых различий по полу и возрасту (p
Всем больным до операции и в разные сроки после нее было выполнено комплексное уродинамическое исследование, даже если они не предъявляли жалоб на расстройства мочеиспускания. Средние уродинамические показатели больных всех 3 групп перед оперативным вмешательством достоверно не отличались друг от друга (p>0,5). Оценка функционального состояния почек и мочевых путей в ближайшем и отдаленном послеоперационном периоде осуществлялась также на основании обследования, включающего определение уровня сывороточного креатинина, электролитов, кислотно-основного состояния крови, ультрасонографию верхних и нижних мочевых путей, экскреторную урографию, реносцинтиграфию, ретроградную и антеградную пиелоуретерографию с пробой Whitaker′a, компьютерную томографию брюшной полости и малого таза, при необходимости цисто-и уретероскопию. Срок наблюдения составил от 3 месяцев до 16 лет (в среднем – 7,3±0,8 лет). При обработке данных все статистические вычисления производились с использованием компьютерной программы “ISTICA for Windows”. При сравнениях установлен уровень значимости α = 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В послеоперационном периоде больные получали антибактериальную и симптоматическую терапию. Большое внимание уделялось функции мочевых дренажей, проводилась периодическое промывание их растворами антисептиков. Мочеточниковые интубаторы удаляли на 10-12-е сутки. После этого выполняли антеградную пиелоуретерографию и при хорошей проходимости извлекали нефростомический дренаж, а затем выписывали больного на амбулаторное лечение. В таблице 1 приведены данные о ранних послеоперационных осложнениях в группе пациентов, перенесших операцию Боари-Демеля.
Как видно из таблицы, частота ранних послеоперационных осложнений после замещения мочеточников по методу Боари, Демеля и psoas-hitch составила 4,9%. Еще более интересны данные о поздних осложнениях после этих опе-раций. Это связано с тем, что большой клинический материал отличается многообразием не только исходных показателей, но также и отдаленных результатов хирургического лечения. Сведения о поздних послеоперационных осложнениях после операций по методу БоариДемеля приведены в таблице 2. Из таблицы также видно, что двум больным на фоне прогрессирующего гидронефроза и вторичного сморщивания почки была выполнена нефрэктомия, один пациент перенес нефролитолапаксию по поводу рецидивной мочекаменной болезни при единственной почке. Среди поздних осложнений обращают внимание больные с нейрогенной дисфункцией мочевого пузыря (5) и пациенты, у которых возник пузырно-мочеточниковый рефлюкс на здоровой стороне (2). Эти примеры подтверждают тезис о том, что широкое выделение стенки мочевого пузыря и выкраивание из него лоскута могут явиться причинами развития недостаточности детрузора [12, 13].
В группе пациентов, которым произведена пластика тазового отдела мочеточника по методу Боари, ранние послеоперационные осложнения развились у 5 (4,9%) больных, поздние – имели место у 13 (12,8%) пациентов, что оказалось достоверно выше, чем в группах сравнения (p
Комплексное уродинамическое исследование было проведено всем пациентам и включало следующие показатели:
- максимальная объемная скорость потока (мл/с);
- время мочеиспускания (с); − количество остаточной мочи (мл);
- объем мочевого пузыря при первом позыве (мл);
- максимальный объем мочевого пузыря (мл);
- микционное давление (см вод.ст.);
- давление при максимальной емкости (см вод.ст.)
Средние уродинамические показатели больных всех 3 групп перед оперативным вмешательством достоверно не отличались друг от друга (p>0,5).
Таблица 1. Ранние послеоперационные осложнения после операции Боари-Демеля
| Осложнение | Кол-во больных | Метод лечения | Исход |
|---|---|---|---|
| Несостоятельность уретероцистоанастомоза | 1 | Эндоскопическое трансуретральное стентирование анастомоза | Выздоровление |
| Нагноение раны. Вторичное заживление | 3 | Консервативное лечение | Выздоровление |
| Тромбоз наружной подвздошной артерии | 1 | Консервативное лечение | Выздоровление |
| Всего | 5 (4,9%) | ||
Таблица 2. Поздние послеоперационные осложнения после операций Боари-Демеля
| Осложнение | Кол-во больных | Метод лечения | Исход |
|---|---|---|---|
| Гидроуретеронефроз 1-2 степени на стороне операции | 3 | Консервативное лечение | Течение без отрицательной динамики |
| Нейрогенная дисфункция мочевого пузыря | 5 | Консервативное лечение | Выздоровление |
| Вторичный нефросклероз | 2 | 1. Нефрэктомия 2. Консервативное лечение, контроль | 1. Выздоровление 2. Течение без отрицательной динамики |
| Рецидив мочекаменной болезни | 1 | Нефролитолапаксия | Выздоровление |
| Клинически значимый пузырно-мочеточниковый рефлюкс | 2 | Консервативное лечение | Течение без отрицательной динамики |
| Всего | 13 (12,8%) | ||
Таблица 3. Данные уродинамических показателей НМП в зависимости от метода восстановительной операции
| Показатели уродинамики | Операция Боари (n=102) | Кишечная пластика мочеточника (n=54) | Аппендикулярная пластика мочеточника (n=19) | |||
|---|---|---|---|---|---|---|
| До операции | Через 12мес. | До операции | Через 12мес. | До операции | Через 12мес. | |
| Объем мочевого пузыря, мл | 410,7±21,3 | 321,8±14,6* | 385,5±6,6 | 409,7±10,4 | 392,8±5,6 | 411,9±9,3 |
| Частота мочеиспускания | 5,3±0,6 | 7,8±1,0* | 5,7±0,8 | 5,7±0,2 | 6,2±0,9 | 6,2±0,5 |
| Максимальная скорость мочеиспускания, см вод.ст. | 29,4±0,6 | 24,3±0,7* | 26,8±3,6 | 28,7±2,5 | 28,1±3,7 | 27,7±3,1 |
| Максимальное давление, см вод.ст. | 11,7±0,9 | 16,3±0,6* | 13,3±0,7 | 12,8±0,6 | 13,4±0,9 | 13,2±0,7 |
| Давление при первом позыве, см вод.ст. | 2,3 ±0,7 | 3,0±1,2 | 2,5±1,4 | 2,3±0,7 | 3,3±1,5 | 2,5±1,1 |
| Давление при максимальной емкости, см вод.ст. | 14,3±3,7 | 15,6±2,5 | 13,6±3,3 | 14,4±2,5 | 14,1±3,3 | 13,3±2,7 |
| Объем возникновения первого позыва, мл | 158,8±9,6 | 119,3±8,3* | 163,9±10,2 | 168,5±9,6 | 162,9±9,9 | 168,2±8,9 |
| Комплаентность, мл/см вод.ст. | 35,5±5,3 | 24,2±3,6* | 36,9±6,4 | 37,8±7,5 | 37,3±7,1 | 37,2±8,1 |
| Объем остаточной мочи, мл | 18,7±4,0 | 16,5±3,8 | 15,6±3,3 | 18,6±4,9 | 16,9±4,0 | 19,2±5,1 |
В таблице 3 представлены сравнительные данные уродинамики НМП у больных до операции и после кишечной, аппендикулярной пластики мочеточников и пациентов, перенесших операцию Боари. По данным таблицы следует, что у больных последней группы через 12 месяцев после операции определяется достоверное снижение функциональной емкости, уменьшение эластичности стенки мочевого пузыря. Можно говорить о появлении таких характерных симптомов гиперактивности мочевого пузыря, как учащение мочеиспускания, императивные позывы к мочеиспусканию.
Подобные изменения в уродинамических характеристиках мочевого пузыря у этих больных объясняются, вероятно, частичной денервацией детрузора во время выделения стенки и уменьшением его емкости, вызванного выкраиванием из него лоскута. Как видно из таблицы, у больных, перенесших кишечную и аппендикулярную реконструкцию мочеточников, подобных функциональных расстройств мочевого пузыря не наблюдалось. Минимальный травматизм при кишечной и аппендикулярной пластике, особенно при внутрибрюшинном выполнении кишечно-пузырного анастомоза, позволяет сохранить функциональные возможности мочевого пузыря у подавляющего большинства больных этой группы.
Полученные результаты убеждают в том, что по эффективности и безопасности кишечная пластика мочеточников ничуть не уступает, а может даже опережать результаты операции по замещению мочеточников тканями собственной мочевыделительной системы. Поэтому следует пересмотреть существующее отношение к реконструкции мочеточников кишечным сегментом или аппендиксом как к резервному вмешательству, к которому прибегают в последнюю очередь, когда все остальные возможности исчерпаны.
Преимуществом аппендикулярной и кишечной пластики перед операцией Боари является то, что и без того поврежденному во время предшествующих операций мочевому пузырю наносится минимальная травма. При этом риск развития его дисфункции в результате снижения емкости, образования окружающих рубцов, деформации стенки и нейроваскулярных расстройств минимален. Средняя продолжительность операции при аппендикулярной пластике мочеточников ненамного выше, чем при операции Боари, однако по количеству ранних и поздних послеоперационных осложнений аппендикулярная пластика имеет преимущества перед “лоскутной”. Изучение уродинамических характеристик нижних мочевыводящих путей показало преимущество кишечной и аппендикулярной пластик перед “лоскутными” операциями, поскольку восстановление мочеточника за счет тканей мочевого пузыря достоверно уменьшает его функциональную емкость, снижает эластичность стенки, проявляясь склонностью к нейрогенной дисфункции мочевого пузыря и пузырнолоханочным рефлюксам. Замещение мочеточника аппендиксом представляет собой его удлинение до мочевого пузыря. Таким образом, червеобразный отросток в роли трансплантата является продолжением мочеточника, поэтому такое замещение можно назвать «идеальной» пластикой мочеточника.
Пластику мочеточника сегментом подвздошной кишки следует рассматривать как увеличение полости мочевого пузыря навстречу мочеточнику, так как кишка в данном случае играет роль буферного резервуара, относящегося к мочевому пузырю. Кишечное замещение мочеточника – более длительная и сложная операция по сравнению с непрямым уретероцистоанастомозом. Вместе с тем, статистически значимых различий в частоте ранних и поздних осложнений при кишечной, аппендикулярной и лоскутных пластик нами выявлено не было.
ЗАКЛЮЧЕНИЕ
Кишечная, а в ряде случаев и аппендикулярная пластика, при протяженных стриктурах мочеточника зачастую являются единственной возможностью сохранить почку, избежать инвалидизирующей уретерокутанеоили нефростомии и восстановить мочеиспускание естественным путем. Данные операции позволяют заместить дефекты одного или обоих мочеточников любой локализации и протяженности и получить хорошие функциональные результаты на отдаленных сроках, нередко являясь эффективной и безопасной альтернативой операциям по замещению мочеточников тканями собственной мочевыделительной системы. Изучение уродинамических характеристик нижних мочевыводящих путей показало преимущество кишечной и аппендикулярной пластик перед “лоскутными” операциями, поскольку восстановление мочеточника за счет тканей мочевого пузыря достоверно уменьшает его функциональную емкость, снижает эластичность стенки, проявляясь склонностью к нейрогенной дисфункции мочевого пузыря и пузырнолоханочным рефлюксам.
ЛИТЕРАТУРА
1. Лоран О.Б., Синякова Л.А., Серегин А.В., Твердохлебов Н.Е. Довлатов З.А. Текеев М.А. Использование изолированных сегментов кишечника в оперативном лечении лучевых повреждений мочевыводящих путей. // Урология. 2012. N 2. С. 20 – 24
2. Gallucci M, Vincenzoni A, Flammia G, Alcini A, Albino G, Akpan GP. Bilateral ureter substitution with ileal loop in bilateral ureter stenosis after orthotopic neobladder reconstruction // Eur. Urol. Suppl. 2002. Vol. 1. P. 102.
3. Hohenfellner M, Black P, Leissner S, Allhof ER. Refluxing ureterointestinal anastomosis for continent cutaneus urinary diversion. // J Urol. 2002. Vol. 168. P. 1013-1017.
4. Cheng M, Looney SW, Brown JA. Ureteroileal anastomotic strictures after a Bricker ileal conduit: 50 case assessment of the impact of conversion from a slit incision to a “shield shaped” ileotomy. // Can J Urol. 2011. Vol. 18, N 2. P. 5644-5649.
5. Chung BI, Hamawy KJ, Zinman LN, Libertino JA. The use of bowel for ureteral replacement for complex ureteral reconstruction: long-term result. // J Urol. 2006. Vol. 175, N 1. P.179-183.
6. D´Urso GA , De Fabii AF. Ricerche sperimental sulla uretero-entero-plastika. // Il. Policlinico. 1900. Vol.VII, N 14. P.348
7. Komyakov BK, Ochelenko VA. Long-term results of 50 ureteral replacements with ileum. // Eur Urol Suppl. 2013. N 12. P.e562
8. Карпенко В.С. Кишечная пластика мочеточников в лечении приобретенных обструктивных уретерогидронефрозов // Урология. 2001. N 2. С.3 -6.
9. Комяков Б.К., Гулиев Б.Г., Дорофеев С.Я., Бурлака О.О. Аппендикоуретеропластика.//Урология. 2006. N 5. С.19-24.
10. Motiwala H.G., Shab S.A., Patel S.M. Ureteric substitution with Boari bladder flap. // Br J Urol. 1990. Vol. 66. P. 369371.
11. Schoeneich G, Winter P, Albers P, Fröhlich G, Müller SC. Management of complete ureteral replacement. Experiences and review of the literature. // Scand J Urol Nephrol. 1997. Vol. 31, N 4. Р. 383-388.
12. Taha A, Querfani B, Sahnoun A, Hamid F, El Mrini M. Appendicular ureteroplasty to repair a ureteric lesion during disk surgery. // Prog Urol. 2005. Vol. 15, N 4. P. 725-728.
13. Komyakov B.K., Ochelenko V.A. Replacement of ureteral defects with vermiform appendix: report of 16 causes. // J Urol. 2013. Vol.189, N 4. P.6-7.
Источник

