Пхт при раке мочевого пузыря
 При раке мочевого пузыря может быть назначена химиотерапия. Она применяется в разных ситуациях:
При раке мочевого пузыря может быть назначена химиотерапия. Она применяется в разных ситуациях:
- До или после проведения операции трансуретральной резекции (ТУР) опухоли.
- В комбинации с лучевой терапией в качестве альтернативы к операции.
- Если при раке мочевого пузыря уже образовались метастазы.
Стоимость химиотерапии рака мочевого пузыря в Германии.
Химиотерапия, назначаемая при ранних стадиях рака мочевого пузыря, закрепляет эффект хирургического вмешательства и служит дополнением к операции по резекции опухоли.
Химиотерапия, которая проводится после ТУР мочевого пузыря, называется адьювантной (дополнительной). Она призвана уничтожить злокачественные клетки, которые, возможно, еще остались после операции. При этом химиопрепараты вводят через катетер непосредственно в мочевой пузырь и оставляют там на 2-3 часа. Эту процедуру повторяют, как правило, несколько раз с промежутком в одну неделю. Такая химиотерапия снижает риск рецидивов и благоприятно влияет на прогноз выживаемости при раке мочевого пузыря.
Химиотерапия при раке мочевого пузыря проводится и до операции – ее называют неоадьювантной терапией. Она призвана уменьшить опухоль и упростить операцию, или же в принципе сделать ее возможной.
Если полное удаление мочевого пузыря при раке на поздних стадиях по тем или иным причинам невозможно (возраст пациента, наличие сопутствующих заболеваний, отказ пациента от операции и пр.), то альтернативной может служить комбинация из лучевой терапии и химиотерапии. Иногда назначается только лучевая терапия.
Но, как показали исследования, прогноз при раке мочевого пузыря (то есть, сколько проживут больные после лечения) лучше у тех пациентов, кому была проведена лучевая терапия в сочетании с химиотерапией при опухоли, проросшей в мышечный слой, но еще не давшей метастазы.
Метастазы при раке мочевого пузыря

При поздних стадиях рака мочевого пузыря, когда опухоль образовала метастазы, назначается системная химиотерапия. Зачастую это единственная возможность, продлить жизнь пациенту и улучшить качество его жизни.
Чтобы усилить воздействие химиотерапевтических препаратов на злокачественные клетки, при метастазах при раке мочевого пузыря применяются комбинации различных медикаментов. В сравнении с монохимиотерапией (применение одного химиотерапевтического препарата) применение нескольких препаратов повышает ответ на лечение рака мочевого пузыря до 70%, а до 30% пациентов могут надеяться на ремиссию.
При метастазах при раке мочевого пузыря в Германии преимущественно используется схема MVAC/MVEC:
- метотрексат
- +винбластин
- +адриамицин (или эпирубицин)
- +цисплатин.
Используется также новый класс соединений – таксаны.
Выживаемость при раке мочевого пузыря – прогнозы
Конечно, всех пациентов с таким диагнозом волнует вопрос, сколько живут при раке мочевого пузыря? Ответ на него зависит от стадии, на которой обнаружен рак, от правильности подобранной терапии и других факторов.
- Если рак мочевого пузыря обнаружен на ранних стадиях, то шансы на излечение достаточно высоки. По данным исследований, пациенты живут после проведенного лечения 10 и более лет.
- При поздних стадиях рака мочевого пузыря ответ на вопрос, сколько проживут пациенты, во многом зависит от реакции организма на применяемые методы лечения, в частности, ответ на химиотерапевтические медикаменты. При должном лечении пациенты могут прожить даже при образовавшихся метастазах 2 года и более.
В целом, на поздних стадиях прогноз продолжительности жизни при раке мочевого пузыря более благоприятен, чем при поздних стадиях других онкологических заболеваний.
Источник
Лечение инвазивного рака мочевого пузыря – актуальная проблема онкоурологии. Стандартным видом лечения в этой ситуации остается радикальная цистэктомия с различными методами деривации мочи. Вместе с тем существует множество публикаций о возможности проведения органосохраняющее лечения, результаты которого в определенных группах пациентов не уступают таковым после удаления органа. Сочетание эндоскопической хирургии, химио-, лучевой терапии позволяет не только добиться высоких показателей отдаленной выживаемости, но и сохранить собственный функционирующий мочевой пузырь.
Появление в клинической практике химиопрепаратов (гемцитабин, таксаны) высокоэффективных в отношении переходно-клеточного рака, дает надежду на повышение эффективности комбинированного лечения больных инвазивным раком мочевого пузыря.
В исследование было включено 69 больных раком мочевого пузыря в стадии Т2а-4аN0M0. Среди них было 59 мужчин и 10 женщин, средний возраст больных – 59 лет. Характеристика больных представлена в табл. 1.
Таблица 1. Характеристика больных
Показатель | ТУР +2 курса ПХТ+ химиолучевая терапия | 3 курса ПХТ + химиолучевая терапия | Всего |
Количество больных, м./ж. | 31 26/5 | 38 33/5 | 69 59/10 |
Средний возраст, годы | 60 | 58 | 59 |
Стадия: | |||
Т2а | 13 | 6 | 19 |
Т2в | 9 | 6 | 15 |
Т3а | 6 | 19 | 25 |
Т3в | 2 | 5 | 7 |
Т4а | 1 | 2 | 3 |
Функция почек: | |||
сохранена | 25 | 27 | 52 |
нарушена | 6 | 11 | 17 |
Степень дифференцировки: | |||
G1 | 6 | 7 | 13 |
G2 | 14 | 19 | 33 |
G3-4 | 11 | 12 | 23 |
Примечание: ТУР – трансуретральная резекция, ПХТ – полихимиотерапия.
В зависимости от местного распространения опухоли больные распределись следующим образом: у 34 (49%) пациентов заболевание было ограничено стенкой мочевого пузыря (Т2а-2в), у 25 (36%) имелась микроинвазия паравезикальной клетчатки (Т3а) и у 10 (15%) – макроскопическое прорастание стенки органа (Т3в) или инвазия предстательной железы (Т4а). Нарушение оттока мочи, связанное со сдавлением одного из устьев мочеточника опухолью, было у 17 (25%) пациентов. После установления диагноза и перед началом специфического лечения 10 (15%) из них выполнена чрескожная пункционная нефростомия под ультразвуковым контролем. У 2 больных выявлена гидронефротическая трансформация с одной стороны. У 5 больных имелась умеренная пиелоэктазия, которая нормализовалась после начала противоопухолевого лечения.
Во всех случаях гистологически верифицирован переходно-клеточный рак. Высокодифференцированные опухоли (G1) были лишь у 13 (19%) больных, в остальных случаях новообразования состояли из умеренно-, низко- и недифференцированных клеток (G2-4).
Исследование носило пилотный характер. Изучали эффективность органосохраняющей терапии. Применяли два варианта лечения. Первый вариант заключался в последовательном выполнении ТУР экзофитной части опухоли, проведении 2 курсов ПХТ и последующей химиолучевой терапии. Показанием для назначения этого метода органосохранной терапии являлось наличие солитарной опухоли, размером не более 5 см, располагающейся в пределах органа, или с наличием микроинвазии окружающей клетчатки (предстательной железы). Схема лечения представлена на рис. 1.
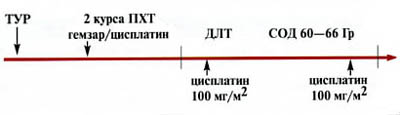
Рис. 1. Схема комбинированного лечения (ТУР, 2 курса химиотерапии, сочетанная химиолучевая терапия) инвазивного рака мочевого пузыря
Целью ТУР было максимальное удаление части новообразования, растущей в просвет органа. Резекция опухоли проводилась последовательно в два этапа. На первом этапе резецировалась экзофитная часть образования, на втором – основание опухоли. После получения гистологического подтверждения мышечной инвазии опухоли больным проводилось два курса системной химиотерапии по схеме гемзар/цисплатин (гемзар – 1000 мг/м2 в 1,8,15-й день, цисплатин – 70 мг/м2 во 2-й день, рецикл – на 29-й день). Для консолидации достигнутого эффекта больным назначалась химиолучевая терапия. Дистанционная лучевая терапия проводилась на ускорителе фирмы “Philips” SL-20 или “Siemens” SL-75 методом дневного дробления дозы на область мочевого пузыря. Дневная доза подводилась дважды по 1 Гр, 5 дней в неделю до суммарной очаговой дозы 60-66 Гр. Размер поля 8х10 или 10х10см. Расстояние “источник – центр ротации” – 100 см. В первую и последнюю 5-дневку проведения лучевой терапии дважды внутривенно вводился цисплатин в дозе 100 мг/м2, сенсибилизирующий опухоль к действию ионизирующего излучения.
Другой вариант комбинированного лечения применялся у больных с опухолями > 5 см либо с мультифокальным поражением мочевого пузыря. Лечение состояло из ряда последовательных этапов (рис. 2).
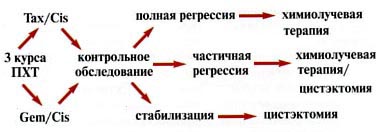
Рис. 2. Схема комбинированного лечения (3 курса химиотерапии + сочетанная химиолучевая терапия) инвазивного рака мочевого пузыря. Tax/Cis – таксотер/цисплатин, Gem/Cis – гемзар/цисплатин
Первоначально всем пациентам назначалось три курса системной ПХТ. Применялись схемы: гемзар/цисплатин и таксотер/цисплатин (таксотер – 75 мг/м2 в 1-й день, цисплатин – 75 мг/м2 в 1-й день, рецикл на 22-й день). Цель неоадъювантной химиотерапии – уменьшение объема опухоли и воздействие на возможные микрометастазы, не определяемые лучевыми методами диагностики. Через 3-4 нед после завершения химиотерапии больных госпитализировали для обследования и продолжения лечения. В случае полной регрессии (ПР) заболевания, проводилась дистанционная лучевая терапия с сочетанным введением цисплатина по той же методике, что и в предыдущей группе. Консервативное лечение также могло быть назначено больным, у которых по данным УЗИ, компьютерной томографии (КТ) и цистоскопии не визуализировалось опухолевых образований, но биопсия из ложа опухоли выявляла микроочаги переходно-клеточного рака. Таким образом, микроскопическое наличие опухоли после неоадъювантной химиотерапии не являлось противопоказанием к проведению консервативного лечения. Решение о продолжении органосохраняющей терапии принималось совместно с пациентом, после обсуждения возможных вариантов лечения и прогноза. При наличии макроскопически определяемых остаточных образований больным рекомендовалось удаление мочевого пузыря.
Непосредственные результаты лечения оценивались через 3 и 6 мес. после его окончания. Для определения объективной регрессии опухоли обязательным являлись пальцевое ректальное исследование, УЗИ, КТ малого таза, цистоскопия с биопсией. Все пациенты, у которых достигнута ПР опухоли через 3 мес после завершения органосохраняющей лечения, оставались под наблюдением. Выявление остаточной опухоли являлось показанием к продолжению лечения. В случае одиночного поверхностного резидуального образования больным выполнялась ТУР с последующей химиотерапией. Если имелась остаточная опухоль без четких границ с признаками инвазивного роста, пациентам предлагалась “спасительная” цистэктомия. Однако при наличии противопоказаний к операции или отказе от удаления мочевого пузыря больным назначалась системная химиотерапия.
Выраженность побочных эффектов в процессе органосохраняющей лечения оценивали по общим критериям токсичности, разработанным Национальным институтом рака США (Common Toxicity Criteria, version 2.0). После окончания терапии больные оставались под наблюдением. Контрольные осмотры проводились через каждые 3 мес в течение первых 2 лет, через 6 мес на 3-м году и затем ежегодно. При наличии остаточной опухоли, рецидива или при прогрессировании болезни этот график изменяли в зависимости от клинической ситуации. Помимо оценки проявлений основного заболевания, во время контрольных осмотров анализировали поздние лучевые реакции. Побочные реакции оценивали по шкале поздних лучевых осложнений, разработанной радиотерапевтической онкологической группой и Европейской организацией по исследованию и лечению рака (RTOG/EORTC Late Radiation Morbidity Scoring Scheme).
Из 69 больных, включенных в исследование, органосохраняющие лечение проведено 64 (92,7%). В их число вошли все пациенты (n=31) 1-й группы, которым проведена комбинированная терапия – ТУР, 2 курса ПХТ гемзар/цисплатин и химиолучевая терапия, а также 33 больных 2-й группы (n=38), в которой применялась комбинация – 3 курса ПХТ + химиолучевая терапия/цистэктомия. 5 больным – после неоадъювантного лечения выполнена радикальная цистэктомия. В табл. 2 представлены результаты 3 курсов системной химиотерапии.
Таблица 2. Регрессия опухоли после неоадъювантной химиотерапии
Схема химиотерапии | Количество больных | ПР | ЧР | Стаби-ли-зация |
Гемзар/ Цисплатин | 20 | 5 | 13 | 2 |
Таксотер/ Цисплатин | 18 | 6 | 12 | – |
Органосохраняющее лечение проведено 11 больным с ПР и 23 пациентам – с частичной регрессией (ЧР) опухоли. Результаты органосохранной терапии, зарегистрированные через 3 и 6 мес после ее окончания, представлены в табл. 3.
Таблица 3. Результаты органосохраняющей терапии
Схема лечения | Количество больных | Результаты лечения, % | |||
через 3 мес | через 6 мес | ||||
ПР | ЧР | ПР | ЧР | ||
ТУР + 2 курса ПХТ+ химиолучевая терапия | 31 | 21 | 10 | 26 | 5 |
3 курса ПХТ + химиолучевая терапия | 38 * | 19 | 14 | 23 | 10 |
* – 5 из этих больных выполнена радикальная цистэктомия.
Количество ПР через 6 мес после завершения лечения возросло, что, вероятно, связано с продолжающейся гибелью опухолевых клеток после химиолучевой терапии, а также с проведением адъювантной терапии. У всех пациентов с ПР после неоадъювантной химиотерапии подтверждено отсутствие опухолевого роста после завершения химиолучевого лечения. Следует отметить удовлетворительную переносимость органосохраняющего лечения. Клинически значимые побочные эффекты суммированы в табл. 4.
Таблица 4. Побочные реакции комбинированного лечения
Токсичность (CTC, version 2.0) | Степень | ТУР + 2 курса ПХТ + химио-лучевая терапия | 3 курса ПХТ + химио-лучевая терапия |
Нейтропения | II-IV | 9 (29) | 11 (29) |
Тромбоци-топения | II-III | 6 (19,4) | 4 (10,5) |
Дизурия | II-III | 1 (3,2) | 2 (6) |
Учащенное мочеиспус-кание | II-III | 1 (3,2) | – |
Примечание: В скобках – процент больных.
Все побочные реакции относительно легко устранялись соответствующим лечением или изменением плана комбинированной терапии.
Редукция доз химиопрепаратов в процессе неоадъювантного лечения потребовалась 24 (34,8%) больным. Дистанционная лучевая терапия доведена до радикальной дозы 60-66 Гр у 60 (93,7%) пациентов. У 4 (6,3%) больных облучение прекращено на СОД 22; 56; 58 и 58 Гр соответственно в связи с развитием острых лучевых реакций III степени тяжести со стороны нижних мочевыводящих путей (дизурия, учащенное мочеиспускание). 46 (71,8%) больным в процессе лучевой терапии дважды вводился цисплатин в дозе 100мг/м2. У 2 пациентов доза редуцирована на 50% в связи с хронической почечной недостаточностью. 16 (25%) пациентам радиосенсибилизация не проводилась, причинами этого были: единственная функционирующая почка (2 больных), печеночная токсичность на неоадъювантном этапе (1), выраженная сердечно-сосудистая патология, лучевая терапия по месту жительства.
Длительность наблюдения в группах больных составила в среднем 34 и 30,2 мес соответственно. Показатели 3-летней общей и скорректированной выживаемости в 1-й группе совпали и были равны 83,3%; во 2-й группе они составили 61,7 и 73,4%.За время наблюдения ни у одного больного не произошло сморщивания мочевого пузыря. Лишь у 2 (3%) пациентов отмечены поздние лучевые циститы II и III степени тяжести.
Мы оценивали также влияние местного распространения опухоли, гистологической дифференцировки опухолевых клеток, наличия пиелоэктазии в связи с опухолью, степени регрессии заболевания на выживаемость больных после органосохраняющей терапии. С этой целью мы объединили обе группы пациентов и сформированы две новые группы. В 1-ю группу вошли больные, у которых опухоль ограничена стенкой мочевого пузыря (Т2а-Т2б), во 2-ю – с распространением опухоли за пределы органа (Т3а-Т4а). По данным однофакторного анализа, влияние на выживаемость имеют стадия Т опухоли и степень ее регрессии после окончания органосохраняющего лечения (табл. 5).
Таблица 5. Влияние факторов прогноза на выживаемость
Критерий прогноза | 3-летняя выжива-емость, % | Однофак-торный анализ (log-rank test) | Много-фак-торный анализ (Cox) | |
Стадия | Т2а-Т2б | 90 | р = 0,02 | р = 0,037 |
Т3а-Т4а | 66 | |||
Степень дифферен-цировки | G1 | 90 | p= 0,921 | p= 0,884 |
G2 | 69 | |||
G3-4 | 84 | |||
Функция почек | Сохранена | 86 | р= 0,067 | р= 0,09 |
Нарушена | 60 | |||
Степень регрессии | ПР | 100 | р=0,001 | р= 0,001 |
ЧР | 45 | |||
Как показал статистический анализ, достоверными критериями (p < 0,05), влияющими на отдаленные результаты лечения, являются: стадии Т2а-Т2бN0M0; ПР опухоли, зарегистрированная через 3 мес после органосохраняющей терапии. Также выявлена тенденция (p < 0,1) к повышению выживаемости больных с сохраненной почечной функцией. Статистически значимого влияния степени дифференцировки опухолевых клеток на эффективность лечения не получено.Эффективность органосохраняющей терапии, продемонстрированная в данном исследовании, в очередной раз подчеркивает правомочность такого подхода. Очевидно, что невозможно проводить прямые сравнения представленных результатов комбинированного лечения с выживаемостью больных после удаления мочевого пузыря. Однако полученные показатели 3-летней выживаемости вполне сопоставимы с эффективностью радикального лечения. Всегда есть пациенты, у которых невозможно сохранить мочевой пузырь и приходится выполнять радикальную цистэктомию. Но определенной группе больных с инвазивным раком мочевого пузыря уже сейчас можно проводить органосохраняющее лечение с положительным результатом.
Разработанное органосохраняющее лечение сопровождалось побочными реакциями, типичными для использованных схем химиотерапии (гемзар/цисплатин, таксотер/цисплатин) и сочетанного химиолучевого воздействия на область мочевого пузыря. Во всех случаях побочные эффекты контролировались своевременным назначением корригирующего лечения или изменением плана органосохранной терапии. Отклонения от схемы лечения касались редукции доз химиопрепаратов, прерывания лучевой терапии. За время проведения исследования не было ни одной смерти, связанной с токсичностью.Количество поздних осложнений II и III степени тяжести со стороны мочевого пузыря составило 3%, что согласуется с данными литературы. В зависимости от использованных схем органосохраняющей терапии авторы сообщают о развитии лучевых циститов в те же сроки у 0,02 – 25% пациентов.
Источник
