Паравезикулярные блокады мочевого пузыря

Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.

Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения – основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря – это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры – это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций – у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Proe Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры – центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи – с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи – с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата – ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением – расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5-2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора – к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3-8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва
Источник
Главная / Полезная информация / Тазовые дисфункции и болевые синдромы в практике врача уролога / Урология-Сексология
В последнее время, особенно во франко- и испано-язычных медицинских кругах, значительно изменился подход к патогенезу, диагностике и лечению заболеваний органов малого таза.
Прежде всего, он стал комплексным или, как говорят в Европе, «мультимодальным», поскольку органы малого таза тесно связаны между собой, часто имеют общую эфферентную и эфферентную иннервацию, кровообращение, мышечно-связочный аппарат. Таким образом, поражение одного органа часто вовлекает в патологический процесс другие.
Как пример можно привести возникновение синдрома болезненного мочевого пузыря (не интерстициального цистита – это разные вещи, ниже будет объяснено, почему), у пациенток с аденомиозом или СРК.
Связано это с феноменом т.н. перекрестной сенсибилизации. Большинство тазовых органов получают сенсорную и моторную инервацию через n.pudendus. Кроме того, в некоторых случаях эти органы имеют представительство в одних и тех же, или соседних центрах головного мозга. Подробнее этот вопрос также будет рассмотрен ниже.
Во-вторых, все более преобладает точка зрения о снижении роли воспалительных заболеваний в патогенезе синдрома хронической тазовой боли. В настоящее время основную роль, по мнению французских коллег, играют миофасциальные (спастические) синдромы мышц тазового дна и нейропатия полового нерва, который неофициально называют king of perineum – «король промежности». В-третьих, изменилась терминология: все чаще вместо термина «синдром хронической тазовой боли» используют термин «синдром хронической промежностно-тазовой боли и дисфункции».
Мы надеемся, что на I Международном конгрессе по тазовым болям и дисфункциям, который состоится в Амстердаме, будет принята единая терминология.
В рамках настоящей статьи не представляется возможным рассмотреть все болевые синдромы и дисфункции органов малого таза, поэтому предлагаем обратить внимание на синдромы органов женского малого таза, имеющие отношение к практике уролога, то есть, на урогинекологические синдромы.
Болевые синдромы:
- синдром болезненного мочевого пузыря;
- нейропатия полового нерва;
- миофасциальные синдромы.
Нарушения накопительной и эвакуаторной функции мочевого пузыря:
- гиперактивный мочевой пузырь с детрузорной гиперактивностью;
- гиперактивный мочевой пузырь с повышенной чувствительностью мочевого пузыря;
- недержание мочи у женщин и мужчин при напряжении.
Что касается синдрома болезненного мочевого пузыря, то это, по мнению G. Amarenco, состояние, обусловленное как раз перекрестной сенсибилизацией мочевого пузыря, вследствие поражения соседних органов, например – толстой кишки (СРК) или матки при аденомиозе. В этом случае количество рецепторов С-волокон также увеличивается, происходит центральная сенсибилизация – но это следствие патологического процесса в другом органе. Патологические изменения в собственной пластинке уротелия могут вызвать повреждение зонтичных клеток, подобное ИЦ – но в этом случае оно будет вторично.
Клинический случай
Пациентка 38 лет, не рожавшая. Обратилась по поводу длительно существующей (3 года) дизурии, поллакиурии, ноктурии, болевого синдрома с локализацией в области уретры, иррадиацией в правую нижнюю конечность. Были проведены неоднократные курсы антибактериальной терапии по поводу U. urealitycum. Посевы мочи стерильны, общие анализы мочи – без изменений. Проведенная цистоскопия выявила визуальные признаки лейкоплакии в области треугольника Льето.
Патоморфологическое исследование: данных за лейкоплакию не выявлено.
Пациентке выполнена ТУР измененного участка в области треугольника Льето. После операции состояние несколько улучшилось, однако через месяц вернулось к ситуации, предшествовавшей вмешательству. На момент осмотра заполнение дневника мочеиспускания продемонстрировало 41 микцию в сутки, средний объем мочеиспускания – 37 мл.
Пациентка осмотрена совместно с профессором Э. Ботраном (L’Avancee Perinneal-Pain Clinic, Aixen-Provence).
Обследование выявило аденомиоз, повышение тонуса правой внутренней обтураторной мышцы, болезненность в триггерной точке m. obturatorius int.
По экспертному мнению профессора Ботрана, в данном случае имеет место синдром болезненного мочевого пузыря, вызванный перекрестной сенсибилизацией вследствие аденомиоза и отягощенный миофасциальной реакцией правой внутренней обтураторной мышцы. Кроме того, вследствие нейрогенного воспаления в lamina propria уротелия, вызванного перекрестной сенсибилизацией, у пациентки имеется повреждение уротелия.
Патогенез этого состояния может быть следующим. Аденомиоз, как и любое другое состояние, вызывающее хронический болевой синдром, приводит к снижению порога болевой чувствительности. Это хорошо продемонстрировано в эксперименте на крысах, названном pressure paw vocalization test.
Суть его в следующем: были взяты две группы крыс, у одной вызывался хронический болевой синдром введением химического реагента под кожу спины, другая группа оставалась интактна. Через месяц проводили тест, сдавливая специальным устройством крысам обеих групп лапку. Определялся порог вокализации, т.е. когда крысы начинали пищать. Так вот, до начала исследования порог у крыс обеих групп был одинаковый. Но через месяц, в группе крыс с хронической болью вокализация возникала при гораздо более слабом давлении на лапу, по сравнению с интактными крысами. Это представляется вполне логичным. Боль – сигнал о повреждении тканей. Если боль стала хронической, значит, головной мозг не предпринял действий, достаточных для ликвидации причины боли. Следовательно, необходимо снизить болевой порог, чтобы мотивировать ЦНС на более активные действия.
Следующий этап – периферическая сенсибилизация. В пораженном органе увеличивается продукция фактора роста нервов (ФРН, NGF). Это приводит к увеличению количества рецепторов, аффилированных с демиелинизированными С-волокнами. Основная роль С-волокон – передача хронических болевых импульсов. Соответственно, увеличение их количества приводит к усилению болевого синдрома в пораженном органе. Однако, как мы уже обсуждали, органы малого таза имеют перекрестную иннервацию и в данном случае, количество рецепторов к С-волокнам увеличивается не только в эндо- и миометрии, но и в уротелии.
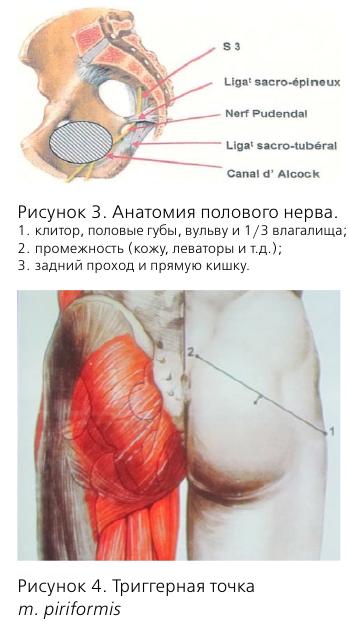
Кроме того, у этой пациентки диагностирована миофасциальная реакция m. obturatorius int. dext. Сокращение мышц – нормальная реакция на боль. Однако длительно существующая боль приводит к спастическим сокращениям, которые, в свою очередь, вызывают болевой синдром за счет накопления лактата в мышце и компрессии нервных волокон. Как пример, можно привести piriformis-syndrome, когда m. piriformis вызывает компрессию n. pudendus.
Возвращаясь к осмотренной пациентке – для лечения аденомиоза она была направлена к гинекологу. Кроме того, с целью терапии синдрома болезненного мочевого пузыря было рекомендовано:
- катадолон 200 мг – с целью купирования болевого синдрома и центральной сенсибилизации;
- прегабалин – 75 мг 2 раза в день с постепенным титрованием дозы – для ликвидации периферической сенсибилизации;
- инъекция 100 ЕД ботулинического токсина в правую обтураторную мышцу под электромиографическим (ЭМГ) контролем;
- внутрипузырный электрофорез 200 ЕД ботулинического токсина;
- внутрипузырное введение гиалуроната натрия (УРО-ГИАЛ) с целью восстановления уротелия.
Следует обратить внимание на эффективность, пусть и кратковременную, ТУР треугольника Льето. Как известно, основная афферентная иннервация мочевого пузыря локализована в области треугольника Льето – видимо ТУР временно вывела из строя окончания афферентных волокон.
Нейропатия полового нерва
Основным симптомом нейропатии полового нерва является боль в одной или более областях, иннервируемых n. pudendus или его ветвями.
Это области прямой кишки, заднего прохода, уретры, промежности и гениталий. Одним из типичных симптомов является усиление боли в положении сидя и прогрессирование в течение дня.
Причины нейропатии обсуждаются до сих пор, но наиболее известной является компрессия полового нерва в канале Алкока.
Другими причинами являются: piriformis-syndrome, повреждение полового нерва в процессе родов, травмы малого таза и злокачественные новообразования. Поэтому, при любых хронических тазовых болях желательно проведение МРТ.
Также активно обсуждается роль вируса герпеса – косвенным доказательством является эффективность ацикловира и валацикловира в некоторых случаях ПН.
Существуют т.н. Нантские критерии ПН, которые разработаны J.J. Labat, R. Robert, G. Amarenco. Выделено пять основных критериев:
- боль на территории, иннервируемой половым нервом;
- преимущественная боль в положении «сидя»;
- боль не вызывает нарушения сна (т.е. не заставляет пациента просыпаться ночью);
- боль не вызывает серьезных нарушений чувствительности;
- блокада полового нерва купирует болевой синдром.
Обычно пациенты описывают боль при ПН как нейропатическую, т.е. жжение, парестезии. Чаще всего боль локализуется с одной стороны. Весьма характерно ощущение инородного тела в прямой кишке.
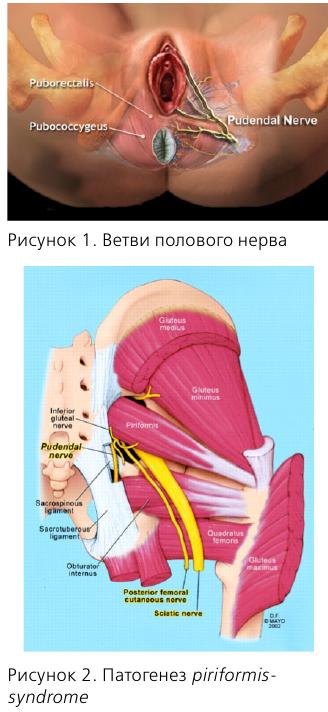
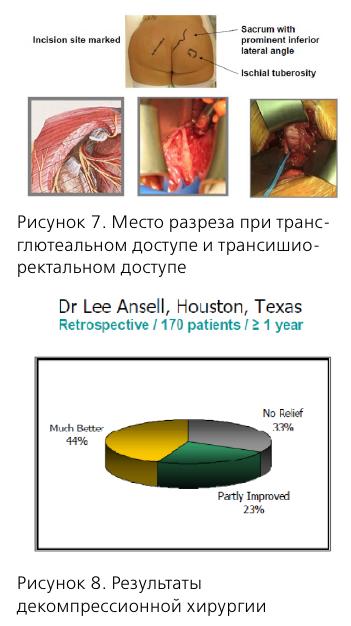
Несколько слов об анатомии n. pudendus. В составе полового нерва имеются как афферентные, так и эфферентные волокна, что обусловливает сенсорные и двигательные нарушения соответствующих органов.
Половой нерв входит в малый таз на уровне S2-S4, проходит через f. piriformis, затем через канал Алкока и делится на 3 ветви.
Предполагается, что дисфункция полового нерва может привести к симптомам гиперактивного мочевого пузыря преимущественно сенсорного генеза, за счет повышения количества С-волокон в мочевом пузыре, а также за счет перекрестной сенсибилизации, о которой мы уже упоминали, в органах, получающих ту же иннервацию по причине конвергенции сенсорных путей в малом тазу.
Диагностика ПН основана на указанных выше Нантских критериях, кроме того, необходимо пальпировать триггерные точки m. piriformis и m. obturatorius для диагностики миофасциальных синдромов.
В диагностике компрессии полового нерва в канале Алкока может помочь трансвагинальное УЗИ с оценкой кровотока в a. pudenda и v. pudenda, т.к. при компрессии нерва эти сосуды также сдавливаются и скорость кровотока на стороне поражения снижается.
Лечение нейропатии полового нерва

Медикаментозное лечение обычно включает прегабалин, начиная с 75 мг два раза в сутки с титровкой дозы до 600 мг/сутки. Для расслабления мышц используют вагинальные суппозитории с диазепамом, инъекции локальных анестетиков с глюкокортикоидами в заинтересованные мышцы. В случае положительного эффекта вводится ботулинический токсин под ЭМГ-контролем.
Для диагностики и лечения используется блокада полового нерва под ентгенологическим или УЗ-контролем. Обычно вводится 5 мл 0,5% бупивакаина с 80 мг триамци-нолона – 3 инъекции.
Хирургическое лечение проводится только при доказанной компрессии полового нерва, резистентной к медикаментозной терапии. Значительное улучшение достигается только в 44% случаев. Другие авторы сообщают о 62% эффективности (Э. Ботран), 70% (Р. Роберт).
Показания к декомпресии полового нерва, ее методика требуют дальнейшего обсуждения и изучения.
Миофасциальные синдромы малого таза
Миофасциальные синдромы или хроническая миофасциальная боль – это хронические болевые синдромы и дисфункции, вызванные хроническим спазмом мышечно-связочного аппарата малого таза.
Эти синдромы достаточно широко распространены, однако редко диагностируются в урологической практике. Например, Skootsky S. cообщает о 30% пациентов с хронической тазовой болью, у которых были диагностированы миофасциальные синдромы в специализированных клиниках по лечению болевых синдромов, при этом Bartoletti R. опубликовал данные о 5540 пациентах, страдающих СХТБ, обследованных в 28 итальянских урологических клиниках – миофасциальные синдромы выявлены только в 13,8% случаев.
Следовательно, необходимо более тщательно обследовать пациентов с хроническим циститом, хроническим простатитом, уретритом и т.д. с целью выявления нейропатических и миофасциальных синдромов.
Виды иофасциальных синдромов малого таза:
- синдром леватора;
- синдром внутренней обтураторной мышцы;
- piriformis-синдром;
- бульбокавернозный синдром.
Синдром леватора
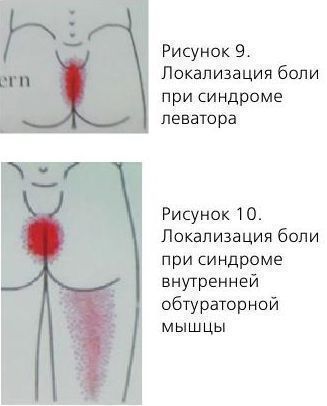
Локализация боли:
- боль в аноректальной области;
- боль во влагалище;
- боль в гипогастрии;
- поллакиурия и императивные позывы на микцию;
- усиление боли в положении сидя.
По данным J. Rigaud этот синдром встречается в 100% случаев у пациентов с СХТБ обоих полов.
Синдром внутренней обтураторной мышцы:
- чувство инородного тела в прямой кишке;
- боль в уретре;
- боль в области вульвы.
Piriformis-синдром:
- боль в пояснице;
- боль в промежности;
- диспареуния;
- эректильная дисфункция;
- боль в ягодице и тазобедренном суставе;
- боль при дефекации.
Бульбокавернозный синдром:
- боль в промежности;
- диспареуния;
- синдром сексуального возбуждения без сексуальной стимуляции;
- эректильная дисфункция;
- боль у основания пениса.
Лечение:
- анальгетики (катадолон);
- габапентины;
- бензодиазепины (если возможно – вагинальные суппозитории);
- антидепрессанты (тразодон);
- чрескожная электростимуляция (TENS);
- инъекции анестетиков и глюкокортикоидов в вовлеченные мышцы (наропин 0,5% + дипроспан);
- инъекции ботулинического токсина под ЭМГ-контролем (Porta M.A, Grabovskiy C.);
- сакральная нейромодуляция.
Гиперактивный мочевой пузырь с детрузорной гиперактивностью
Об этом виде ГАМПа написано достаточно, разработаны эффективные методы диагностики и лечения.
Препаратами выбора являются М-холинолитики, однако достаточно часто встречаются случаи недостаточной эффективности этих препаратов. Возможно, это обусловлено сочетанием ГАМП с ДО и ГАМП с повышенной чувствительностью мочевого пузыря, который будет рассмотрен ниже.
Гиперактивный мочевой пузырь с повышенной чувствительностью мочевого пузыря
Клинически этот вид ГАМП (который иногда называют «ГАМП без ГАМП») проявляется частым или даже постоянным ощущением позыва на мочеиспускание, но без императивных позывов и эпизодов ургентного недержания мочи у мужчин, как и у женщин. М-холинолитики, как правило, неэффективны.
Уродинамические проявления:
- снижение объема первого ощущения наполнения мочевого пузыря;
- снижение объема первого позыва на мочеиспускание;
- снижение максимальной цистометрической емкости;
- отсутствие детрузорной гиперактивности и эпизодов недержания мочи;
- положительный тест с холодной водой;
- положительный тест с лидокаином.
Этиология:
- нейропатия полового нерва;
- миофасциальные синдромы;
- перекрестная сенсибилизация уротелия при аденомиозе, СРК, ад-ексите;
- повреждение GAG-слоя уротелия.
Патогенез
Так же, как и при синдроме болезненного мочевого пузыря, происходит увеличение количества С-волокон и аффилированных с ними рецепторов. Причем иногда клинические и уродинамические проявления обоих состояний идентичны. Возможно, это различные по степени выраженности проявления одного и того же процесса.
Также большую роль играет центральная сенсибилизация. Именно поэтому эффективно применение тибиальной нейромодуляции – тибиальный нерв и половой нерв имеют одно и то же представительство в ЦНС.
Лечение:
- прегабалин;
- внутрипузырное применение анестетиков, оксибутинина;
- внутрипузырный электрофорез анестетиков, глюкокортикоидов, ботулинического токсина;
- внутрипузырное применение ванилоидов (резинифератоксина, капсаицина);
- чрескожная электростимуляция (TENS) с размещением электродов на уровне S2-S4, (например, Neurotrack Pelvitone, режим 10 Гц, 200 мс, 30 – 40 минут в день);
- сакральная нейромодуляция;
- тибиальная нейромодуляция;
- лечение нейропатии полового нерва и миофасциальных синдромов;
- лазерная или электроабляция треугольника Льето (А.И. Неймарк, В. Гомберг);
- гидробужирование мочевого пузыря.
Недержание мочи при напряжении (Стрессовая инконтиненция)
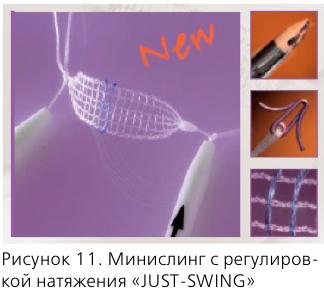
Патология и лечение недержания мочи заслуживает рассмотрения в отдельной статье, поэтому мы коснемся только ее взаимосвязи с тазовыми дисфункциями и болевыми синдромами.
Речь идет об осложнениях имплантации синтетических слингов трансобтураторным доступом. Достаточно часто (2-8%) после этой процедуры возникает болевой синдром, связанный с проведением и персистенцией импланта в обтураторной мышце, с компрессией веток обтураторного нерва и возникновением миофасциального обтураторного синдрома. Иногда, кроме болевого синдрома, возникает симптоматика ГАМП, которая весьма трудно купируется.
Возможным решением проблемы представляется использование новых видов слингов:
- минислингов нового поколения (“JUST-SWING”) – они фиксируются титановым якорем в обтураторной мембране, не вовлекая мышцу;
- биодеградирующих мини-слингов (например, матрица из полимолочной кислоты, полученная технологией электроспиннинга), импрегнированных факторами роста фибробластов.
Для терапии болевых синдромов после TVT-O хирургии возможно использование инъекций в обтураторную мышцу смесей из анестетиков и глюкокортикоидов. При неэффективности – удаление импланта.
Заключение
Диагностика и лечение тазовых болевых синдромов и дисфункций представляется весьма актуальным и перспективным направлением в урологии. Активное внедрение современного подхода к тактике ведения пациентов с такими синдромами позволит улучшить качество оказания медицинской помощи и снизить затраты на лечение.
Следует также рассмотреть возможность организации специализированных кабинетов или отделений в составе ведущих урологических лечебных учреждений.
И.А. Аполихина, Я.Б. Миркин, Д.А. Бедретдинова, И.А. Эйзенах, О.Ю.Малинина.
Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова, НИИ урологии Минздравсоцразвития РФ, Москва, NMTC International, ООО «Новые Медицин
