Папилломавирусная инфекция и рак мочевого пузыря

Доброкачественные новообразования (папилломы) мочевого пузыря занимают около 1% от всех заболеваний данной локализации. Длительное время они могут никак не проявлять себя клинически. В редких случаях приводят к нарушению мочеиспускания и изменению нормального состава мочи. Несмотря на невысокую распространенность и отсутствие симптоматики со стороны мочевыводящих путей, папилломатозные выросты могут представлять серьёзную опасность из-за имеющегося риска трансформации в злокачественную опухоль.
Онкогенный потенциал папиллом различен и зависит от множества внешних и внутренних факторов. Правильная тактика заключается в обязательном удалении обнаруженных во время обследования доброкачественных новообразований мочевого пузыря и последующем проведении профилактических осмотров пациента.
Общая информация
Нормальная слизистая оболочка мочевого пузыря покрыта многослойным эпителием из плоских клеток. Количество слоев может быть от 3 до 6. Поверхностно расположенные клетки являются крупными и секретируют большое количество муцина, подобно железистому эпителию. Такие особенности слизистого покрова мочевого пузыря привели к появлению терминов «переходный эпителий» или «уротелий» в отношении эпителиальной выстилки органа.
Папиллома по своему строению представляет собой вырост на слизистой оболочке мочевого пузыря, исходящий из клеток эпителиального слоя. Она может иметь различную форму, но чаще всего представлена одиночным узловым образованием, расположенным на широком основании или тонкой ножке, идущей к поверхности слизистой. Сверху доброкачественное новообразование покрыто нормальным уротелием.
Все папилломатозные выросты относят к доброкачественным новообразованиям, имеющим онкогенный потенциал различной степени. Риск трансформации в злокачественную опухоль зависит от множества факторов: длительное воздействие неблагоприятных факторов (канцерогены химического происхождения, ионизирующее излучение), нарушение уродинамики, хронические воспалительные процессы в стенке пузыря и некоторые другие. При этом в эпителиальном слое происходят изменения, приводящие к нарушению нормального клеточного и тканевого состава – атипия и дисплазия. Выраженность этих процессов напрямую влияет на риск злокачественной трансформации.
Причины
Точные причины появления папиллом мочевого пузыря остаются неизвестными, однако существуют факторы риска, которые увеличивают вероятность развития заболевания. К ним относятся:
- престарелый и старческий возраст;
- снижение местного иммунитета слизистой оболочки;
- хронические воспалительные заболевания мочеполовой системы;
- нарушение пассажа мочи;
- врожденные и приобретенные иммунодефицитные состояния.
В последнее время активно изучается влияние цитопатогенных вирусов на слизистую оболочку мочевого пузыря: папилломавирусная инфекция, вирусы простого герпеса, цитомегаловирусная инфекция, вирус Эпштейна-Барр. Присутствие данных возбудителей в организме длительное время остается незамеченным, они выявляют себя при стойком снижении иммунной сопротивляемости организма, одним из проявлений которых может являться усиление тканевой пролиферации и рост новообразований.
Виды
В подавляющем большинстве случаев доброкачественные эпителиальные выросты представлены двумя типами: переходно-клеточным и плоскоклеточным. Переходно-клеточная (уротелиальная) папиллома составляет до 4% от всех новообразований мочевого пузыря. Она представляет собой сосочковое разрастание с рыхлой соединительной тканью, внутри которой имеются мельчайшие кровеносные сосуды. Покрыто новообразование уротелием, выстилающим поверхность всего органа изнутри. Встречается уротелиальная папиллома у пациентов старше 50 лет. Она имеет крайне низкий риск рецидива и озлокачествления. Новообразование чаще всего представлено изолированными эпителиальными выростами на тонкой ножке или широком плоском основании, но может иметь и диффузный (рассыпной) характер расположения.
Один из ее морфологических вариантов – папиллома погружного типа. Она обладает теми же гистологическими характеристиками, но располагается иначе. Рост новообразования происходит преимущественно в толщу слизистой оболочки. Таким образом, основная часть папилломы глубоко прорастает в стенку мочевого пузыря, а в просвете органа расположен лишь небольшой экзофитный компонент. Встречается папиллома погружного типа менее, чем в 1% случаев и обычно наблюдается у пациентов старше 65-70 лет. Она характеризуется медленным ростом и доброкачественным клиническим течением, редко подвергается злокачественной трансформации. Большинство таких новообразований одиночные, локализуются в области шейки или треугольника Льето мочевого пузыря.
Плоскоклеточная папиллома – новообразование, в отношении которого до сих пор имеется множество разногласий со стороны клиницистов и исследователей. В ряде случаев доброкачественный эпителиальный вырост имеет высокий онкогенный потенциал. Истинная доброкачественная плоскоклеточная папиллома встречается в 2-3% случаев. Она имеет вид одиночной нежной ворсины, выступающей в просвет пузыря. Покрыт вырост неизмененным уротелием, который содержит не более 6 слоев клеток. О высоком риске злокачественной трансформации говорят в том случае, когда увеличивается количество слоев в эпителиальном пласте и появляется клеточная атипия.
Возможные симптомы
Единичные и небольшие полипы могут никак не проявлять себя клинически и длительное время растут в просвет мочевого пузыря. В некоторых случаях возможно появление дизурического синдрома – комплекса симптомов, связанного с нарушением мочеиспускания. К ним относятся:
- субъективный дискомфорт во время и после мочеиспускания;
- ощущение неполного опорожнения мочевого пузыря;
- рези при мочеиспускании.
Большие папилломы погружного типа могут стать причиной гематурии – появления крови в моче. Как правило, наблюдается микрогематурия (выявляется только лабораторно по наличию эритроцитов в моче), но иногда встречается и макрогематурия – примесь крови, определяемая визуально. Моча при этом имеет багрово-алый оттенок.
Диагностика и лечение
Из-за скудной клинической симптоматики доброкачественные новообразования часто становятся случайной диагностической находкой. Лишь небольшая часть пациентов проходит обследование в связи с появлением дизурии или гематурии. Основное исследование, позволяющее выявить папилломатозные выросты – цистоскопия. Метод подразумевает осмотр слизистой выстилки мочевого пузыря при помощи эндоскопического оборудования (оптическая система и источник света). При выявлении папилломы врач определяет ее локализацию, размеры, тип основания, поверхность выстилки. На этом этапе эндоскопист может лишь предположить вид папилломы исходя из своего клинического опыта. Для достоверного определения клеточного и тканевого строения необходимо провести забор биопсийного материала и отправить его на гистологическое исследование. Врач-патоморфолог детально изучает тонкие срезы папилломы под микроскопом и выносит окончательное заключение.
Как правило, в клинической практике диагностическая цистоскопия сразу же переходит в лечебную – обнаруженное новообразование удаляется, а в месте повреждения слизистой оболочки проводится эндоскопический гемостаз (профилактика кровотечения). Полученный папилломатозный вырост сразу отправляется на гистологическое исследование.
Вспомогательную роль в диагностике играют контрастные рентгенологические исследования и УЗИ мочевыводящих путей, методы компьютерной и магнитно-резонансной томографии. В обязательный минимум обследования входят анализы крови и мочи, при необходимости лечащий врач может назначить мазки из уретры и влагалища, а также расширенные исследования мочи (по Каковскому-Аддису, Нечипоренко, посев на микрофлору и другие).
Дальнейшая тактика
Цистоскопия – амбулаторная манипуляция, поэтому пациент может в тот же день вернуться к привычному образу жизни. В течение 1-3 дней после эндоскопического исследования возможно учащение мочеиспускания и появление неприятных ощущений в виде резей. Это связано с непосредственной травматизацией чувствительной слизистой оболочки уретры и мочевого пузыря во время процедуры. Слизистые покровы обладают высокой регенераторной способностью и быстро заживают самостоятельно. В течение первых суток после удаления полипов возможно появление незначительной примеси крови в моче или слизисто-кровянистого отделяемого из уретры.
После полипэктомии пациенту рекомендуется планово проходить медицинское обследование. Его кратность определяется лечащим врачом. Как правило, после цистоскопии врач назначает пациенту контрольное исследование крови и мочи. Через 6-12 месяцев следует пройти повторное эндоскопическое исследование, чтобы исключить рецидивы и оценить состояние слизистой мочевого пузыря.
Источник
ˡ Кафедра урологии и хирургической андрологии РМАНПО (зав. каф. – академик РАН, д.м.н., проф. О. Б. Лоран), Москва, Россия; 2 урологическое отделение и 3патологоанатомическое отделение ГБУЗ ГКБ № 68 ДЗМ
(гл. врач – д.м.н., проф. С. Н. Переходов), Москва, Россия; 4 Коми республиканский онкологический диспансер (КРОД) (гл. врач – А. Н. Соколов), Сыктывкар, Россия; 5 Вологодская областная клиническая больница № 2 (ВОКБ № 2)
(гл. врач – д.м.н. А. Г. Пулин), г. Череповец, Россия
Цель: определить роль вируса папилломы человека (ВПЧ) высокого онкогенного риска в развитии рака мочевого пузыря.
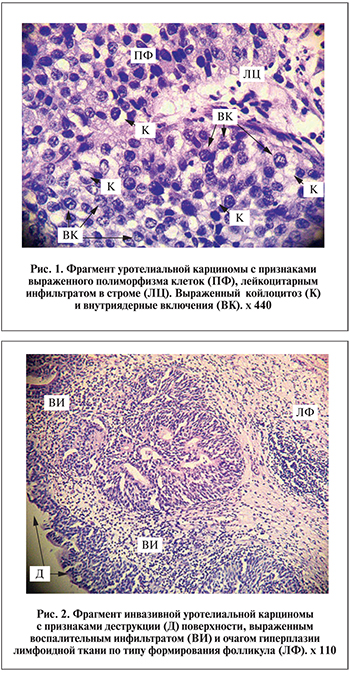
Материалы и методы. Проведено обследование и лечение 100 пациентов (72 мужчины и 28 женщин) в возрасте от 38 до 90 лет (средний возраст – 65±10 лет) c диагнозом «рак мочевого пузыря». Дополнительно выполнены иммуноферментные анализы крови на наличие противовирусных антител к вирусу простого герпеса (ВПГ) 1-го и 2-го типов, цитомегаловирусу (ЦМВ), вирусу Эпштейна-Барр (ВЭБ); соскоб из уретры для выявления ВПЧ высокого онкогенного риска. Осуществляли забор ткани опухоли с целью выявления вышеуказанных вирусов методом ПЦР. Полуколичественно оценивали составляющие лимфоцитарно-плазмоцитарного и лейкоцитарного инфильтратов, цитопатические изменения опухолевой ткани.
Результаты. Были выявлены прямые коррелятивные связи между цитопатическими изменениями клеток (койлоцитозом и внутриядерными включениями как проявлениями ВПЧ) и уровнем противовирусных антител, наличием вирусов в опухоли, а также составляющими лимфоидно-плазмоцитарного инфильтрата. И обратные – между наличием папилломатоза и вышеуказанными изменениями.
Заключение. Вирус папилломы человека рассматривается как триггер возникновения опухоли у пациентов молодого возраста на фоне латентной инфекции (ЦМВ и ВЭБ, ВПГ, ВПЧ). Цитопатические изменения (койлоцитоз и внутриядерные включения) были ассоциированы с активностью и морфологическими признаками герпес-вирусных инфекций. Их степень варьировалась в зависимости от стадии процесса, но не от степени анаплазии. Папилломатоз ассоциирован с более благоприятным течением опухолевого процесса.
Введение. В настоящее время этиологическая роль высокоонкогенных типов вируса папилломы человека (ВПЧ) при плоскоклеточном раке шейки матки и верхних дыхательных путей считается доказанной. Вместе с тем появились публикации, указывающие на влияние ВПЧ на возникновение РМП, однако данные их весьма противоречивы [1-3]. Что касается ВПЧ высокого онкогенного риска, то все больше исследователей склоняются к причастности вируса к развитию рецидивных форм РМП [2] и появлению инвазивных и низкодифференцированных его форм [4]. Кроме того, Д. А. Головина и соавт. [5] указывают на изменения уротелия вокруг опухоли (микроокружения) вирусом папилломы человека и вовлечение нормального эпителия в онкопроцесс с развитием рецидивных форм опухоли уже в отсутствие вируса [5]. T. Griffiths и соавт. [6] сделали вывод, согласно которому вирус играет определенную роль в канцерогенезе у иммунокомпрометированных пациентов, тогда как у пациентов с нормальным уровнем иммунной защиты ВПЧ в развитии уротелиальной опухоли мочевого пузыря роли не играет [6].
Цель исследования: определить роль ВПЧ высокого онкогенного риска в развитии РМП.
Материалы и методы. Проведено обследование и лечение 100 больных (72 мужчины и 28 женщин) в возрасте от 38 до 90 лет (средний возраст – 65±10 лет), поступивших в стационар с направительным диагнозом «рак мочевого пузыря». Дополнительно к общепринятым методам обследования взяты анализы крови на IgG, M к вирусу простого герпеса (ВПГ) 1-го и 2-го типов (ВПГ-1 и ВПГ-2), цитомегаловирусу (ЦМВ), вирусу Эпштейна-Барр (ВЭБ). Ткань опухоли и моча взяты на ПЦР-диагностику с целью выявления вирусов ВПГ-1 и ВПГ-2, ВПЧ высокого онкогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68), ЦМВ, ВЭБ. Было исследовано и проанализировано 100 гистологических случаев с эпителиальными злокачественными образованиями мочевого пузыря. Операционный и биопсийный материалы фиксировались в 10%-ном растворе формалина, использовался метод спиртовой проводки с последующей заливкой в парафин. В микропрепаратах, представляющих собой парафиновые срезы, окрашенные гематоксилин-эозином, оценивалась степень анаплазии и мышечной инвазии.
Семидесяти больным была проведена оценка воспалительной инфильтрации в опухолевой ткани и подлежащей строме.

Полуколичественно от 0 до 3 баллов (отсутствие, слабая, умеренная и выраженная степени) оценивались следующие признаки:
- Лимфоцитарно-плазмоцитарный инфильтрат: а) в опухоли, б) рассеянный в подлежащей строме, в) периваскулярная инфильтрация, г) очаговая гиперплазия лимфоидной ткани в виде лимфоидных фолликулов.
- Активность воспаления: а) степень лейкоцитарного инфильтрата, б) степень эозинофильной инфильтрации.
- Цитопатические изменения: а) внутриклеточные включения (койлоцитоз), б) внутриядерные включения.
 В работе использованы общепринятые методы статистической обработки данных – все числовые показатели проверялись на соответствие нормальному закону распределения с помощью критерия Лиллиефорса, определены средние значения (M), стандартное отклонение (SD), ошибка среднего (m), в работе данные представлены как M±m, 95% доверительный интервал, частоты (%). Различия между количественными показателями осуществлялись с помощью t-критерия Стьюдента для независимых выборок или непараметрического U-критерия Манна-Уитни. Различия между частотой признаков находились с помощью критерия χ2, точного критерия Фишера. Для малых выборок, для случаев частоты, равной 0% или 100%, использовался t-критерий Стьюдента для частот с поправкой на концевые точки. Для определения связи между изучаемыми параметрами применен корреляционный анализ Пирсона (r) или Спирмена (R). Статистически значимыми принимались различия при p
В работе использованы общепринятые методы статистической обработки данных – все числовые показатели проверялись на соответствие нормальному закону распределения с помощью критерия Лиллиефорса, определены средние значения (M), стандартное отклонение (SD), ошибка среднего (m), в работе данные представлены как M±m, 95% доверительный интервал, частоты (%). Различия между количественными показателями осуществлялись с помощью t-критерия Стьюдента для независимых выборок или непараметрического U-критерия Манна-Уитни. Различия между частотой признаков находились с помощью критерия χ2, точного критерия Фишера. Для малых выборок, для случаев частоты, равной 0% или 100%, использовался t-критерий Стьюдента для частот с поправкой на концевые точки. Для определения связи между изучаемыми параметрами применен корреляционный анализ Пирсона (r) или Спирмена (R). Статистически значимыми принимались различия при p
Результаты. Стадия процесса соответствовала T1NxM0 для 51 больного, в 1 случае имела место папиллома мочевого пузыря, T2NxM0 у 25 больных, в 23% случаев выявлен местнораспространенный процесс. У 7 пациентов диагностировано лимфогенное метастазирование. Трансуретральная резекция стенки мочевого пузыря с опухолью выполнена 70 больным, радикальная цистэктомия с формированием гетеротопического резервуара (уретерокутанеостомией в двух случаях и в ряде случаев с сигмостомией) – 16, резекция мочевого пузыря – 14 пациентам. Опухоль была рецидивой для 24 пациентов.
Вирусные ДНК в опухолевой ткани были выявлены у 34 пациентов (21 мужчина и 13 женщин). Инфицирование ткани ВЭБ имело место в 27 случаях, ЦМВ – в 6, ВПЧ высокого онкогенного риска (16, 39, 45, 52, 59) – в 5, ВПГ-1 и ВПГ-2 – в 1. В 4 наблюдениях выявлена ДНК нескольких вирусов: ВПЧ+ВЭБ (1), ВЭБ+ЦМВ (2), ЦМВ+ВЭБ+ВПЧ (1). Опухоли являлись низкодифференцированными в 56% случаев.
Результаты морфологического исследования образцов тканей представлены в табл. 1. По степени анаплазии пациенты распределились следующим образом: уротелиальная карцинома высокой степени злокачественност…
О.Б. Лоран, Л.А. Синякова, Л.В. Гундорова, В.А. Косов, И.В. Косова, И.Е. Погодина, Д.Н. Колбасов
Источник
В настоящее время обсуждается вопрос об этиологической роли инфекционных агентов, в частности, вирусов в генезе развития опухолей мочевого пузыря, их влиянии на частоту рецидивирования и развития инвазивных и метастатических его форм. В литературе есть указания на онкомодулирующий эффект цитомегаловируса (CMV) при глиобластомах, опухолях кишечника [1]. Этиологическая роль высокоонкогенных типов вируса папилломы человека (HPV) при плоскоклеточном раке шейки матки и верхних дыхательных путей считается доказанной. Вместе с тем появились публикации, свидетельствующие о влиянии HPV на возникновение рака мочевого пузыря, инвазивность процесса и его метастатический характер [2-6].
МАТЕРИАЛЫ И МЕТОДЫ
Проведено обследование и лечение 54 больных (44 мужчин и 10 женщин) в возрасте от 38 до 90 лет (средний возраст 64,6±9,93), поступивших в урологическое отделение ГКБ №68 и урологическое отделение КРОД в большинстве случаев в экстренном порядке в связи с макрогематурией. Всем пациентам выполнены сл. исследования: общий анализ крови, мочи, ультразвуковое исследование (УЗИ) почек, мочевого пузыря, анализ крови на IgG, IgM к герпесу (HSV) I и II типа, цитомегаловирусу (CMV), вирусу Эпштейна- Барр (EBV), ПЦР мочи к вышеуказанным вирусам, соскоб из уретры на выявление вируса папилломы человека высокого онкогенного риска, магнитно-резонансная томография (МРТ) по показаниям, рентгенография органов грудной клетки. В работе использовались общепринятые методы статистической обработки данных – все числовые показатели проверялись на соответствие нормальному закону распределения с помощью критерия Лиллиефорса, определялись средние значения (M), стандартное отклонение (SD), ошибка средней (m), 95% доверительный интервал, частоты (%). В работе использовались М±m. Различия между количественными показателями осуществлялась с помощью t-критерия Стьюдента для независимых выборок или непараметрического U-критерия Манна-Уитни. Различия между частотой признаков находились с помощью критерия Хи-квадрат, точного критерия Фишера для малых выборок, для случаев частоты равной 0% или 100% использовался t-критерий Стьюдента для частот с поправкой на концевые точки. Для определения связи между изучаемыми параметрами применяли корреляционный анализ Пирсона (r) или Спирмена (R). Статистически значимыми принимались различия при p< 0,05.
РЕЗУЛЬТАТЫ
У 53 больных был диагностирован рак мочевого пузыря, в одном случае выявлена папиллома мочевого пузыря. Стадия опухолевого процесса соответствовала T1NxM0 в 61% случаев (33 больных), T2NxM0 в 22,2% (12 больных), в 14,8% случаях имел место местно-распространенный процесс. Примерно в половине случаев (у 28 больных) выявлено множественное поражение мочевого пузыря, в остальных – единичные опухолевые образования. Трансуретральная резекция стенки мочевого пузыря с опухолью выполнена 45 больным (83,3%), одному больному (1,8%) произведена эвисцерация таза с выведением уретерокутанеостом и одноствольной колостомы, 4-м больным (7,4%) – радикальная цистэктомия с формированием резервуара по Бриккеру, 4-м пациентам (7,4%) – открытая резекция мочевого пузыря. При патоморфологическом исследовании уротелиальный рак с высокой степенью злокачественности явлен в 72,2% случаев (39 больных), в 25,9% (14 больных) – рак с низким потенциалом злокачественности, в одном случае (1,8%) – папиллома. Опухоль была рецидивная у 15 пациентов (27,8%).
Семейство герпесвирусов (Herpesviridaeгреч. herpesползучий) объединяет пантропность к органам и тканям, пожизненную персистентность и способность вызывать многообразные манифестные формы заболевания. Оно насчитывает около 100 вирусов, 8 из которых вызывают заболевания у человека. Вирус простого герпеса относится к αгерпесвирусам и является вирусом I типа, генитальный герпес относится к α-герпес вирусам II типа, цитомегаловирус человека является вирусом 5 типа (β -герпесвирус), который длительное время может персистировать в организме человека [7].
По результатам нашего исследования антитела класса иммуноглобулинов М (IgM) к CMV не были выявлены ни у одного пациента.
Уровни антител класса IgG к CMV представлены на рисунке 1. Как видно из рисунка, у пациентов с высокодифференцированным, первично выявленным, не мышечно-инвазивным уротелиальным раком мочевого пузыря уровень IgG-антител был практически в два раза ниже, чем у больных с низкодифференцированным (p=0,2), рецидивным (p=0,02), местно-распространенным процессом (p=0,0014). Различий между уровнем анти-CMV IgG у пациентов с единичными или множественными опухолями мочевого пузыря не выявлено. Отмечается высокая корреляция между уровнем anti-CMV IgG и стадией процесса, рецидивным характером опухоли и уровнем антител к ранним антигенам EBV. Что касается выявления антител к HSV I и II типа, то белки острой фазы были выявлены только у одного пациента. Значимых изменений между уровнем IgG к HSV I и II типов и стадией процесса, степенью анаплазии и рецидивным характером опухоли выявлено не было (рис. 2). Высокий уровень антител IgG (более 30 инд. поз.) был выявлен у 5 больных с первичной уротелиальной опухолью, при этом у 4-х больных опухоль была высокой степени злокачественности, в трех случаях имело место множественное поражение мочевого пузыря. H. Abol-Enein в своей работе указывает на вторичное инфицирование опухолевых клеток HSV, так как этот процесс происходит легче, чем контаминация вирусом нормального уротелия [8].

Рис. 1. Уровни анти-CMV IgG-антител у больных раком мочевого пузыря

Рис. 2. Уровни антител IgG к HSV I и II типа в зависимости от степени анаплазии, стадии процесса и рецидивного характера опухоли
В нашем исследовании мы обнаружили ДНК EBV в опухоли у 9 больных, в двух случаях имело место инфицирование опухоли CMV, у двух больных выявлен HPV высокого онкогенного риска (16, 45, 52, 59 типы), у одного пациента имело место сочетанная инфекция – EBV и HPV (рис. 3). Следует сразу оговориться, что в большинстве случаев больным выполнялась ТУР стенки мочевого пузыря. При небольших размерах опухоли возможна недостаточная для определения концентрация ДНК вируса в материале, вследствие чего даже при наличии высоких уровней антител ДНК вируса в опухоли не выделялось.

Рис. 3. Частота выявления ДНК вирусов в опухоли мочевого пузыря

Рис. 4. Кореляционные соотношения между уровнем антител и наличием ДНК вирусов в опухоли
При наличии ДНК CMV и HPV высокого онкогенного риска в опухоли по степени анаплазии опухоль была высокой степени злокачественности. В первом случае имел место местнораспространенный процесс (равно как и при сочетанной HPV+EBV инфекции), во втором – не мышечно-инвазивный рак. ДНК вирусов простого герпеса I или II типов не было выявлено ни в одном случае.
Корреляционные закономерности уровня антител к CMV, HSV I и II типов, наличия HPV высокого онкогенного риска в опухоли представлены на рисунке 4. Корреляции между степенью анаплазии, стадией процесса, характером опухоли и уровнем антител к герпес-вирусу I и II типа выявлено не было. Некоторые различия оказались статистически недостоверными из-за небольшого количества больных, включенных в исследование, и неравномерности их распределения по группам.
ОБСУЖДЕНИЕ
Заболевания, обусловленные вирусом семейства Herpesviridae, называются герпесвирусными инфекциями, которые характеризуются поражением кожи, слизистых оболочек, нервной системы, глаз, внутренних органов, мочеполовой системы [7]. Это самые распространенные и малоконтролируемые заболевания [9]. После внедрения вирусы герпеса персистируют в организме человека пожизненно в виде латентной инфекции и могут под влиянием ослабляющих факторов (грипп, СПИД, др. заболевания) реактивироваться с образованием новых вирусов, вызывая клинически выраженные формы с развитием вторичной иммунологической недостаточности [7]. Все патогенные герпесвирусы во время вирусемии воспроизводятся в лейкоцитах крови, что является важным патогенетическим фактором развития иммунодефицитных состояний [10].
Следует отметить возможную роль HSV II типа (совместно с вирусами папилломы человека, CMV, хламидиями и микоплазмами) в развитии неопластических процессов у человека, в частности, рака шейки матки, рака предстательной железы [11-13]. Считается, что в этом случае этот вирус может выступать в качестве кофактора канцерогенеза, инициируя развитие дисплазии и поддерживая ее в состоянии стабилизации. Однако мы не получили каких-либо данных, свидетельствующих о роли HSV I или II типов в онкогенезе рака мочевого пузыря. Кроме того, в настоящее время ведутся исследования по использованию мутантных штаммов HSV для проведения онколитической терапии [14, 15].
Роль HPV в развитии рака мочевого пузыря исследовалась различными авторами. Частота выявления вируса в опухолевых клетках варьировала от 2% [16,17] до 35% [18]. J. Griffiths и T. Mellon сделали вывод о том, что вирус играет определенную роль в канцерогенезе у иммунокомпроментированных пациентов, тогда как у пациентов с нормальным уровнем иммунной защиты HPV в развитии уротелиальной опухоли мочевого пузыря роли не играет [19]. По данным группы российских авторов, при сравнении групп “HPV-положительных” и “HPVотрицательных” больных выявлено, что HPV-положительный рак мочевого пузыря характеризуется более высокой степенью анаплазии клеток, чем HPV-отрицательный, при этом первичный рак бывает чаще HPVположительным, чем рецидивный. Пол, возраст и инвазия в мышечный слой не коррелируют с HPV-положительностью рака мочевого пузыря [20]. ДНК HPV 16 типа чаще обнаруживается в первичном раке мочевого пузыря, чем в рецидивном. Авторы предполагают, что HPV 16 типа нередко оказывается вовлечен в процесс инициации рака мочевого пузыря. HPV-положительные клетки опухоли до того, как в ходе лечения их удается удалить, влияют на микроокружение опухоли, что способноствует ускорению развития рецидива из клеток условно-нормального уротелия, прилегавшего к удаленной впоследствии опухоли. Воздействие на микроокружение HPV-положительного рака мочевого пузыря в дополнение к воздействию непосредственно на опухоль может стать эффективным способом помощи таким больным подобные разработки уже ведутся применительно к раку шейки матки [21]. В нашей работе HPV высокого онкогенного риска встретился только у двух больных с низкодифференцированной опухолью (в одном случае опухоль была рецидивная, в одном первичная), поэтому делать какиелибо выводы преждевременно.
На фоне CMV может развиваться инфицирование другими видами вирусов или бактериями, т.е. суперинфекция. Доказано, что CMV инфицирует В-клетки, латентно инфицированные EBV, более эффективно, чем EBV-негативные [22]. Инфицирование вирусом герпеса человека 6-го типа EBV-позитивных клеточных линий может индуцировать литический репликативный цикл EBV. Вирус HSV6 также индуцирует экспрессию CD4-молекулы на CD3+ CD4-CD8+. Другим примером может быть усиленная экспрессия РНК HPV Е6 и Е7, что было показано в HPV-6-инфицированных, HPVтрансформированных эпителиальных клетках цервикального канала [23]. Подобный сценарий мы наблюдаем, рассматривая наличие высоких коррелятивных связей между наличием различных вирусов в уротелиальной опухоли и их титров у пациентов с разной степенью анаплазии опухоли, стадией процесса и рецидивным характером. Такое взаимовлияние также наблюдается между вирусами одного вида.
M. Michaeles и соавт. считают, что CMV может инфицировать опухолевые клетки (не являясь онкогенным вирусом) и модулировать свойства опухоли в сторону появления инвазивных свойств и способности ее к метастазированию, тем самым оказывая онкомодулирующий эффект [1]. Для оказания такого действия необходима длительная персистенция вируса в организме. При этом CMV не способен инициировать подобные изменения в неопухолевых клетках. Высокие титры анти-CMV IgG-антител у больных раком мочевого пузыря, особенно рецидивным, свидетельствуют о длительной персистенции этого вируса и периодической его активации.
ЗАКЛЮЧЕНИЕ
В нашем исследовании у больных с рецидивным течением, высоким потенциалом злокачественности и местнораспространенным процессом уровень анти-CMV IgG-антител был выше, чем у больных с неинвазивным первичным раком мочевого пузыря низкого потенциала злокачественности. Титр анти-CMV IgG-антител коррелировал с повышенным уровнем антител других вирусов, наличием CMV и других вирусов в опухоли, стадией процесса, рецидивным ее характером, что, по всей видимости, свидетельствует о потенцировании онкогенного действия одних вирусов и онкомодуляции другими вирусами опухолевых клеток мочевого пузыря. Наличие ДНК CMV в опухоли коррелировало с уровнем антител IgG к CMV, anti-EBV к нуклеарному антигену и раннему антигену. Корреляционных взаимоотношений между HSV I, II типа и других вирусов выявлено не было, как и динамики IgG-антител в зависимости от характера опухоли и степени анаплазии. ДНК HPV высокого онкогенного риска в опухоли выявлена у больных с низкодифференцированным уротелиальным раком. Отмечается высокая корреляционная зависимость между наличием вируса в опухоли и уровнем белков острой фазы к капсидному антигену EBV. Остальные данные статистически недостоверны.
Таким образом, все возрастающая роль вирусных инфекций в этиологии опухолей различной локализации, их влияние на частоту рецидивирования и течение заболевания, а также возможность проведения противовирусной онколитический терапии диктует необходимость более тщательного изучения их роли в этиологии развития рака мочевого пузыря.
ВЫВОДЫ
1. Выявлены высокие титры anti – CMV IgG у больных раком мочевого пузыря. Их уровень был значительно выше у больных с рецидивным характером опухоли, высокой степенью анаплазии и высокой стадией процесса.
2. Имеется статистически достоверная корреляционная зависимость между наличием ДНК CMV в опухоли и уровнем анти-CMV IgG, стадией процесса, уровнем ранних антител и антител к нуклеарному антигену к EBV.
3. Определяются высокие коррелятивные связи между уровнем анти-CMV IgG и стадией процесса, рецидивным характером опухоли и уровнем ранних антител к EBV.
4. Значительного изменения уровня анти-HSV I и II IgG, а также корреляционных связей между уровнем антител других вирусов и наличием ДНК других вирусов в опухоли не выявлено.
5. ДНК HPV высокого онкогенного риска выявлена в 3 случаях (в одном в сочетании с EBV) у больных с низкодифференцированной опухолью и его наличие коррелировало с уровнем белков острой фазы IgM к капсидному антигену EBV.
Полученные данные позволяют говорить о целесообразности продолжения исследования и о получении статистически достоверных данных.
ЛИТЕРАТУРА
1. Michaelis M, Doerr HW, Cinatl JJr. The story of Human Cytomegalovirus and Cancer Increasing Evidence and Open Questions. // Neoplasia. 2009. Vol. 11, N 1. P. 1-9
2. Андреева Ю.Ю. Морфологические и молекулярно-биологические факторы прогноза рака мочевого пузыря: Автореф. дисс. … д-ра мед.наук. М., 2009. 43 с.
3. Франк Г.А., Завалишина Л.Э., Иткес А.В., Мяндина Г.И., Пягай П.Э. Детекция генома вируса папилломы человека типа 16 в клетках опухолей периферической крови пациентов, страдающих раком мочевого пузыря.// Вестник РУДН. Серия Медицина; 2003. N 5. C. 29-32.
4. Frank G, Zavalishina L, Andreeva YY. Immunohistochemical study of urothelial carcinoma in patients with different tumor progression risk. // Mod Pathol. 2006. Vol. 19, Suppl 3. P. 115.
5. Badawi H, Ahmed H, Ismail A, Diab M, Moubarak M, Badawy A, Saber M. Role of human papillomavirus types 16, 18, and 52 in recurrent cystitis and urinary bladder cancer among Egyptian patients. // Medscape J Med.2008. Vol. 10, N 10. P. 232.
6. Moonen PM, Bakkers JM, Kiemeney LA, Schalken JA, Melchers WJ, Witjes JA Human papilloma virus DNA and p53 mutation analysis on bladder washes in realtion to clinical outcome of bladder cancer. // Eur Urol. 2007. Vol. 52, N 2. P. 464-468.
7. Исаков В.А., Архипова Е.И., Исаков Д.В. Герпесвирусные инфекции человека. Руководство для врачей. Спб:. СпецЛит, 2006. 303 c.
8. Abol-Enein H. Infection: is it cause of bladder cancer? // Scand J Urol Nephrol Suppl. 2008. N 218. P. 79-84.
9. Молочков В.А, Семенова Т.Б., Киселев В.И., Молочков А.В. Генитальные вирусные инфекции. М.: Изд-во БИНОМ, 2009. 208 с.
10. Guthrie R. American Herpes FoundationMonitor 1999.Vol.1.-P. 1
11. Башмакова М.А., Савичева А.М. Папилломавирусная инфекция. М.: Медицинская книга; Н. Новгород: Изд-во НГМА; 2002. 21 с
12. Чеботкевич ВН., Абдулкадыров К.М. Вирусные инфекции у онкогематологических больных (патогенез, диагностика, клиника, профилактика, лечение), СанктПетербург, 2002. 134 с.
13. Винаров A.З. Микоплазменная инфекция: персистенция и возможная роль в канцерогенезе предстательной железы. // Урология сегодня, 2010, N 4. C.5
14. Mullerad M, Bochner BH, Adusumilli PS, Bhargava A, Kikuchi E, Hui-Ni C, Kattan MW, Chou TC, Fong Y. Herpes simples based gene therapy enhances the efficacy of mitomycin C for the treatment of human bladder transitional cell carcinoma. // J Urology. 2005. Vol. 174, N 2.P. 741-716
15. Kohno S, Luo C, Goshima F, Nishiyama Y, Sata T, Ono Y. Herpes simplex virus type I mutant HF10 oncolytic viral therapy for bladder cancer. // Urology. 2005. Vol. 66, N 5. P. 1116-1121
16. Maloney KE, Wiener JS, Walther PJ. Oncogenic human papillomaviruses are rarely associated with squamous cell carcinoma of the bladder: evaluation by differential polymerase chain reaction. // J Urol. 1994. Vol. 151, N 2. P. 360-364.
17. Aynaud O, Tranbaloc P, Orth G. Lack of evidence for a role of human papillomaviruses in transitional cell carcinoma of the bladder. // J Urol. 1998. Vol. 159, N 1. P. 86-89. 18. LaRue H, Simoneau M, Fradet Y. Human papillomavirus in transitional cell carcinoma of the urinary bladder. // Clin Cancer Res. 1995. Vol. 1, N 4. P. 435-440.
19. Griffiths TR, Mellon JK. Human papillomavirus and urological tumours: II. Role in bladder, proe, renal and testicular cancer. // BJU Int. 2000. Vol. 85, N 2. P. 211-217.
20. Головина Д.А., Ермилова В.Д., Хачатурян А.В., Чебан Н.Л., Матвеев В.Б., Волгарева Г.М. ВПЧ-статус рака мочевого пузыря, морфологические характеристики опухоли и клинические особенности заболевания. // Онкоурология. 2014. N 1. C. 35-38
21. Piersma SJ. Immunosupressive tumpr microenvironment incervical cencer patients. // Cancer Microenviron. 2011. Vol. 4, N 3. P. 361-375.
22. Flamand L, Romerio F, Reitz MS, Gallo RC. CD4 ter transactivation by human herpesvirus 6. // J Virol. 1998. Vol. 72, N 11. P. 8797-8805.
23. Chen M, Popescu N, Woodworth C, Berneman Z, Corbellino M, Lusso P, Ablashi DV, DiPaolo JA. Human herpesvirus 6 infects cervical epithelial cells and transactivates human papillomavirus gene expression. // J Virology. 1994. Vol. 68, N 2. P. 1173-1178.
Ключевые слова: рак мочевого пузыря, цитомегаловирус, вирус герпеса I-го и II-го типа, вирус папиломы человека высокого онкогенного риска
Источник
