Осложнения экстрофии мочевого пузыря

Экстрофия мочевого пузыря – это порок развития мочеполовой системы, при котором формирование мочевого пузыря и передней брюшной стенки в его проекции остается незавершенным. С рождения наблюдается открытая и вывернутая наружу слизистая оболочка задней стенки мочевого пузыря, а также постоянное отделение и стекание мочи из открывающихся в нижней части органа протоков мочеточников. Экстрофия мочевого пузыря часто сочетается с пороками наружных и внутренних половых органов, мочеточников и почек. Диагностируется по характерным внешним признакам, дополнительно проводится рентгенологическое и УЗИ-обследование. Лечение оперативное, выполняются реконструктивно-пластические и заместительные операции.
Общие сведения
Экстрофия мочевого пузыря – одна из наиболее часто встречаемых аномалий развития мочеполовой системы. Частота в популяции – 1 случай на 30-50 тысяч новорожденных, примерно 1/5 часть пациентов имеет сочетанные пороки развития. В большей степени страдают мальчики, по данным разных авторов распространенность патологии среди них в 2-6 раз выше, чем среди девочек.
Специалисты в сфере педиатрии и хирургии сталкиваются с большими трудностями в лечении экстрофии мочевого пузыря, хотя первые операции для коррекции этой аномалии были предложены еще в 1960-х годах. Реконструкция и пластика не приводят к излечению. Сохраняющееся недержание мочи значительно ухудшает качество жизни ребенка, а частые восходящие инфекции становятся причиной хронической почечной недостаточности, представляющей серьезную опасность для жизни.
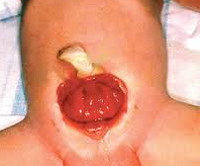
Экстрофия мочевого пузыря
Причины
Конкретной причины данной аномалии развития не выявлено, патология считается мультифакториальной. Доказана генетическая предрасположенность к некоторым сочетанным порокам органов брюшной полости, в числе которых присутствует и экстрофия мочевого пузыря. Кроме того, повышает риск развития аномалии воздействие различных токсических и инфекционных агентов во время беременности, в частности, курение, внутриутробные инфекции, некоторые медикаменты и т. д. Травмы плода также могут способствовать нарушению правильного эмбриогенеза с развитием пороков.
Патогенез
Основной патогенетический момент экстрофии мочевого пузыря – задержка обратного развития клоакальной перегородки, которая препятствует внедрению мезодермального листка между наружным и внутренним эмбриональными слоями. Это приводит к тому, что процесс формирования стенок мочевого пузыря оказывается незавершенным, и орган остается открытым и вывернутым наружу. Описанные процессы в норме протекают на 4-6 неделе эмбрионального развития, поэтому воздействие тератогенных факторов наиболее опасно в самом начале беременности. Впрочем, это касается не только экстрофии мочевого пузыря, но и большинства пороков развития.
Симптомы
Проявления порока визуально заметны сразу после рождения. Неонатолог при осмотре новорожденного обращает внимание на ярко-красную слизистую оболочку мочевого пузыря, которая замещает отсутствующую часть передней брюшной стенки. Слизистая, как правило, имеет обычную морфологию, но возможно и псевдопапилломатозное изменение. В нижней части заметны отверстия мочеточников, из которых постоянно выделяется моча.
С течением времени основной проблемой при экстрофии мочевого пузыря становится раздражение окружающих тканей мочевыми солями, постоянная мацерация вокруг открытого участка и в области бедер. Инфицирование слизистой оболочки мочевого пузыря является причиной восходящей инфекции мочеточников и почек.
Экстрофия мочевого пузыря часто сочетается с аномалиями верхних мочевыводящих путей. Кроме того, экстрофии всегда сопутствует расхождение лобкового симфиза. Вследствие анатомических различий у мальчиков и девочек наблюдаются разные изменения в соседних органах. У мальчиков встречается расщепление пещеристых тел или их редукция, у девочек – расщепление клитора, аномалии развития влагалища.
Диагностика
В последние годы активно развиваются методы антенатальной диагностики данного порока. Экстрофия мочевого пузыря может быть заметна уже на втором УЗИ-скрининге, однако такое случается не всегда. Часто аномалия развития обнаруживается только после рождения. Поскольку симптоматика специфична, диагноз не вызывает сомнений.
Обязательно проведение рентгенографии брюшной полости для выявления сочетанных пороков, в первую очередь, в мочевыделительной системе, но также в кишечнике и спинном мозге (наиболее характерные сочетания с экстрофией мочевого пузыря). С этой же целью проводится УЗИ. Рекомендована экскреторная урография, которая позволяет убедиться в целостности и правильном развитии мочеточников и почек.
Лечение экстрофии мочевого пузыря
Лечение оперативное. Тип операции зависит от степени экстрофии мочевого пузыря, а именно – от размеров вывернутой части органа и, соответственно, отсутствующего сегмента передней брюшной стенки, а также от сопутствующих пороков развития. Если размер дефекта не превышает 4 см, проводится реконструктивно-пластическое вмешательство, цель которого – закрытие дефекта с помощью близлежащих тканей и восстановление целостности мочевого пузыря. Этого достаточно, поскольку гистологически орган развит правильно, несмотря на патологию в анатомии.
В случае больших размеров дефекта создается искусственный мочевой пузырь, который может выполнять функцию резервуара и опорожняться по желанию. Также часто мочеточники выводятся в сигмовидную кишку (уретеросигмостомия) – это обязательная мера в случае их расщепления.
Большую проблему для детских хирургов представляет расхождение костей таза при экстрофии мочевого пузыря. Накопленный врачебный опыт говорит о высокой частоте неудовлетворительных результатов операций, что связано с большим количеством сочетанных пороков и значительным дефектом передней брюшной стенки.
Прогноз и профилактика
Прогноз для выздоровления сомнительный. Неоперированные пациенты редко доживают до 10 лет. Что касается успеха оперативного лечения, то 20-80% проведенных вмешательств приводят лишь к незначительному улучшению. Нарушения уродинамики продолжают прогрессировать, сохраняется недержание. Риск развития восходящей инфекции остается высоким.
Профилактика экстрофии мочевого пузыря возможна в антенатальном периоде, еще лучше – на этапе планирования беременности, чтобы максимально исключить воздействие тератогенных факторов, особенно на этапе закладки основных органов и систем, то есть в первые 4-8 недель внутриутробного развития.
Источник

УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Введение
Экстрофия мочевого пузыря (ЭМП) – редкий тяжелый врожденный порок развития нижних мочевых путей, характеризующийся отсутствием передней брюшной стенки и передней стенки мочевого пузыря, а также расхождением лонного сочленения (диастаз). Через дефект передней брюшной стенки пролабирует слизистая оболочка. В нижней части обнаженной слизистой оболочки расположены устья мочеточников, из которых постоянно выделяется моча. Пуповина впадает низко в верхний край дефекта передней брюшной стенки.
Экстрофийные пороки нижних мочевых путей делят на классическую экстрофию мочевого пузыря и экстрофию клоаки. У мальчиков экстрофия мочевого пузыря сочетается с расщеплением мочеиспускательного канала (эписпадия). Экстрофия мочевого пузыря у девочек сопровождается расщеплением клитора, расщеплением или отсутствием мочеиспускательного канала, а также спайками больших и малых половых губ [1, 2].
В литературе экстрофия мочевого пузыря чаще всего описывается в комплексе с эписпадией, хотя имеются сообщения об изолированном поражении стенки мочевого пузыря, когда его шейка и мочеиспускательный канал сформированы. Такая патология называется неполной экстрофией, или переднепузырным свищом. При неполной экстрофии патология половых органов отсутствует [3, 4]. Наиболее тяжелой и редкой формой порока является экстрофия клоаки, при которой расщепление распространяется не только на урогенитальную область, но и на терминальный отдел кишечника [5, 6].
Впервые экстрофию мочевого пузыря, как врожденный порок развития, описал Schenk von Grafenberg в 1597 г. В 1780 г. Chaussier впервые использовал термин “экстрофия”. Упоминания об экстрофии мочевого пузыря обнаружены на ассирийских табличках, сделанных 2000 лет до н. э. [7]. Частота экстрофии мочевого пузыря составляет 0,25-0,5 на 10 тыс. новорожденных. Соотношение классической экстрофии мочевого пузыря у мальчиков и девочек 3:1 [1, 8]. При экстрофии мочевого пузыря встречаются сопутствующие врожденные аномалии – паховые грыжи (у 56 % мальчиков, у 15 % девочек), крипторхизм (20 %), колоректальные аномалии (1,8 %) и др. [1, 2]. Экстрофия мочевого пузыря может входить в состав комплекса OEIS (omphalocele, extrophy, imperforate anus, spinal defects), OMIM 258040.
Пренатальная диагностика экстрофии мочевого пузыря возможна уже при первом скрининговом обследовании в 11-14 нед беременности, когда в норме полость мочевого пузыря начинает наполняться мочой. Визуализация мочевого пузыря обязательно входит в стандартные протоколы исследования пренатального скрининга.
Эмбриопатогенез
Экстрофия мочевого пузыря формируется на 4-5-й неделе эмбриогенеза, когда на 28-32-й день происходит каудальная миграция мембраны клоаки. В то же время формируется передняя брюшная стенка, однако если мезенхима не переходит из одного клеточного слоя нижней брюшной стенки в другой, то это приводит к нестабильности клоакальной мембраны. Преждевременный разрыв мембраны клоаки приводит к комплексу “подпупочных” аномалий. Разрыв клоакальной мембраны после полного разделения “урогенитальной” части от пищеварительного тракта приводит к формированию классической экстрофии мочевого пузыря.
Если повреждение мембраны происходит до того, как спускается уроректальная перегородка, тогда это приводит к вывороту нижнего уретрального тракта и части пищеварительного тракта с формированием клоакальной экстрофии. Генетические факторы, связанные с экстрофией мочевого пузыря, на сегодняшний день не выявлены, однако существует гипотеза, что потеря экспрессии р63 из-за полиморфизмов очередности у промотера является фактором риска развития экстрофии мочевого пузыря [1, 9].
Ниже представлен случай диагностики экстрофии мочевого пузыря в III триместре беременности.
Материал и методы
Пациентка С.,18 лет, настоящая беременность первая, от первого брака, супруги соматически здоровы, профессиональных вредностей не имеют, наследственность не отягощена. На учете в женской консультации пациентка состояла с 9 нед беременности. Беременность протекала без осложнений. При скрининговом УЗ-исследовании в I и II триместрах по месту жительства ВПР и УЗ-маркеров хромосомных перестроек у плода не обнаружено.
При УЗ-обследовании в 34 нед беременности в женской консультации по месту жительства было обнаружено образование средней эхогенности размером 28x23x25 мм в области нижних отделов передней брюшной стенки. Женщина была направлена в медикогенетическое отделение МОНИИАГ с диагнозом: “ВПР плода, экстрофия мочевого пузыря?”.
УЗ-исследование проводилось на сканере WS80A (компании Samsung Medison) с использованием объемного датчика CV1-8A.
Результаты
При УЗ-исследовании обнаружен один живой плод женского пола в головном предлежании. Гестационный срок составил 34,4 нед. Фетометрические показатели плода соответствовали данному сроку. Патологических изменений плаценты и околоплодных вод не выявлено. При исследовании мочевой пузырь в типичном месте не визуализировался.
В нижних отделах передней брюшной стенки в надлобковой области визуализировалось эхогенное образование размером 30x28x25 мм (рис. 1, 2). Определялось низкое впадение пуповины. Почки плода визуализировались в типичном месте, без структурных изменений. Патологических изменений других органов не было выявлено.

Рис. 1. Эхогенное образование в нижнем отделе передней брюшной стенки (экстрофированный мочевой пузырь).

Рис. 2. Экстрофия мочевого пузыря в сочетании с отсутствием видимой патологии наружных половых органов (режим трехмерной реконструкции).
Поставлен диагноз: “Беременность 34,4 нед. ВПР плода – экстрофия мочевого пузыря”.
Обсуждение
Пренатальными УЗ-признаками экстрофии мочевого пузыря являются: отсутствие визуализации мочевого пузыря при нормальном количестве околоплодных вод, структурно неизмененные почки, визуализация эхогенного образования в надлобковой области, аномалии строения половых органов. Использование ЦДК является дополнительным инструментом для диагностики экстрофии мочевого пузыря. В норме пупочные артерии проходят вдоль стенки мочевого пузыря при поперечном сканировании нижней части живота. Для экстрофии мочевого пузыря характерно низкое впадение пуповины, при котором артерии охватывают образование в надлобковой области. При отсутствии визуализации мочевого пузыря в типичном месте необходимо провести повторное сканирование через 30-40 мин для адекватной оценки его расположения и степени наполнения.
Изолированная экстрофия мочевого пузыря, как правило, не сочетается с хромосомными перестройками у плода и не требует пренатального кариотипирования.
В данном клиническом наблюдении экстрофия мочевого пузыря была диагностирована у плода женского пола, что встречается значительно реже, чем у плодов мужского пола. Кроме того, отсутствие выраженной деформации наружных половых органов позволяет предположить неполную форму экстрофии. Оценка анатомии мочевого пузыря включена в протокол обязательного скринингового обследования во всех триместрах беременности. Отсутствие визуализации мочевого пузыря в типичном месте должно насторожить врачей УЗ-диагностики. Однако часто экстрофия мочевого пузыря диагностируют лишь в III триместре беременности.
После рождения детям с экстрофией мочевого пузыря требуется многоэтапная сложная хирургическая коррекция. Процент неудовлетворительных отдаленных результатов, к сожалению, остается на сегодняшний день очень высоким, как правило, вследствие присоединения таких осложнений, как нарушение функции тазовых органов: недержание мочи, рубцовая деформация половых органов, половая дисфункция, выраженная деформация передней брюшной стенки, уретерогидронефроз III-IV степени, непрерывно рецидивирующий пиелонефрит со снижением функции почек, хроническая почечная недостаточность и др. [4, 7]. Огромной и сложной проблемой остается медико-социальная реабилитация больных с экстрофией мочевого пузыря.
Заключение
Сложности ранней диагностики связаны с невыраженными УЗ-проявлениями достаточно тяжелой патологии. Четкое соблюдение алгоритма скрининговых УЗ-исследований анатомии плода в 11-14 и 20-22 нед беременности позволяет диагностировать экстрофию мочевого пузыря. При выявлении экстрофии мочевого пузыря у плода необходимо проведение медико-генетического консультирования с оформлением пренатального консилиума. Требуется тщательное разъяснение родителям сути выявленной патологии, а также информация о частых послеоперационных отдаленных последствиях и осложнениях как физического, так и психогенного генеза.
Литература
- Лопаткин Н.А., Пугачев А.Г. Пороки развития мочевого пузыря и уретры. В кн. Детская урология. Руководство. М.: Медицина, 1986. С. 207-242.
- Gearhart J.P. Criteria for the prenatal diagnosis of classic bladder exstrophy / J.P. Gearhart, J. Ben-Chaim, R.D. Jeffs // Obstet. Gynecol. 1995. Jun. 1. V. 85. № 6. P. 961-964.
- Михельсон А.И. Оперативное лечение недержания мочи на почве врожденных аномалий мочевой системы. Минск, Госсиздат БССР. 1957.
- Осипов И.Б. Реконструктивно-пластические операции при экстрофии мочевого пузыря у детей: автореф. дисс. докт. мед. наук. СПб, 1996.
- Ахунзянов А.А. Диагностика и лечение врожденной клоаки у детей // Хирургия. 1976. № 9. С. 98-101.
- Захаров Н.Л. Дефекты передней брюшной стенки у новорожденных // Хирургия. 1986. № 6.
- Hollowell J.G., Ransley P.G. Surgical management of Incontinence in bladder exstrophy // Brit. J. Urol. 1991. V. 68. № 5. P. 543-548.
- Kockum C.C., Hansson E.E., Stenberg A.et. al. Bladder exstrophy in Sweden-a long-term follow-up study // Eur. J. Pediatr. Surg. 1996. V. 6. P. 208-211.
- Баиров Г.А., Ахметджанов И.А., Осипов И.Б. Реконструктивно-пластические операции при экстрофии мочевого пузыря у детей // Вестник хирургии. 1986. Т. 136. № 6. С. 105-108.

УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Источник
Экстрофия мочевого пузыря
Что такое экстрофия мочевого пузыря?
Экстрофия мочевого пузыря – это врожденная аномалия мочевого пузыря, наружных половых органов и костей таза. Мочевой пузырь не имеет нормальной шаровидной формы, а открыт спереди и вывернут внизу живота наизнанку – слизистой оболочкой наружу. Кости таза не образуют замкнутого кольца, так как лобковые (лонные) кости разведены в стороны и между ними находится мочепузырная площадка. Пупок отсутствует. У мальчиков всегда имеется эписпадия – расщелина передней стенки мочеиспускательного канала с укорочением и расщеплением спереди полового члена. У девочек – расщепленный на 2 половины клитор, влагалище смещено кпереди, отсутствует передняя спайка половых губ. У всех детей тотальное недержание мочи.
Как часто встречается экстрофия мочевого пузыря?
Частота аномалии составляет примерно 1 случай на 35 000 новорожденных. Эта аномалия встречается в 3 раза чаще у мальчиков, чем у девочек. Вероятность рождения второго ребенка с экстрофией в одной семье не более 1%. Генетическая основа экстрофии находится в процессе изучения. Редкость патологии не позволяет большому количеству врачей иметь опыт лечения. Поэтому экстрофию с успехом лечат лишь отдельные специалисты.
Какие проблемы связаны с открытой слизистой оболочкой мочевого пузыря?
Обычно таких проблем немного. Для предотвращения развития полипов на мочевой площадке вследствие механического раздражения памперсами ее закрывают предварительно перфорированной пищевой пленкой (проколоть много отверстий иголкой) и обрабатывают антисептиками.
Как лечится экстрофия и в чем залог успеха?
Экстрофия сложное заболевание с множеством персональных особенностей и проблем. Лечение хирургическое. Для достижения оптимального результата следует обращаться к хирургу – специалисту по лечению экстрофии, владеющему всеми методами, и имеющему значительный опыт успешных реконструкций. В команде врачей обязательно должен быть опытный хирург – ортопед для выполнения пластики таза и устранения промежутка между лобковыми (лонными) косточками. Хирург и его команда должны вести ребенка в течение многих лет, проводя этапное хирургическое лечение и своевременно предупреждая осложнения, в частности, нарушения функции почек. Врачи должны быть доступны для связи.
Как проходит лечение и какие операции выполняют большинству пациентов с экстрофией мочевого пузыря?
Лечение экстрофии этапное. Первый этап первичное закрытие мочевого пузыря выполняется в 1-3 месяцев. Затем проводится лечение, направленное на увеличение мочевого пузыря. От емкости мочевого пузыря зависит результат основного (второго) этапа – создания механизма удержания мочи – шейки мочевого пузыря и уретрального сфинктера. Предпочтительно – в возрасте 4-6 лет. При выполнении пластики шейки мочевого пузыря у детей в возрасте 1-3 лет мочевой пузырь может прекратить свое развитие.
Перед пластикой шейки обычно требуется пересадка мочеточников для ликвидации пузырно-мочеточникового рефлюкса. Примерно у трети детей проводится операции пластики таза – устранения межлонного промежутка. Всем детям показана эстетическая пластика передней брюшной стенки, создание пупка. У мальчиков, обычно в 1-3 года – реконструкция полового члена – фаллопластика. У девочек – пластика наружных половых органов.
Как часто требуется пластика таза при экстрофии мочевого пузыря. Насколько важно совмещать ее с закрытием мочевого пузыря?
Пластику таза следует выполнять при большом межлонном промежутке и с целью улучшения внешнего вида. Это 30-40% детей с экстрофией и 10% детей с эписпадией. Стабилизация походки достигается при пластике таза у детей с межлонным промежутком более 6 см. На результаты лечения недержания мочи и пролапс тазовых органов у девочек устранение межлонного промежутка по последним данным не влияет. Остеотомия со сближением лонных костей может выполняться отдельно от закрытия мочевого пузыря или совместно.
Можно ли устранить межлонный промежуток без остеотомии?
По данным литературы и практического опыта все попытки устранения межлонного промежутка без остеотомии (у детей старше 5 дней жизни) не привели к положительным результатам и давали множество осложнений. Только пересечение подвздошных костей (остеотомия) позволяет свести лонные кости. Консолидация (сращение) в местах остеотомии происходит в течение 1-2 месяцев в зависимости от возраста.
Что делают, если мочевой пузырь не вырос к 5-6 годам?
У некоторых детей мочевой пузырь не растет и формируется микроцистис – рубцовый мочевой пузырь малого объема. Это связано с малыми размерами и выраженными полипозными изменениями уже при рождении или ранним созданием удерживающего мочу механизма. В таких случаях в проводится операция аугментации – увеличения емкости мочевого пузыря за счет использования участка кишки.
В каких зарубежных странах и клиниках проводится лечение экстрофии?
Лечение экстрофии проводится хирургами в разных странах. В Европе и США лечением экстрофии занимаются специалисты, работающие в многопрофильных клиниках. И это оправдано, так как для достижения результата и обучения родителей всем нюансам обращения со сложными пациентами нужна команда специалистов. При лечении в небольших частных клиниках, например в Израиле, Сербии и др. операции выполняются одним хирургом , не делаются реконструкции костей таза, резко сокращается срок пребывания в больнице. Все это экономит деньги, но экономия нередко оборачивается осложнениями и лишними операциями.
Каковы риски лечения за рубежом?
Общей опасностью лечения экстрофии за рубежом является невозможность прямых контактов с оперирующими врачами после возвращения домой. А проблем, по которым приходится советоваться множество – практически весь перечень урологических заболеваний детского возраста.
Инфекции мочевого пузыря, острый пиелонефрит, образование мочевых камней, свищи, пузырно-мочеточниковый рефлюкс и мегауретер, неразвивающийся мочевой пузырь, пролапс тазовых органов у девочек и короткий половой член у мальчиков, невозможность проведения катетера по каналам для катетеризации, осложнения после аугментации мочевого пузыря, задержки мочи и др. Там, где проживает ребенок, как правило нет специалистов, готовых решать вопросы послеоперационных осложнений у оперированных за рубежом пациентов.
Опыт лечения экстрофии в РДКБ. Насколько он успешен?
Усовершенствование методов лечения экстрофии и собственные разработки вывели наши результаты на новый уровень. Благодаря изучению опыта разных хирургических школ, были найдены решения, позволившие предложить новый подход к реконструкциям и достигать удержания мочи и самостоятельного мочеиспускания без периодической катетеризации мочевого пузыря. По окончании лечения все дети удерживают мочу и более 70% детей могут мочится самостоятельно.
Насколько важно обеспечить успех первичного закрытия с первого раза и где его проводить?
Первичное закрытие мочевого пузыря важно сделать качественно с первого раза. Это увеличивает шансы на достижение удержания в дальнейшем. Закрытие необязательно должно проводиться после рождения, главное, чтобы ее выполнял специалист, имеющий большой положительный опыт таких операций. За последние 8 лет мы успешно провели первичное закрытие боле 40 пациентам с экстрофией в возрасте от 1 месяца до 15 лет.
Первичное закрытие мочевого пузыря: Когда и Как?
Первичное закрытие мочевого пузыря играет огромную роль в многоэтапном лечении экстрофии. Родители должны знать несколько важных принципов, которые особенно влияют на результат.
Первичное закрытие мочевого пузыря сразу после рождения имеет риск осложнений от 20 до 80%. Осложнения у новорожденных связаны с тяжелым состоянием, больничными инфекциями, отсутствием иммунитета, с попытками тесного сведения лонных косточек, малыми размерами мочевой пластинки, длительным пребыванием в больнице (более 30 суток) и др. Кроме того, ребенок находится несколько дней в реанимации, затем на вытяжении, с мочевыми дренажами в пузыре и мочеточниках, что способствует развитию инфекции, затрудняет уход, мешает контакту с мамой и грудному вскармливанию.
Считается, что сведение лонных косточек у новорожденных улучшает результаты закрытия. Однако, на практике количество осложнений после сведения в первые дни жизни только возрастает. Остеотомии и сведение лонных косточек у новорожденных детей резко утяжеляют состояние ребенка, затягивая выздоровление и увеличивая риск инфекций. В последующем, несмотря на сведение лонных косточек и даже проведенную остеотомию, они вновь расходятся до 5-7 см, что обесценивает затраченные усилия.
Лучшие результаты первичного закрытия мочевого пузыря достигаются в возрасте от 1 до 3 месяцев. Закрытие, проведенное в 6-14 месяцев, может сопровождаться недоразвитием мочевого пузыря. Правильный уход за мочевой пластинкой после рождения также важен для результата. За месяц после рождения ребенок полностью восстанавливается после родов, налаживается тесная связь с мамой, грудное вскармливание дает ребенку необходимый иммунитет, кишечник заселен нормальной микрофлорой.
Операции закрытия мочевого пузыря, проведенные в возрасте 1-3 месяца, по моему опыту, обычно не требуют остеотомии и дают прекрасные результаты. Заживление происходит в течение 10-12 дней, после чего ребенок может быть выписан домой, не успев получить госпитальную инфекцию и связанные с ней осложнения.
Остеотомию в процессе закрытия необходимо выполнять лишь у 10-15% детей – с экстрофией клоаки или при очень большой мочевой пластинке (> 5 см в диаметре). У пациентов с широким расхождением лонных костей остеотомии, также как и пластика полового члена могут выполняться и в более старшем возрасте, когда ребенок уже вылечен от недержания мочи. И результаты фаллопластики при отсутствии недержания могут быть даже лучше, чем у мальчиков 1-2 лет.
У детей 1 месяца с маленькой мочепузырной пластинкой (до 3 см) – для достижения лучшего результата после рождения или в возрасте 1-2 месяцев стоит провести обкалывание пузыря ботоксом (лантоксом или аналогом) и через 4 месяца провести операцию. За это время поперечный размер пузырной пластинки увеличиваются примерно в 1,5 раза, что достаточно для достижения хорошего результата лечения.
Консультации (от 0 до 18 лет) проводятся в поликлинике Российской Детской Клинической Больницы (Москва, Ленинский проспект 117)
+7 (495) 434-76-00
номер приемной Российской Детской Клинической Больницы
+7 (916) 610-70-82
Контактный номер (только WhatsApp) Николаева Василия Викторовича
Назад
Источник
