Очаговая инфильтрация мочевого пузыря

Опухолью мочевого пузыря называют доброкачественное новообразование, возникающее на его стенках. Наиболее часто патологические процессы происходят на задней и боковых стенках пузыря, шейке, в мочепузырном треугольнике (треугольник Льето), изменяя количественный и качественный состав клеток эпителия слизистых оболочек.
Доброкачественная опухоль мочевого пузыря, как правило, локализуясь на определённом участке поверхностей, изменяет его клетки, в результате чего образуются полипы, аденомы, эндометриоз, феохромоцитомы (фиброепителиомы), лейомиомы, рабдомиомы, невриномы и папилломы в мочевом пузыре, где преимущественно располагаются все опухоли мочевыделительной системы. Мужское население от 50 до 70 лет заболевает опухолевыми болезнями мочевого пузыря в 4 раза чаще, чем женское.
Эпителиального происхождения доброкачественные опухоли встречаются у 95-98% больных в виде папиллом и полипов, которые при озлокачествлениипроцесса могут перейти в разные виды рака мочевого пузыря и аденокарциному (90-96% от всех опухолей мочевого пузыря). Папиллома мочевого пузыря, невзирая на её морфологически доброкачественнуюструктуру, определяется как предраковая опухоль, потому как имеет склонность к частым рецидивами перерождению в злокачественную.
Доброкачественные опухоли мочевого пузыря отличаются отсутствием метастазирования, поражения здоровых тканей вокруг и продолжением роста после оперативного удаления. Самую большую распространенность среди мужчин после 45 лет получила аденома, хотя за последние десятки лет она значительно «помолодела».
Неэпителиального происхождения (из соединительной ткани) опухоли мочевого пузыря в виде фибром, миом, гемангиом, фибросарком – очень редко встречающиеся новообразования, хотя саркомы, дающие лимфогенные и гематогенные метастазы на ранних стадиях, определяются гораздо чаще.

Классификация опухолей мочевого пузыря
Доброкачественныеопухоли делятся на группы эпителиальногои неэпителиальногопроисхождения. К эпителиальным условно доброкачественным опухолям относятся:
- Папилломы, представляющие собой многочисленные длинные разветвленные ворсинки со множеством кровеносных сосудов, которые определяются как потенциально злокачественные, т.к. склонны к малигнизированию.
- Аденома (гиперплазия) предстательной железы, образующаяся из клеток слизистой мочевого пузыря или стромальной составляющей предстательной железы. Она имеет узелки, которые при увеличении размеров сдавливают мочевыводящий канал, мешая процессу мочеотделения.
- Эндометриозмочевого пузыря – это опухоль, являющаяся итогом гормональных нарушений, когда имеется избыток эстрогенов и дефицит прогестерона, с губчатой структурой из разнокалиберных кист на стенке, выпирающих в пузырь, на фоне повышенной отечности и гиперемии околослизистого пространства. Эндометриоз зависим от менструального цикла, имеет склонность к озлокачествлению клеток.
- Полипы – это выступающие над слизистым слоем мочевого пузыря патологические разрастания тканей.
- Феохромоцитома – нейроэндокринная опухоль в мышечном слое шейки, образовавшаяся из клеток хромаффинной ткани, выделяющей переизбыток катехоламинов.
- Типичная фиброэпителиома – нежное ворсистое новообразование на ножке, которое может размножиться.
- Атипичная фиброэпителиома – ворсинчатое образование с более грубыми ворсинками на более толстой ножке, с умеренно отечной и гиперемированной слизистой оболочкой вокруг. При объединении с папилломатозом она опасна перерождением в злокачественную опухоль.
К неэпителиальным доброкачественным опухолям мочевого пузыря относятся фибромы, миомы, фибромиксомы, гемангиомы, липомы, лимфангиомы, опухоль Абрикосова (зернистоклеточная опухоль), невриномы, встречающиеся в урологической практике относительно нечасто.
Прогноз и профилактика доброкачественных опухолей мочевого пузыря
В основной практике полипы и папилломы продолжительное время могут никак себя не проявлять, поэтому их обнаружение и лечение на запущенных стадиях озлокачествления редко даёт положительные результаты. Чтобы избежать усложнений заболевания, люди из группы риска должны периодически обследоваться, избавляться от провоцирующих опухолеобразование болезней, вести здоровый образ жизни и находиться под наблюдением врача. Послеоперационный период при неосложненных новообразованиях длится недолго, и возврат к нормальной полноценной жизни равен практически 100%.
Причины развития доброкачественных опухолей мочевого пузыря
Этиология развития опухолей мочевого пузыря окончательно не определена, однако, исходя из известных факторов, определяются следующие:
- анилиновые красители, особенно их производные – ароматические амины с их конечными метаболитами (бензидином, нафтиламином и др.), обладающие канцерогенным действием на работников лакокрасочных, бумажных, химических и резиновых производств;
- различные канцерогены окружающей среды, попадая в организм и выводясь с мочой, приобретают патологическое влияние на уротелий при застое мочи;
- курение и стаз мочи являются толчковым механизмом к образованию опухолей мочевого пузыря, когда ортоаминофенолы (продукты конечного обмена аминокислоты триптофана) вызывают разрастание клеток эпителия мочевыводящего тракта;
- возраст и пол больного, анатомические особенности строения мужской мочевыводящей системы, морфологические отличия слизистой пожилых людей, часто приводящие к застою мочи;
- наличие и частота воспалительных заболеваний уретры и мочевого пузыря, таких как шеечный цистит, простатит, мочекаменная болезнь, лейкоплакия, изъязвления мочевого пузыря;
- нарушения гормонального фона, снижение активности Т-системы иммунитета;
- паразитарные инвазии типа бильгарциоза, шистомоза и другие.
Кроме этого, существует обсуждаемая тема в мировой медицине о вирусном происхождении новообразований в мочевом пузыре.
Симптомы доброкачественных опухолей мочевого пузыря
Доброкачественная опухоль мочевого пузыря, симптомы которой обычно никак не проявляются, обнаруживается, как правило, случайно. Основные и наиболее выраженные симптомы доброкачественных опухолей:
- гематурия различных типов выраженности (микро-, макрогематурия, тотальная, терминальная): главный симптом при любой доброкачественной опухоли – это наличие крови и её сгустков в мочевой жидкости на различных этапах мочеиспускания у большинства пациентов, что отличает виды и стадии опухоли;
- дизурия – затрудненное мочеиспускание, наблюдаемое у трети пациентов с частотой, увеличивающейся в результате ухудшения состояния больного;
- вторичный цистит и восходящий пиелонефрит как результат распада новообразования;
- различной выраженности дискомфорт, жжение или болезненность при мочеиспускании;
- докучающие позывы к мочеиспусканию;
- недержание мочи у мужчин и женщин;
- ложные позывы к дефекации, боль, распространяющаяся в промежность, прямую кишку, крестец при опухоли шейки мочевого пузыря;
- нарушение опорожнения мочевого пузыря при сжимании устьев мочеточников опухолями приводит к проявлению признаков хронической почечной недостаточности, пиелонефроза и уретерогидронефроза;
- болевые ощущения, рези внизу живота, локализующиеся в лобковой, а затем и в паховой области.
Иногда, вследствие перекручивания полипа или папилломы пузыря, происходит острое нарушение кровообращения, ведущее к инфаркту новообразования, что сопровождается усилением гематурии. Доброкачественные опухоли мочевого пузыря являются катализаторами рецидивов воспалительных заболеваний мочевыводящих путей – циститов, восходящих уретеропиелонефритов.
Опасность перерождения доброкачественных тканей папиллом мочевого пузыря в злокачественные наиболее велика у заядлых курильщиков. Папилломы мочевого пузыря имеют склонность к повторному прорастанию с непредсказуемой периодикой, с каждым рецидивом становясь более злокачественными, чем прежде удаленные опухоли.
Обнаружили симптомы данного заболевания?
Звоните
Наши специалисты проконсультируют Вас!
Диагностика доброкачественных опухолей мочевого пузыря
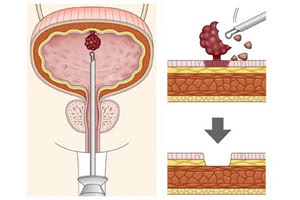
Чтобы выявить и достоверно определить наличие, тип и стадию опухоли мочевого пузыря, необходимо провести комплексную диагностику пациента всеми доступными в настоящее время методами. Особенно следует отметить следующие.
Бимануальная пальпация (ручное исследование) – обязательное исследование, однако маленькие опухоли, выросшие вовнутрь, как правило, не пальпируются, а новообразование, которое удалось пальпировать, указывает на распространившееся проникающее поражение мочевого пузыря.
Ряд клинических и биохимических анализов крови и мочи через определённые этапы времени, позволяющие провести точную оценку развития заболевания.
Рентгенологическое исследование пузыря с введением контрастного вещества (экскреторная урография) в полость пузыря для определения дефекта наполнения его мочевой жидкостью и определения состояния его слизистой оболочки. Иногда это исследование проводят в условиях двойного контрастирования, вводя кислород в мочевой пузырь и окружающую его клетчатку, чтобы уточнить степень инфильтрации стенки пузыря и распространения её на окружающие участки.
Эндоскопическое исследование полости пузыря (цистоскопия) предоставляет его внутреннюю картину, помогает с достаточной точностью определить вид опухоли, её характеристики и площадь поражения с обязательным получением тканей и мочи для бактериологического анализа.
Цитологический анализ мочевой жидкости с целью выявления атипичных клеток проводится в случаях, когда нет возможности произвести биопсию на гистологию.
Трансуретральная пункционная биопсия тканей опухоли для определения их гистологии выполняется как отдельная процедура или при трансуретральной резекции мочевого пузыря.
УЗИ (ультразвуковое исследование) пузыря и органов малого таза выявит новообразование, его вид, размеры, экспозицию и широту распространенности.
Использование магнитно-резонансной и компьютерной томография почек с введением контрастного вещества позволит обнаружить опухоль пузыря, степень её прорастания в стенки и соседние органы, развитие метастазов в регионарных лимфатических узлах.
Экскреторная томография с введением контрастных веществ в вену позволит осуществить контроль над их выходом из почек и последующим выводом из организма.
Лечение доброкачественных опухолей мочевого пузыря
Хирургическое удаление является обязательным при диагностике доброкачественных новообразований методом трансуретральной резекции, эндоскопии, электро- или лазерной коагуляции опухоли. Также предписывается полное удаления мочевого пузыря в случае значительного вовлечения его и уретры в опухолевый процесс.
Лекарственное лечение обычно бывает направлено на укрепления местного и общего иммунитета.
Противовоспалительная, противопаразитарная и противовирусная терапия назначается при необходимости.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
Источник
А.С. Попко, К.Л. Локшин, Л.А. Шестакова, В.Н. Ширшов
Клинический госпиталь Лапино, ГК «Мать и дитя»; Москва, Россия
Воспалительная миофибробластическая опухоль (ВМО) – редко встречающееся новообразование мезенхимального происхождения [1]. В классификации опухолей мягких тканей и костей Всемирной организации здравоохранения 2013 года ВМО относится к промежуточным фибробластическим/миофибробластическим опухолям, для которых характерна невысокая частота (до 2%) встречаемости отдаленных метастазов в лимфатические узлы и легкие. В зависимости от локализации первичной опухоли выделяют ВМО с поражением легких и внелегочные ВМО [2]. Чаще всего воспалительная миофибробластическая опухоль встречается в легких, брыжейке кишечника, сальнике. Описана локализация опухоли в ЦНС, сердце, среднем ухе, костях, почках, мочевом пузыре, поджелудочной железе, яичниках, печени. Заболевание выявляется у пациентов в возрасте от 3 до 89 лет, однако наиболее распространено у детей и молодых взрослых (средний возраст – 9 лет) [3].
Клиническое течение ВМО весьма вариабельно. Иногда опухоль может медленно расти и никак не проявляться клинически. В некоторых ситуациях возможен быстрый инфильтративный рост в окружающие ткани и отдаленное метастазирование. На начальных этапах развития опухоли клиническая картина может проявляться потерей массы тела, лихорадкой, анемией и повышением в сыворотке крови концентрации белков острой фазы воспаления. В дальнейшем появляются симптомы сдавления тех органов и тканей, в которых она возникла. Лечение ВМО преимущественно оперативное. В случае технической невозможности выполнения операции при прогрессировании заболевания возможно применение лучевой или химиотерапии.
Пациентка К., 30 лет, обратилась к урологу в январе 2017 г. по поводу тотальной безболевой макрогематурии без сгустков (моча цвета мясных помоев), возникшей около 10 дней назад. При УЗИ (рис. 1) и КТ (рис. 2) было выявлено образование передней стенки мочевого пузыря, размерами до 29 мм. Образование обильно васкуляризировано (рис. 3). В общем анализе мочи: лейкоциты > 100 в поле зрения, эритроциты > 100 в поле зрения. В анализах крови и соматическом статусе – без отклонений от нормы. 18.01.17 выполнена цистоскопия, трансуретральная резекция (ТУР) мочевого пузыря с опухолью. При эндоскопическом исследовании опухоль расположена на передней стенке мочевого пузыря, плотная, бугристая на широком основании, покрыта ярко-розовой слизистой. При ТУР отмечается повышенная кровоточивость сосудов опухоли. Выполнена «холодная» щипковая биопсия стенки мочевого пузыря из ложа удаленной опухоли. Осложнений не было.
Рисунок 1. УЗИ мочевого пузыря a) поперечное сканирование b) продольное сканирование
Рисунок 2. Компьютерная томография a) мультипланарная реконструкция b) поперечный скан (стрелкой указана опухоль)
Рисунок 3. УЗИ мочевого пузыря, допплерография
При морфологическом исследовании удаленной ткани выявлены множественные фрагменты опухоли из переплетающихся пучков мономорфных веретеновидных клеток с низкой митотической активностью, участкамимиксоматоза и отека, с зонами эрозий и изъязвлений, частично выстланные уротелием с реактивными изменениями. Отмечается диффузно-очаговая лимфо-плазмоцитарная инфильтрация с примесью большого количества нейтрофилов и эозинофилов. Морфологическая картина соответствует воспалительной миофибробластической опухоли мочевого пузыря (рис. 4). В биопсии из зоны основания опухоли элементов опухоли не обнаружено.
Рисунок 4. Воспалительная миофибробластическая опухоль мочевого пузыря. Окраска гематоксилином и эозином: a) фрагмент опухоли, выстланный уротелием. х40; b) среди клеток воспалительного инфильтрата определяются скопления гранул гемосидерина. х200; c) пролиферация миофибробластов сопровождается диффузно-очаговой лимфо-плазмоцитарной инфильтрацией, с примесью большого количества нейтрофилов и эозинофилов. х100; d) мономорфные веретеновидные миофибробласты с везикулярными ядрами, вперемешку с клетками воспалительного инфильтрата, расположены в рыхлой и миксоидной строме. х400
При контрольной цистоскопии через 3 и 9 месяцев данных за рецидив опухоли не получено, слизистая мочевого пузыря без патологических изменений. В анализах мочи без патологических сдвигов. В последующем планируется проведение динамического наблюдения, как и за больными с уротелиальной карциномой низкой степени злокачественности.
Заключение
В представленном клиническом наблюдении описан опыт успешного эндоскопического лечения пациентки с редким заболеванием – воспалительной миофибробластической опухолью мочевого пузыря.
Литература
- Santos Lopes S, Furtado A, Oliveira R, Cebola A, Graça B, Ferreira Coelho M, Ferrito F, Gomes C. Infl ammatory Myofi broblastic Tumor of the Bladder: 2 Rare Cases Managed with Laparoscopic Partial Cystectomy. Case Rep Urol. 2016;2016:4976150. doi: 10.1155/2016/4976150
- Etani T, Naiki T, Nagai T, Iida K, Ando R, Naiki-Ito A, Kawai N, Tozawa K, Mizuno K, Okada A, Mogami T, Yasui T. Inammatory Myofi broblastic Tumor of the Urinary Bladder: A Case Report. Case Rep Oncol. 2016;9(2):464-469. doi: 10.1159/000448550
- Inamura K, Kobayashi M, Nagano H, Sugiura Y, Ogawa M, Masuda H, Yonese J, Ishikawa Y. A novel fusion of HNRNPA1-ALK in infl ammatory myofi broblastic tumor of urinary bladder. Hum Pathol. 2017;69:96-100. doi: 10.1016/j.humpath.2017.04.022
Статья опубликована в журнале “Вестник урологии” №4 2017, стр. 79-83
Источник

УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Введение
Опухоли мочевого пузыря составляют до 4% всех опухолевых образований и по показателям смертности занимают 6 место среди других онкологических заболеваний [1,2]. В клинической практике чаще других встречаются эпителиальные опухоли мочевого пузыря, которые обычно представлены переходно-клеточной карциномой или плоскоклеточным раком, реже (в 1-2% случаев) – аденокарциномой. Различают высокодифференцированные поверхностные и низкодифференцированные инвазивные формы новообразований [3]. Клинические симптомы заболевания долгое время могут отсутствовать или выражаться в непостоянной дизурии. Наиболее ранним и самым частым осложнением опухоли мочевого пузыря является гематурия, которая в большинстве случаев становится первым признаком болезни [4,5].
На ранних стадиях заболевания традиционные рентгенологические методы исследования, в том числе цистография с двойным контрастированием в сочетании с введением газа в паравезикальную клетчатку, а также цистоскопия и современные неинвазивные методы лучевой диагностики – КТ, МРТ – не обладают достаточной специфичностью.
Известно, что приблизительно 30-50% больных поступают в стационары с распространенным опухолевым процессом.
После местного хирургического лечения рак мочевого пузыря имеет тенденцию к рецидивированию [6].
Трудность диагностики заключается в том, что многие папиллярные формы рака мочевого пузыря представлены множественными полиморфными эндофитными, узловатыми новообразованиями с отдельными сосочковыми фокусами, ворсинчатыми структурами, иногда имеющими сливной характер, или участками изъязвлений. При этом окончательный диагноз опухоли может быть установлен при биопсии [7,8].
Ведущее место в выявлении новообразований мочевого пузыря на современном этапе принадлежит ультразвуковым методам исследования. Большая клиническая значимость ультразвуковых методов обусловлена их высокой информативностью, безопасностью для пациента и относительной дешевизной исследования. Метод двухмерно-серошкальной эхографии позволяет визуализировать объемные образования, оценивать локализацию, размеры, состояние контуров, эхоструктуру и характер их взаимодействия с окружающими органами и сосудистыми структурами, а также изучать области регионарного метастазирования и одновременно оценивать состояние других органов брюшной полости и, что особенно важно, почек [9].
По данным некоторых авторов [5,10], УЗИ дает возможность установить диагноз опухоли мочевого пузыря у 70-82% больных. При этом, согласно данным Ли-Шен-Ли и соавт. [10], проведение КТ не дает существенной дополнительной информации о распространенности процесса.
Использование традиционного трансабдоминального многоплоскостного ультразвукового сканирования не всегда оказывается достаточно информативным для точного определения объема опухоли, степени инфильтрации стенки мочевого пузыря и определения стадии бластоматозного процесса. Наличие сгустков крови, детрита и солей в полости мочевого пузыря затрудняет ультразвуковую диагностику. Наибольшие трудности возникают при инфильтративных опухолях мочевого пузыря, располагающихся в области его шейки или в мочепузырном треугольнике. Лучшими диагностическими возможностями при поражениях этих отделов обладает трансректальное ультразвуковое сканирование [10].
Режим трехмерного изображения при ультразвуковых исследованиях – новое направление объективной визуализации. В его в основе лежит компьютерная обработка серии эхотомографических срезов с получением целенаправленной объемной реконструкции участка, части органа ткани или патологического очага. Достаточно удобной областью исследования для получения трехмерных изображений является полость малого таза, в частности, мочевой пузырь и прилегающие органы, в связи с естественными анатомическими особенностями и наличием соседствующих сред, резко отличающихся по своим акустическим свойствам.
Цель настоящего исследования – получение в реальном масштабе времени трехмерных ультразвуковых изображений мочевого пузыря при его опухолевых заболеваниях, а также оценка возможностей указанного метода в определении объема новообразования, характера поражения слизистой оболочки, степени инфильтративного роста опухоли.
Материалы и методы
Ультразвуковым методом с построением трехмерного изображения были в динамике обследованы 37 мужчин 37-74 лет (средний возраст – 57,4 года), получающих химиолучевое лечение по поводу рака мочевого пузыря различных стадий в клинике ЦНИРРИ МЗ РФ. Длительность заболевания от появления первых симптомов составляла от 6 мес до 1,5 лет. У всех обследованных в анамнезе отмечены макрогематурия и случаи острой задержки мочи. У 14 пациентов ранее была выполнена трансуретральная резекция мочевого пузыря. Все больные комплексно обследованы с обязательным патоморфологическим подтверждением диагноза. У большинства пациентов опухоль была представлена высокодифференцированными экзофитными узловатыми образованиями переходноклеточного и плоскоклеточного рака.
Трансабдоминальное ультразвуковое исследование выполнялось на цифровом ультразвуковом сканере SA-8800 MT фирмы MEDISON с использованием второй гармоники OHI™ (HD2) с установленной частотой датчика 3 или 3,5 МГц. В процессе исследования получали двухмерные изображения в режиме серой шкалы в трансверзальной и сагиттальной плоскостях с фиксацией срезов, на которых размеры опухолевых образований были наибольшими и расcчитывали объем опухоли по методу площадь – длина с учетом инвазии в стенку мочевого пузыря. При этом наилучшие результаты получали, когда мочевой пузырь не был чрезмерно наполнен. Необходимое количество жидкости в полости мочевого пузыря было в пределах 250-300 мл. Такое наполнение пузыря позволяло полностью помещать исследуемый орган в зону интереса при сканировании и уменьшало количество артефактов. Чтобы снизить возможность артефактов, связанных с движением больного, на время плавного ручного сканирования пациента просили задержать дыхание на 10-15 сек.
Объемную визуализацию в виде трехмерного изображения мочевого пузыря получали включением автоматической обработки, которая осуществлялась с учетом полутоновых градаций для каждого элемента трехмерного изображения вдоль соответствующей проекции выбранного направления движения сканирующего луча. В дальнейшем для улучшения качества трехмерного изображения использовались различные алгоритмы обработки и подбирались соответствующие режимы прозрачной, поверхностной, световой визуализации или их смешивание; для наилучшего выявления опухоли изменяли размер просматриваемого участка и пространственное его расположение. Использовалось цветное изображение в коричневых тонах, позволяющее получать больше информации об отдельных деталях бластоматозного процесса, в особенности о состоянии основания опухоли и степени поражения стенки мочевого пузыря (рис. 1). Использование опции позволяло сохранить трехмерное изображение в форме файла, а применение режима кинопамяти давало возможность просматривать трехмерное изображение под различными углами зрения в виде подвижного.

Рис. 1. Получение 3D изображения на основании реконструкции серии эхотомографических срезов новообразования мочевого пузыря в различных проекциях.
Результаты и обсуждение
В результате УЗ-исследования мочевого пузыря и сканирования подвздошных областей были определены объемы новообразований: до 10 см³ – у 1 пациента, от 10 до 50 см³ – у 21, от 50 до 100 см³ – у 16 пациентов. Инфильтрация стенки мочевого пузыря от подслизистого слоя до полного ее прорастания в той или иной степени наблюдалась у всех обследованных больных. При этом определялась отчетливая прямая зависимость между размером опухоли и распространением процесса на подслизистый и мышечный слои, а прорастание всех слоев стенки мочевого пузыря было выявлено у 14 из 16 пациентов с объемом опухоли более 50 см³.
Метастатическое поражение регионарных лимфатических узлов было выявлено у 6 больных, отдаленные метастазы – у 4. Таким образом, основную группу (27 пациентов) составили больные со II и III стадиями заболевания. У 10 пациентов диагностирован рак мочевого пузыря IV стадии.
На основании клинического, лучевого и лабораторного обследования с учетом анамнестических данных радикальное хирургическое лечение всем этим больным было противопоказано, поэтому проводилось комплексное химиолучевое лечение [11,12]. На первом этапе всем пациентам проводили дистанционное облучение области первичной опухоли. Суммарная очаговая доза составляла в среднем 60-66 Гр. Через 1 мес после окончания лучевой терапии проводилась регионарная внутриартериальная химиотерапия в сочетании с СВЧ гипертермией и селективной гипергликемией, которая по показаниям повторялась через 1-2 мес.
На всех этапах в процессе лечения больным выполнялось контрольное УЗИ мочевого пузыря с построением трехмерных изображений и целенаправленное изучение пораженной стенки мочевого пузыря. Данные ультразвукового исследования были определяющими в оценке эффективности проводимого лечения. Наименьший размер выявленного образования с применением трехмерной эхографии – опухоль в пределах слизистой оболочки диаметром 4 мм (рис. 2).

Рис. 2. Полип мочевого пузыря размером 4 мм (режим 3D).
Полный регресс рака мочевого пузыря с восстановлением структуры слизистой оболочки получен у 5 пациентов. В остальных случаях положительная динамика выражалась в уменьшении размеров опухоли (рис. 3 а-г).
Рис. 3. Динамика регресса рака мочевого пузыря.

а) Массивная опухоль задней стенки мочевого пузыря. Объем опухоли – 72 см², двухмерное изображение.

б) Трехмерное изображение опухоли после реконструкции.

в) Значительное уменьшение объема опухоли после комплексного химиолучевого лечения.

г) Уменьшение объема опухоли наглядно визуализируется на трехмерном изображении.
Уменьшение опухоли на 80% определялось у 9, на 50% – у 21, на 30% – у 7 пациентов. Процесс фиброза в результате химиолучевого воздействия определялся в виде утолщения стенки мочевого пузыря, повышения ее эхогенности и однородности структуры. У всех больных после химиолучевого лечения отмечалось образование спаек в полости малого таза и уплотнение паравезикальной клетчатки (рис. 4 а-в).
Рис. 4. Рак мочевого пузыря.

а) По задней стенке мочевого пузыря отчетливо определяется новообразование.

б) То же новообразование в трехмерном изображении.

в) Через 4 мес после трансуретральной резекции мочевого пузыря и химиолучевого лечения. Признаки фиброза стенки мочевого пузыря и паравезикальной клетчатки.
Выводы
Таким образом, используемый ультразвуковой метод трехмерной реконструкции позволяет выявить опухоли мочевого пузыря на ранних стадиях заболевания и их возможные рецидивы, что является новым направлением в лучевой диагностике, обеспечивающим получение объективной информации о пространственном расположении, форме, виде и объеме патологического образования. Возможность оценить степень прорастания опухолью стенки мочевого пузыря и степень вовлечения в процесс околопузырной клетчатки, соседних органов и тканей позволяет судить о стадии заболевания. В результате использования программ последующей обработки изображений можно с большой точностью судить о степени злокачественности новообразований.
Метод трехмерной реконструкции изображения обеспечивает объективный и качественный контроль за результатами проводимых лечебных мероприятий, в том числе химиолучевой терапии.
Литература
- Гиссов В.И., Старинский В.В., Ременник Л.В. Злокачественные новообразования в Российской Федерации. – М., 1995. – С. 102117.
- Дятченко О.Т., Худолей В.В., Мабашова Н.Я. Злокачественные новообразования в общей системе состояния здоровья населения Российской Федерации // Вопр. онкологии, 1996. – N4. – С. 80-89.
- Карпенко В.С., Романенко А.М., Гойнберг М.И. Эпителиальные опухоли мочевого пузыря. – Здоровья: Киев, 1986.
- Аль-Шукри, Ткачук В.Н. Опухоли мочеполовых органов. – Питер: СПб., 2000. – 310 с.
- Ратобыльский Г.В. К вопросу о трудностях УЗ-диагностики при макрогематурии //SonoAce International, 2000. – Вып. 6. – С. 32-36.
- Wolf N. Prognostic factors in bladder carcinoma // Scand.urol.Nephrol., 1991, v. 138, p. 153-160.
- Карелин М.И. Эндоваскулярная хирургия при кровоточащем раке мочевого пузыря: Автореф. дисс. … канд. мед. наук. – СПб., 1992.
- Barents J.O., Jagez G.J., Vierren P.B.J. et al. Studing urinary bladder cancer after transurethral biopsy: value of fast dynamic contrast – enhanced MR imaging // Radiology, 1996, v. 201, N1, p. 185-193.
- Мухарлямов Н.М. Клиническая ультразвуковая диагностика: Руководство для врачей. – Медицина: М., 1987. – 328 с.
- Ли-Шен-Ли, Ли-Руи-Шен, Лиу Мин-Ху и др. Ультразвуковые признаки кист предстательной железы и перипростатических желез при исследовании трансректальным ультразвуковым датчиком высокого разрешения. //SonoAce International, 1998. – Вып. 2. – С. 27-33.
- Блохин Н.Н., Переводчикова Н.И. Химиотерапия опухолевых заболеваний. – Медицина: М., 1988. – 235с.
- Broodley K.E., Kurowska A., Dick R. et al. The role of embolization in palliative care //Palliat. Med., 1995, v. 9, N4, p. 331-335.

УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Источник
