Мочевой пузырь у плода формируются

Мочевой пузырь начинает развиваться из зародышевого лепестка с 25 дня с момента зачатия и окончательно формируется к 22 неделе беременности. К этому сроку мочевой пузырь достигает размера 8 мм. При трансвагинальном УЗИ орган виден уже на 11 неделе, при трансабдоминальном – с 16-й недели.

Аномалии мочеполовой системы встречаются крайне редко. Часто они связаны с хромосомными нарушениями и сопровождаются целым спектром нарушений и синдромов.
Ультразвуковая диагностика на 2 триместре выявляет 85% патологий. Наиболее часто встречающиеся аномалии мочевого пузыря:
Патологии и аномалии мочевого пузыря у плода
- Мегацистис. Это увеличение мочевого пузыря свыше 8 мм в продольном срезе на УЗИ. Патология обнаруживается на 10-15 неделе беременности. Вместе с ней обычно выявляется нарушение соотношения мочевого пузыря к копчико-теменной зоне (10,4% вместо 5,4%). Мегацистис имеет хромосомную природу и выражается в нарушении уродинамики вследствие закупорки или сращения уретры.
- Обструкция детрузора. Выражается в отсутствии сократительной способности мышечного слоя мочевого пузыря, отвечающего за изгнание мочи. На УЗИ мочевой пузырь имеет грушевидную форму, стенки тонкие, а сам орган увеличен в размерах. В случае обнаружения эхографических признаков патологии плод исследуется методом везикоцентеза. Затем проводят кариотипирование плода, и в случае подтверждения хромосомных отклонений женщину отправляют на аборт. То же самое происходит и при увеличении органа до 20-30 мм вместо положенных 8 мм. Существует вероятность нормализации после 13 недели беременности.
- Экстрофия. Это отсутствие передней стенки мочевого пузыря. На УЗИ мочевой пузырь отсутствует вовсе, но при этом структура почек остаётся без изменений.
- Атрезия. Отсутствие мочевого канала приводит к увеличению мочевого пузыря до таких размеров, что у плода значительно увеличивается объём животика. Женщине рекомендуют прервать беременность, потому что малыш может родиться с тяжёлой гипоплазией лёгких или умереть внутриутробно.
- Задний уретральный клапан. Эта проблема встречается только у мальчиков. У девочек встречается синдром pmne-bUy, который имеет схожие симптомы. Аномалия заключается в том, что из-за внутриутробного нарушения нижняя часть мочеиспускательного канала, выходящая в мочевой пузырь, слишком узкая, из-за чего происходит обратный отток мочи в почку. В результате возникает гидронефроз – скопление в почках лишней жидкости. У плода на УЗИ будут увеличены почки, а мочевой пузырь будет маленьким. Патология исправляется сразу после рождения малыша методом иссечения места патологического сужения уретры. Существует высокий риск гибели младенца из-за гипоплазии лёгких на фоне почечной недостаточности.
- Пузырно-мочеточниковый рефлюкс. В норме мочеточник входит в мочевой пузырь таким образом, что мышечная стенка органа служит клапаном, препятствующим оттоку мочи обратно в почку.
Если мочеточник входит в мочевой пузырь неправильно, то возникает рефлюкс – забросе мочи обратно в мочеточник. Аномалия не является основанием для прерывания беременности, потому что исчезает сама собой в первые 2 года жизни малыша. В тяжёлых случаях проводится хирургическое вмешательство.
Выводы
Патологии мочевого пузыря у плода хорошо видны на скрининговом УЗИ, поэтому такое обследование нельзя игнорировать. Делать скрининговое УЗИ плода нужно только с помощью хорошего оборудования.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter
Поделиться ссылкой:
Источник
Сегодня расскажу об одном пороке развития, который может проявить себя, а значит, может быть заподозрен уже на скрининге 1 триместра.
Prune Belly – синдром включающий в себя целый ряд аномалий развития, среди которых выделяют три основные:
- слабость, недоразвитие передней брюшной стенки
- двусторонний крипторхизм
- аномалии мочеполового тракта
В поисках информации об этом синдроме, каких только вариаций переводов и произношений мне не попалось! И на итальянский манер Прунэ Бэлли, и с французским акцентом Прюно Белли, создавая у меня впечатление, что это имя и фамилия некоего учёного. А также синдром “подрезанного живота” и синдром “сливового живота”, с-м Фрелиха (Frölich) и с-м Обринского.
Prune – это английское слово, которое переводится как слива, хотя в данном контексте имелось в виду другое значение – чернослив, ввиду характерного морщинистого вида передней брюшной стенки, belly переводится как живот.
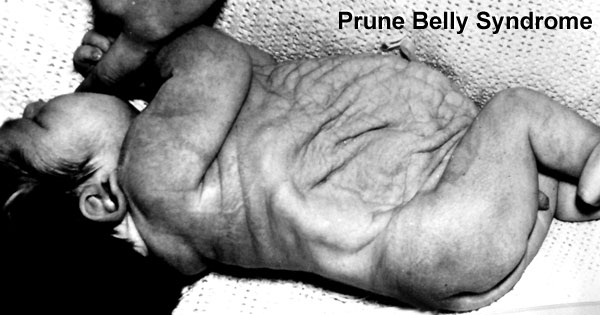
В русскоязычной литературе термин «черносливный живот» не используется, поэтому в дальнейшем буду использовать его английский вариант, думаю, так будет правильнее.
Впервые этот вид дефекта брюшной стенки описал Frölich в 1839г., а термин Prune Belly предложил Osler в 1901г.
Несмотря на то, что именно характерный вид животика ребёнка является отличительной чертой этой аномалии, по которому, обычно, и ставится диагноз новорожденному, лежащие в его основе аномалии мочеполового тракта являются самым важным фактором, определяющим общую выживаемость. Различают широкий спектр тяжести проявлений внутри синдрома. Некоторые дети, с тяжёлыми респираторными и почечными нарушениями погибают в неонатальном периоде, в то время как у других изменения умеренные и поддаются коррекции. Выраженная дисплазия почек, маловодие и, как следствие, гипоплазия лёгких в 20% случаев приводит к антенатальной гибели плода и в 30% к прогрессирующей почечной недостаточности в первые два года жизни ребёнка. Ассоциированные с Prune Belly аномалии мочеполового тракта включают в себя
- гидронефроз
- извилистые расширенные мочеточники
- различной степени дисплазия почек
- увеличенный мочевой пузырь
Кроме того, могут быть вовлечены и другие системы: сердечно-сосудистая, опорно-двигательная, респираторная, желудочно-кишечный тракт.
В 95% случаев встречается у мальчиков, но похожие изменения, включающие отсутствие мышц передней брюшной стенки в сочетании с аномалиями мочеполовой системы, описаны и у девочек.
В качестве иллюстрации, предлагаю историю, найденную мною в свободном доступе на одном из форумов:
“Девочки, кому интересно у меня родился такой ребенок с синдромом Пруне Белли. Начну свой рассказ с того, что ни я, ни мой муж ничем не болеем, беременность протекала хорошо, краску я не нюхала, не пью, не курю, причина данной ситуации так и не найдена, ни у нас, ни в Америке. Да нас конечно огорчила такая ситуация, и если бы мне на сроке 12 недель сообщили об этом, я наверное бы прервала беременность, сейчас же у меня прекрасный ребенок, у которого периодически портятся анализы мочи, это сильно сказывается на почках, ему в будущем требуется операция на брюшную стенку, по поводу крипторхизма, а также по поводу порока сердца, у него плоскостопие, раньше было косолапие, но с 2х недельного возраста мы его гипсовали по методу Пансети, ножки исправились, он ведет себя как обычный ребенок, также лезут зубы садится, встает, ходит, гулит, ну в общем прекрасный малыш, правда делает это все с опозданием на 3-4 месяца. Знаю ребенка с таким же диагнозом как у нас, ему сделали в Англии операцию собрал порядка 4х миллионов рублей и все у него вроде хорошо, тьфу,тьфу,тьфу.
1. У нас малыш на сроке примерно 18 недель начал писить (это мы думали что мочевой уменьшился от того, что он начал писить, но не тут то было, на брюшине образовалась дырочка от сильного давления поэтому мочевой пузырь пришел в норму) мы радовались безмерно прыгали и бегал… недолго.
2. На 20 неделе обнаружили проблемы с почками (двухсторонний гидронефроз), но тут же сказал, и что это лечится мол не переживайте
3. На 24 неделе обнаружили косолапие (сказали что все нормально исправят, мальчикам даже мол оно идет)
4. На 28 неделе крипторхизм…
Набор всех этих показателей и есть Синдром Пруне Белли, но никто из узистов этого не сказал. Так вот, находила информацию в интернете, что кому-то на 12 неделях уже сказали, что у ребенка синдром Пруне Белли, узист увидел тонкую стенку живота у ребенка, у нас никто не видел.”
Существует три основные эмбриологические теории возникновения этого синдрома:
Обструкция выходных отделов мочевого пузыря
Эта теория, предложенная ещё в 1903 году, была позднее обоснована путём воссоздания фенотипических изменений, характерных для Prune Belly, при обструкции мочеиспускательного канала плоду овцы на сроке 43-45 дней гестации. Согласно этой теории, все остальные изменения вторичны. Отсутствие оттока мочи из мочевого пузыря, приводит к значительному его увеличению, растяжению передней брюшной стенки, нарушению её кровоснабжения и атрофии, а также нарушает процесс опущения яичек в мошонку и приводит к формированию гидронефроза и расширению мочеточников.
Однако у людей, обструкция мочеиспускательного канала при этом синдроме встречается в 10-20% случаев. Часть учёных считает, что обструкция может быть проходящей, другие утверждают, что обструкция встречается в самых тяжёлых формах Prune Belly. Согласно эмбриологии плода человека, такие изменения должны проявиться на сроке 13-15 недель, так как к этому времени начинает закрываться урахус и значительно увеличивается продукция мочи плодом.
Не смотря на то, что эта теория достаточно убедительна, она не способна объяснить все изменения, ассоциированные с Prune Belly.
Теория мезодермальной задержки развития
Предполагается, что нарушения мочевыделительного тракта, могут быть объяснены аномальным развитием мезонефроса между 6-й и 10-й неделями. Изменения в развитии Вольфова протока приводят к гипоплазии простаты, замедлению развития простатической части уретры и клапан-подобной обструкции. Однако и эта теория не может включить в себя все аномалии, встречающиеся при данном синдроме.
Теория желточного мешка
Существует гипотеза о том, что при Prune Belly избыточный объём желточного мешка может приводить к аномалиям развития передней брюшной стенки, вследствие вовлечения большей части аллантоиса в формирование мочевого тракта.
Как же заподозрить синдром Prune Belly во время УЗИ?
Первое, что бросается в глаза – это мегацистис, т.е. значительное увеличение размеров мочевого пузыря, а также тонкая, растянутая и выпячивающаяся передняя брюшная стенка. В 10 -14 недель беременности диагноз мегацистис ставится при продольном размере мочевого пузыря, превышающем условный норматив 7 мм. При размерах 8-12мм, в большинстве случаев происходит самостоятельная нормализация, но требуется динамическое наблюдение раз в 2 недели. Это, по-видимому, происходит из-за того, что формирование гладкомышечной мускулатуры и иннервации мочевого пузыря не заканчивается к 13-й неделе гестации и продолжается в последующие дни, что дает основание для саморазрешения проблемы в последующие недели внутриутробного развития плода. Увеличение размеров мочевого пузыря, расширение мочеточников и пиелоэктазия могут встречаться при синдроме мегацистис-мегауретер и при заднем уретральном клапане, но при этих состояниях количество околоплодных вод обычно остаётся нормальным, и нет такого истончения и выбухания передней брюшной стенки. Прогрессирование мегацистиса и маловодие – прогностически неблагоприятные признаки, говорящие об обструкции выходных отделов мочевого пузыря.
Однозначно поставить диагноз синдром Prune Belly в 11-13 недель не представляется возможным, он может быть лишь заподозрен, а основным диагнозом будет Мегацистис, который, как я уже говорил, может быть при различных состояниях.
Что же делать?
Это Ваш ребёнок и выбор, как всегда, приходится делать именно Вам. Но иногда, очень важно, чтобы кто-то снял, принял на себя это бремя ответственности, бремя выбора, который вы должны сделать со своей, да и не только своей жизнью. Очень важно почувствовать, что только лучшее из решений будет принято здесь и сейчас.
Вот рекомендации, опубликованные в статье «Пренатальное консультирование детским урологом и тактика принятия решений при диагностике синдрома «мегацистис» в первом триместре гестации» https://www.lvrach.ru/2015/01/15436142/ :
«Учитывая, что «мегацистис» в 25-40% сочетается с хромосомной патологией, существенную роль для принятия решения о пролонгировании или прерывании беременности играют результаты генетических исследований. Большинство авторов сходятся во мнении, что клапаны задней уретры, а также prune-belle синдром не являются генетически наследуемой патологией, однако это не исключает возможность хромосомных поломок. A. W. Liao констатирует в 25% случаев наличие трисомии по 13-й и 18-й хромосоме при увеличении размеров мочевого пузыря от 7 до 15 мм у плодов 10-14 недель гестации.
Проведенный анализ диагностических мероприятий и исходов течения беременностей позволил разработать диагностический алгоритм, который предполагает обязательное кариотипирование плодного материала при наличии размеров пузыря в пределах 7-15 мм. При подтверждении нарушения кариотипа целесообразно прерывание беременности, в противном случае – динамическое наблюдение до появления убедительных маркеров прогноза диагностируемого состояния.
Значительное исходное увеличение пузыря ≥ 20-30 мм однозначно свидетельствует о выраженной обструкции нижних мочевых путей и не требует динамического наблюдения, целесообразно прерывание беременности.
Наличие расширения верхних мочевых путей не всегда дополняет синдром «мегацистис» в ранние сроки гестации (11-13 недель) и наиболее отчетливо определяется во втором и третьем триместрах гестации. Однако во всех случаях его наличие является фактором, отягощающим прогноз.
Таким образом, подводя итоги анализа литературных данных и результатов собственных наблюдений, очевидны несколько выводов:
- Комплекс мероприятий, входящих в ранний пренатальный скрининг 11-14 недель гестации (молекулярно-генетические и ультразвуковые маркеры ВПР и ХА), не позволяет определить вероятность наличия у плода ВПР мочевыделительной системы. Выделение группы риска плодов, угрожаемых по наличию врожденный патологии МВС, происходит на основании диагностики увеличенного продольного размера мочевого пузыря ≥ 7 мм, что трактуют как синдром мегацистис плода, и требует проведения тщательных диагностических мероприятий, позволяющих прогнозировать исход.
- Синдром «мегацистис плода» рассматривается как проявление выраженных нарушений уродинамики нижних мочевых путей анатомического или функционального генеза, лежащих в основе развития обструктивных нарушений верхних мочевых путей и диспластичного развития почечной паренхимы, включая ее кистозную дисплазию, что предопределяет декомпенсацию почечных функций и неблагоприятный исход.
- Комплекс диагностических процедур, уточняющих прогноз при выделении группы плодов с синдромом мегацистис, включает проведение кариотипирования плодного материала (ворсин хориона) при отсутствии расширения верхних мочевых путей и размерах пузыря ≤ 20 мм и прерывание беременности в случаях выявленной хромосомной патологии.
- Наличие увеличения мочевого пузыря ≥ 20 мм изолированно или при наличии расширений верхних мочевых путей является показанием для прерывания беременности.
- Пролонгирование беременности рекомендовано во всех случаях умеренного расширения пузыря в пределах 7-15 мм при отсутствии расширения верхних мочевых путей, положительной динамики наблюдения в течения 2-3 недель, восстановления размеров мочевого пузыря.
- Проведение диагностических мероприятий и выбор тактических решений должны проводиться при участии детского уролога, включая анте- и постнатальный этап динамического наблюдения и необходимого лечения.”
Источники информации:
https://www.pediatricurologybook.com/prune_belly.html
https://www.lvrach.ru/2015/01/15436142/
До
Источник
Изучение уродинамики нижних мочевых путей является обязательным этапом обследования детей с пороками развития почек и верхних мочевых путей, расстройствами мочеиспускания и энурезом, рецидивирующим течением инфекции мочевыводящих путей, пиелонефритом. Наибольшую значимость и сложность эта проблема приобретает при лечении новорожденных и детей раннего возраста, стертости клинических проявлений нарушений мочеиспускания, сложности проведения специальных уродинамических исследований.
В данном аспекте особую значимость для урологов и нефрологов педиатрического профиля приобретают сведения о физиологии мочеиспускания новорожденных и детей младшего возраста, имеющие определяющее значение для ранней диагностики патологии мочевыделительной системы и предупреждения осложнений.
Физиология мочеиспускания у детей раннего возраста до настоящего времени остается не до конца изученной.
Акт мочеиспускания состоит из двух фаз – фазы накопления мочи и фазы эвакуации мочи. При этом детрузор мочевого пузыря и его сфинктеры (гладкомышечный и наружный, поперечно-полосатый) находятся в реципрокных отношениях: в фазу накопления мочи детрузор расслабляется, а сфинктер сокращен и удерживает мочу; в фазу опорожнения мочи – сокращается детрузор и расслабляется сфинктер, происходит опорожнение мочевого пузыря. Обеспечивает этот процесс сложная регуляторная система, в работе которой участвуют спинной мозг, субкортикальные и корковые центры, система биологически активных веществ и половые гормоны.
В фазу накопления мочи основная роль принадлежит детрузору мочевого пузыря, который обеспечивает адекватную резервуарную функцию (за счет эластичности мышц мочевого пузыря и благодаря системе детрузор-стабилизирующих рефлексов), при этом давление в мочевом пузыре, несмотря на его заполнение, поддерживается на низком уровне (5-10 см водного столба). Эвакуация мочи – сложный рефлекторный акт, во время которого происходит синхронное расслабление внутреннего и наружного сфинктеров мочевого пузыря и сокращение мышцы мочевого пузыря – детрузора. В эвакуации мочи принимают участие также мышцы брюшного пресса и промежности. Нормальное мочеиспускание определяется анатомической и функциональной полноценностью не только сфинктеров и детрузора, но и системой нервных структур, регулирующих этот сложный акт.
Основным вегетативным центром является спинальный центр регуляции мочеиспускания, располагающийся на уровне пояснично-крестцовых сегментов спинного мозга, который, в свою очередь, имеет симпатическое (Th XII – L II-III) и парасимпатическое (L IV-V) представительство. Следует помнить, что парасимпатический отдел отвечает за вегетативное обеспечение сократительной активности детрузора, а симпатический – за его адаптацию (по мере заполнения мочевого пузыря давление в нем не повышается). Соматическое обеспечение поперечно-полосатой мускулатуры тазового дна обеспечивается за счет сакральных сегментов. А вот связь соматического и вегетативного звеньев осуществляется благодаря системе рефлексов, стабилизирующих детрузор. Именно благодаря этой сложной системе и обеспечиваются реципрокные отношения между детрузором и сфинктером (при сокращении детрузора – сфинктер расслабляется, и, наоборот, прекращение мочеиспускания и сокращение сфинктера ведут к восстановлению резервуарной функции мочевого пузыря) [1, 2].
Динамический характер изменений мочеиспускания в процессе роста ребенка затрагивает как увеличение гидродинамических параметров мочеиспускания (объем мочевого пузыря, частота мочеиспусканий, изменение скорости тока мочи), так и контролируемые сознанием характеристики (позыв, умение прерывать мочеиспускание, поведенческие реакции), что в совокупности позволяет констатировать формирование «зрелого» типа мочеиспускания [1].
Традиционная концепция предполагает, что мочеиспускание новорожденного происходит автоматически, за счет спонтанно возникающего рефлекса, замыкающегося на уровне спинного мозга. Однако последние исследования фетальной уродинамики показали, что такое мнение довольно упрощенное. Появились доказательства того, что даже внутриутробно мочеиспускание имеет поведенческие зависимости: отмечены задержки мочеиспускания во время сна плода и максимально частое опорожнение пузыря во время бодрствования плода.
При изучении вопросов физиологии мочеиспускания плодов 19-40 недель гестации с использованием антенатальной ультразвуковой цистометрии при естественном наполнении оценены накопительная, эвакуаторная функции мочевого пузыря, характер мочеиспускания плодов. Уродинамика плодов оценивалась с помощью таких показателей, как максимальный объем мочевого пузыря, продолжительность микционного цикла, процент остаточной мочи, продолжительность выведения мочи, диурез [3, 4].
Отмечено, что с 19-й до 38-40 недели гестации размеры мочевого пузыря возрастают практически в 30-40 раз и составляют в 20 недель 0,65-1,0 мл, а в 40 недель – 25-30 мл. Закономерности темпов роста объема мочевого пузыря опережают темпы роста массы плода, которая за эти же сроки возрастает более чем в 10 раз.
При изучении продолжительности микционного цикла – показателя, эквивалентного ритму спонтанных мочеиспусканий, отмечено его увеличение по мере возрастания срока гестации. Предположено, что плод мочится 72 раза в сутки в 20 недель и 32-36 раз в 38-40 недель.
У большинства плодов опорожнение мочевого пузыря полное. При этом во II и III триместрах беременности допустимым является наличие 10-15% остаточной мочи [3-5].
Характер мочевыведения плода значительно отличается от такового у детей постнатального периода. Наряду с одномоментным мочеиспусканием отмечается фракционное мочеиспускание, чаще встречаемое в III триместре беременности.
Такие характеристики, как фракционный способ опорожнения мочевого пузыря и его неполная эффективность (с остаточной мочой 10-15%), определяют так называемый «фетальный тип мочеиспускания».
Эквиваленты фетальных поведенческих реакций проявляются в виде двигательной активности плода, предшествующей выведению мочи, или преждевременным опорожнением мочевого пузыря в ответ на шумовой раздражитель. Таким образом, в процессе антенатального периода становление мочеиспускания плода осуществляется за счет поддержания функционального режима чередования микционных циклов, формирования основных показателей мочеиспускания: пузырного рефлекса, «фетального» типа выведения мочи, эквивалентов фетальных поведенческих реакций [4, 5]. В течение последнего триместра беременности внутриматочной мочи производится намного больше, чем в постнатальный период (30 мл/час), а частота мочеиспускания плода приблизительно равна 30 раз в сутки [4-6].
В постнатальный период механизмы контроля мочеиспускания претерпевают дальнейшие изменения. Использование амбулаторного мониторинга мочевого пузыря в сочетании с методом полисомнографии показало, что у новорожденных во время сна мочевой пузырь находится в состоянии покоя и мочеиспускание во время сна не происходит [7].
Сразу после рождения мочеиспускание обычно редкое. Первый раз младенец может помочиться через 12 и более часов (до 24 часов). После первой недели частота мочеиспусканий быстро возрастает и достигает максимума в возрасте от 2 до 4 недель и составляет в среднем один раз в час. Затем частота уменьшается и остается стабильной до 6 месяцев – 10-15 раз в день. После первого года число мочеиспусканий уменьшается до 8-10 раз в день. У новорожденных мочеиспускание может иметь прерывистый характер, при этом более чем в 80 процентах мочевой пузырь опорожняется полностью [8]. Для детей до шести месяцев жизни характерным является частое и неполное опорожнение мочевого пузыря, мочеиспускание в два приема, относительно большой объем остаточной мочи, что указывает на функциональную нестабильность мочевого пузыря, которая уменьшается с возрастом и достигает определенной зрелости к одному году [9].
Установлено, что становление функции мочевого пузыря у здоровых детей протекает в три стадии, которые имеют определенную последовательность и четкие возрастные границы. На первой стадии формирования функции мочевого пузыря значительные изменения претерпевает емкость мочевого пузыря, которая на первом году жизни увеличивается в два раза, а к трем годам в шесть раз. Со второго месяца жизни происходят существенные колебания емкости мочевого пузыря в течение дня, что позволяет выделить максимальный и минимальный объемы. Эффективный объем первого после сна мочеиспускания формируется к середине второго года жизни. С 6-8 месяцев до одного года ребенок начинает ощущать и пытаться как-то «сигнализировать» о необходимости мочиться. Идет активное формирование условного рефлекса, формируются кортико-висцеральные (вертикальные) связи, осуществляемые через подкорковые, понтийные центры. Важным моментом на первой стадии формирования емкости мочевого пузыря является период, когда ребенок начинает ходить. В это время отмечается учащение мочеиспускания, уменьшение объема порции мочи, появление «прерывистого» мочеиспускания. С полутора лет у здоровых детей стабильно увеличивается эффективная емкость мочевого пузыря и уменьшается частота мочеиспусканий. В период становления основных черт зрелого мочеиспускания выявлены отличительные особенности уродинамики нижних мочевых путей у детей грудного и раннего возраста. Установлено, что процесс наполнения мочевого пузыря у них осуществляется в условиях базовой гипертензии. Реализация микционного цикла при относительно высоком давлении отражает свойственный этому периоду жизни ребенка гипертонус гладких мышц мочевого пузыря, обеспечивающий высокий автоматизм эвакуации мочи до появления произвольного контроля мочеиспускания [10].
Также отмечено, что давление вытеснения у мальчиков выше, чем у девочек, а до 70% младенцев имеют прерывистое мочеиспускание. Эти более высокие значения давления детрузора и прерывистый характер мочеиспускания постепенно уменьшаются с возрастом в течение 1-2 лет жизни, отражая процесс созревания детрузора и сфинктерной координации. Видеоуродинамические исследования подтверждают эти результаты [8, 11-14]. По мере взросления ребенка, в привитии навыков мочеиспускания и формирования зрелого типа контроля над ним, особую важность приобретают три основных фактора:
1) увеличение емкости мочевого пузыря для обеспечения его резервуарной функции;
2) появление произвольного контроля над поперечно-полосатой мускулатурой (наружный уретральный сфинктер) для обеспечения произвольного начала и окончания акта мочеиспускания, что обычно появляется к третьему году жизни;
3) формирование прямого произвольного контроля над микционным рефлексом, что позволяет ребенку управлять процессом сокращения детрузора собственным волевым усилием.
О «зрелом типе» мочеиспускания можно говорить тогда, когда оно становится полностью управляемым (контролируемым ребенком). Его клиническими признаками являются:
- соответствие объема мочевого пузыря возрасту ребенка;
- адекватное диурезу и объему мочевого пузыря число мочеиспусканий в сутки;
- полное удержание мочи днем и ночью;
- умение задерживать и прерывать при необходимости акт мочеиспускания;
- умение опорожнять мочевой пузырь без предшествующего позыва на мочеиспускание;
- адекватное поведение (стремление к уединению при появлении позыва, приемы непосредственной подготовки к опорожнению мочевого пузыря, переживание при наличии любых его расстройств и пр.) [15, 16].
Сформированный механизм контроля над микционным рефлексом, аналогичный взрослому, у большинства детей складывается к 4-5 годам. Контроль над мочеиспусканием в ночное время имеет более широкие возрастные границы (3-7 лет) [17].
Определение эффективной емкости мочевого пузыря у детей различных возрастов производится по формулам:
- у младенцев: емкость мочевого пузыря (мл) = 38 + (2,5 × возраст (мес)) [14];
- у детей с одного года жизни: емкость мочевого пузыря (мл) = 30 + 30n, где n – возраст в годах [18].
Таким образом, знание сложных и многокомпонентных регуляторных механизмов мочеиспускания поможет разобраться в этиопатогенезе расстройств мочеиспускания и недержания мочи у детей. Тем не менее, следуя диагностическому протоколу, разработанному на основании рекомендаций Международного общества по удержанию мочи у детей (International Children’s Continence Society, ICCS), можно, проведя необходимые исследования, четко дифференцировать различия в причинах и характере недержания мочи, назначить лечение, обоснованное патогенетически, провести курс реабилитации и добиться выздоровления [19].
Работа выполнена в рамках государственного задания Минздрава России «Разработка тактики постнатального лечения детей с антенатально выявленными пороками мочевыделительной системы».
Литература
- Джавад-Заде М. Д., Державин B. M., Вишневский Е. Л. и др. Нейрогенные дисфункции мочевого пузыря. М.: Медицина. 1989. 384 с.
- Franco I. Overactive bladder in children. Part 1: Pathophysiology // J Urol. 2007; 178 (3 Pt 1): 761-8.
- Дерюгина Л. А. Антенатальная диагностика врожденных заболеваний мочевыводящей системы и обоснование тактики ведения детей в постнатальном периоде. Автореф. дис. … д.м.н, 2008. 50 с.
- Дерюгина Л. А., Морозов Д. А. Становление мочевыведения плода на этапах гестации // Детская хирургия. 2007. № 6. С. 22-27.
- Дерюгина Л. А. Расстройства уродинамики нижних мочевых путей у плодов // Детская хирургия. 2007. № 3. С. 30-34.
- Goelllner M. H., Ziegler E. E., Fomon S. J. Urination duringtheFirst 3 yearsof life // Nephron. 1981; 28: 174-178.
- Yeung C. K., Godley M. L., Ho C. K. W., Ransley P., Duffy P. G., Chen C. N., Li A. K. C. Somt ntw insights into bladder in infancy // Br J Urol. 1995; 6; 235-240.
- Yeung C. K., Godley M. L., Duffy P. G., Ransley P. G. Natural filing cystometry in infants and children // Br J Urol. 1995; 75: 531-537.
- Николаев Н. С. Диагностика и лечение дисфункций мочевого пузыря у детей раннего возраста. Автореф. дис. … к.м.н., 2003. 27 с.
- Рудакова Э. А. Дисфункции мочевого пузыря у детей раннего возраста. Автореф. дис. … д.м.н., 1995. 28 с.
- Yeung C. K., Godley M. L., Dhillon H. K., Duffy P. G., Ransley P. G. Urodynamic patterns in infants with normal lover urinary tracts or primary vesico-ureteric reflux // Br J Urol. 1998; 81: 461-467.
- Bachelard M., Sillen U., Hansson S., Hermansson G., Jodal U., Jacobsson B. Urodinamic pattern in asymptomatic infants: siblidings of children with vesico-ureteric reflux // J Urol. 1999; 162: 1733-1737.
- Sillen U., Solsnes E., Yellstrom A. I., Sandberg K. The voiding pattern of healthy preterm neonates // J Urol. 2000; 163: 278.
- Holmdahl G., Hansson E., Hansson M., Hellstrom A.-L., Hjälmås K., Sillen U. Four hour voiding observation in healthy infants // J Urol. 1996; 156: 1809-1812.
- Yeates W. K. Bladder in normal Micturition. In: Kolvin I., MacKeith R. C., Meadow S. R. (eds). Bladder Control and Enuresis. London, W Heinemann Medical, 1973. 28-365.
- Вишневский Е. Л., Лоран О. Б., Вишневский А. Е. Клиническая оценка расстройств мочеиспускания. М.: Терра, 2001. 96 с.
- Hellstrom A. L., Hansson E., Hansson S., Hjälmås K., Jodal U. Micturition habits and incontinence in 7-year-old Swedish school entrants // Eur J Pediatr. 1990; 149 (6): 434-437.
- Koff S. A. Estimating bladder capacity in children // Urology. 1983; 21: 248-251.
- Основные принципы диагностики и лечения расстройств мочеиспускания у детей и подростков. Методические рекомендации № 10. М., 2013. 40 с.
Т. В. Отпущенникова, кандидат медицинских наук
ФГБОУ ВО СГМУ им. В. И. Разумовского, Саратов
Контактная информация: tkatina1@yandex.ru
Физиологические аспекты мочеиспускания у детей раннего возраста/ Т. В. Отпущенникова
Для цитирования: Лечащий врач № 9/2018; Номера страниц в выпуске: 26-28
Теги: энурез, пиелонефрит, нижние мочевые пути, условный рефлекс
Источник
