Мочевого пузыря шейки и предстательной железы

У больных доброкачественной гиперплазией предстательной железы (ДГПЖ) основными причинами, заставляющими их обращаться за медицинской помощью, являются расстройства мочеиспускания, проявляющиеся в виде его затруднения, или в виде гиперактивности мочевого пузыря. Расстройства мочеиспускания выявляются также у больных с хроническим простатитом, причем даже в тех случаях, когда его этиология не связана с бактериальной инфекцией (формы IIIb и IV) [1, 2].
Многочисленные данные свидетельствуют о наличии анатомических и функциональных взаимосвязей между мочевым пузырем (МП) и предстательной железой (ПЖ). Эмбриологически мочевой пузырь и предстательная железа развиваются из одного источника – урогенитального синуса. Оба органа имеют общее кровоснабжение – основная масса предстательной железы кровоснабжается ветвями нижних мочепузырных артерий, а венозный отток осуществляется через сообщающиеся мочепузырное и простатическое сплетения. Кроме этого МП и ПЖ имеют общую иннервацию из нижнего подчревного сплетения.
Предстательная железа играет важную роль в обеспечении механизма удержания мочи и акта мочеиспускания. Удержание мочи связано не только с состоянием внутреннего и наружного сфинктеров уретры, но и с тонусом простатического и мембранозного участка мочеиспускательного канала, который обеспечивает поддержание внутриуретрального давления на значениях, превышающих внутрипузырное давление даже при переполнении мочевого пузыря [3, 4]. Большое значение в этом механизме имеет тонус гладкомышечных клеток ПЖ. Терапия α-адреноблокаторами снижает их тонус, также как и тонус детрузора [5-7].
Таким образом, хотя МП и ПЖ относят к разным функциональным системам – мочевой пузырь к мочевой системе, а предстательную железу к половой системе, – но анализ их функциональных взаимоотношений дает основание рассматривать оба органа, как единую функциональную систему, обеспечивающую регуляцию функции накопления и эвакуации мочи [8].
Нами были проведены исследования функциональных и регуляторных взаимосвязей МП и ПЖ в норме, при моделировании острой задержки мочи (ОЗМ) и при экспериментально вызванной ДГПЖ с целью подтверждения этого положения.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты проведены на 30 половозрелых белых беспородных крысах-самцах массой 280-320 г. Животные содержались в стандартных условиях вивария на стандартном рационе питания. Все эксперименты проводили с соблюдением принципов Европейской конвенции о гуманном отношении к животным. Опыты обязательно проводились в условиях общего обезболивания (ингаляция паров эфира). Эвтаназия животных производилась избыточным введением наркотического вещества.
Для изучения функциональных взаимосвязей МП и ПЖ в норме (8 экспериментов) под эфирным наркозом выполняли нижне-срединную лапаротомию. В рану выводили МП и ПЖ, выделяя их из окружающих тканей. Ко дну и шейке МП, а также к обеим боковым долям ПЖ подшивали хлорсеребряные электроде. МП пунктировали в области верхушки укороченным внутривенным катетером диаметром 1,1 мм, соединенным через 3-ходовой кран с датчиком давления и системой для внутрипузырного введения физиологического раствора. Электроды и датчик давления подключали к аппаратнопрограммному комплексу (производство НПК «Биола», Россия) для одновременной регистрации импеданса органов и внутрипузырного давления. С помощью спектрального анализа колебаний импеданса по методу Фурье определяли характерные частотные пики, отражающие состояние интраорганного кровообращения на частоте сердцебиений (пик С1), активность симпатической нейрогенной регуляции (пик М1) и парасимпатической регуляции (пик R1) (рис. 1). Выраженность пиков рассчитывали количественно по специальной программе в мОм [9, 10].
Таблица 1. Изменение пика С1, характеризующего состояние кровоснабжении органов при ОЗМ (мОм)
| Этап исследования | Мочевой пузырь | Предстательная железа |
|---|---|---|
| Норма | 38±3 | 41±3 |
| 4 часа ОЗМ | 15±1*** | 28±2** |
| Ликвидация ОЗМ | 17±1** | 29±2** |
| Через 1 сутки | 23±2** | 33±1* |
Достоверность различий по сравнению с нормой: * p<0,05, ** p<0,01, ***-p<0,001.
Функциональные параметры регистрировали при опорожненном МП и в процессе инфузионной цистометрии при постепенном его наполнении физиологическим раствором через цистостомический катетер.
В 14 опытах вызывали острую задержку мочи (ОЗМ) путем пережатия уретры микрососудистой клипсой на 4 часа с регистрацией вышеуказанных показателей после снятия зажима и через 1 сутки.
В хроническом эксперименте на 8 крысах моделировали ДГПЖ путем введения комплекса эфиров тестостерона (препарат Сустанон-250), 4 инъекции с 7-дневным интервалом из расчета 3 мг чистого тестостерона на 1 кг веса в сутки. У этих крыс регистрировали те же параметры, что на фоне опорожненного мочевого пузыря и в процессе инфузионной цистометрии.
Полученные цифровые данные обрабатывали статистически с использованием t-критерия Стьюдента и коэффициента корреляции Пирсона при помощи программ Excel 2010 и istica 8.0.

Рис. 1. Типичный спектр ЭКГ (1) и колебаний импеданса (2) мочевого пузыря интактной крысы
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты исследований у интактных крыс показали, что наполнение мочевого пузыря до максимальной емкости (начало подтекания мочи по уретре, повышение внутрипузырного давления с 6±1 до 38±2 см водн. ст.) приводило к интенсификации интраорганной гемодинамики (увеличение кардиального пика С1) не только в МП, но и в ПЖ (рис. 2).

Рис. 2. Синхронное изменение параметров гемодинамики (значения пика С1, мОм) в мочевом пузыре и предстательной железе при переполнении мочевого пузыря
Эти изменения с высокой степенью достоверности коррелировали между собой (коэффициент корреляции Пирсона r=0,814, p< 0,001).
При экспериментально вызванной 4-х часовой ОЗМ, как и при остром переполнении мочевого пузыря, происходят синхронные изменения интрамурального кровотока в обоих органах. В этой ситуации на фоне повышения внутрипузырного давления до 48±4 см водн. ст. происходит ухудшение кровоснабжения (уменьшение значений пика М1) как в самом МП, так и в ПЖ (табл. 1). При этом сниженная гемоперфузия обоих органов не нормализуется даже на следующие сутки после ликвидации обструкции. Определение взаимосвязи между изменением кровоснабжения мочевого пузыря и предстательной железы выявило высокодостоверную положительную корреляцию изменений (коэффициент корреляции Пирсона r=0,638, p< 0,01).
У крыс с ДГПЖ, вызванной андрогенной стимуляцией, исходные показатели кровоснабжения МП и ПЖ при опорожненном мочевом пузыре оказались достоверно сниженными по сравнению с интактнымит крысами (p< 0,05) (табл. 2). При инфузионной цистометрии на фоне максимального наполнения МП (рост внутрипузырного давления с 8±1 до 44±3 см водн. ст.) происходило дальнейшее ухудшение микроциркуляции в обоих органах.
Таким образом, как в физиологических условиях, так и при экспериментально вызванных нарушениях состояния одного из органов (для мочевого пузыря – ОЗМ, для предстательной железы – ДГПЖ) происходят однонаправленные изменения кровотока в обоих органах – интенсификация при физиологическом наполнении МП и ухудшение – при патологических состояниях.
Синхронность изменений параметров кровоснабжения шейки МП и ПЖ у больных с ДГПЖ и хроническим простатитом при их медикаментозном лечении выявляли Ю.М. Есилевский[11] и др. [12-13].
Синхронное изменение кровоснабжения МП и ПЖ опосредуется сдвигами в их автономной нервной регуляции, которые носят иной характер, но тем не менее характеризуют функциональную взаимосвязь обоих органов. В норме переполнение мочевого пузыря сопровождалось сменой преобладания симпатической активности (отношение пиков М1/R1>1) на преобладание парасимпатической активности (M1/R1< 1) (рис. 3А), что соответствует современным представлениям о расслабляющем действии стимуляции β-адренорецепторов на детрузор, обеспечивая накопительную функцию этого органа и активации М-холинорецепторов детрузора для обеспечения его сокращения и эвакуации мочи [14]. В ПЖ при переполнении МП отмечалось относительное возрастание активности парасимпатической нейрогенной регуляции (M1/R1< 1), что может характеризовать увеличение тонуса гладкомышечных клеток ПЖ и увеличение сопротивления уретры, то есть, способствовать повышению эффективности механизма удержания мочи.
У крыс с ДГПЖ при наполнении МП относительная симпатическая нейрогенная активность в этом органе вместо уменьшения нарастала (рис. 3Б), что может быть связано с усилением его накопительной функции и увеличением емкости мочевого пузыря (с 0,63±0,04 до 0,95±0,06, p< 0,05). В ПЖ при этом возрастала относительная значимость парасимпатической активности, также способствуя удержанию мочи.
Функциональная значимость выявленных изменений состоит в том, что сократительная активность выходного отдела МП и ПЖ опосредуется активацией парасимпатического отдела автономной нервной системы, реализуемой через М3-холинорецепторы [15, 16], в связи с чем преобладание холинэргических влияний на гиперплазированную ПЖ может инициировать повышение ее тонуса, увеличивая сопротивление уретры току мочи. Однако, взаимосвязь между изменением соотношений симпато-вагусной регуляции МП и ПЖ может быть сложнее, как показали данные А. Rosen и соавт. о синэргичном действии симпатической и парасимпатической систем в реализации сокращения выходного отдела мочевого пузыря и предстательной железы [15].
Еще одним доказательством функциональных взаимосвязей МП и ПЖ является взаимосвязанность колебаний их тонуса в процессе наполнения МП. Даже в накопительную фазу детрузор циклически меняет свой тонус. Отражением этого являются относительно небольшие колебания внутрипузырного давления, составляющие в норме 3,1±0,3 см водн. ст. Одновременная регистрация тонуса ПЖ, оцениваемого по колебаниям импеданса этого органа, показала, что они совпадают по частоте, несколько сдвигаясь во времени (рис. 4).
При этом повышение внутрипузырного давления сопровождается увеличением тонуса ПЖ. Амплитуда колебаний тонуса ПЖ и внутрипузырного давления по мере наполнения МП возрастали синхронно.
Эти данные подтверждают участие ПЖ в механизме удержания мочи в фазу накопления.
У крыс с ДГПЖ также выявлялась синхронность колебаний тонуса ПЖ и внутрипузырного давления, но эти колебания происходили с более высокой частотой и возрастание тонуса ПЖ несколько опережало периоды подъема внутрипузырного давления или происходило одновременно с ними (рис. 5). Эти данные свидетельствуют, что и в патологических ситуациях сохраняется общность регуляции состояния МП и ПЖ.

Рис. 3. Динамика симпатико-парасимпатических нейрогенных влияний (отношение пиков М1/R1 в спектрограмме) мочевого пузыря и предстательной железы при инфузионной цистометрии в норме (А) и при ДГПЖ (Б)

Рис. 4. Пример одновременной записи колебаний импеданса предстательной железы, характеризующего тонус органа, и внутрипузырного давления в мочевом пузыре интактной крысы

Рис. 5. Пример одновременной записи колебаний импеданса предстательной железы и внутрипузырного давления в мочевом пузыре крысы с ДГПЖ
Таблица 2. Изменение кровоснабжения мочевого пузыря и предстательной железы (значения пика С1, мОм) у крыс с ДГПЖ при инфузионной цистометрии
| Наполнение мочевого пузыря | Мочевой пузырь | Предстательная железа |
|---|---|---|
| Опорожненный МП | 16±1 | 33±2 |
| Наполненный МП | 12±1* | 27±1* |
ЗАКЛЮЧЕНИЕ
Полученные результаты характеризуют синхронность функционирования МП и ПЖ в обеспечении функции удержания и изгнания мочи, которая обеспечивается общностью механизмов регуляции кровоснабжения и взаимодействием нейрогенных регуляторных воздействий на эти органы. Совокупность полученных нами данных позволяет рассматривать мочевой пузырь и предстательную железу, как единую функциональную систему.
ЛИТЕРАТУРА
1. Доброкачественная гиперплазия предстательной железы. [Под ред. Н.А. Лопаткина]. М. 1999. 216 c.
2. Родоман В.Е., Авдошин В.П., Колдесников Г.П. Заболевания предстательной железы. М., МИА. 2009. 672 с.
3. Brading AF. The physiology of mammalian urinary outflow tract. // Experimental Physiology. 1999. Vol. 84. P. 215-221.
4. Vírseda M, Salinas J, López A, Esteban M. Usefulness of Dynamic Urethral Resistance Relation (DURR) measurement for differential diagnosis between ic and dynamic urinary obstruction in male spinal cord injury patients. // Neurourol Urodyn. 2012. Vol. 31, N 4. P. 549-555.
5. Chakrabarty B, Dey A, Lam M, Ventura S, Exintaris B. Tamsulosin modulates, but does not abolish the spontaneous activity in the guinea pig proe gland. // Neurourol Urodyn. 2014. Vol. 34, N 5. P. 482-488.
6. Angulo J, Cuevas P, Fernández A, La Fuente JM, Allona A, Moncada I, Sáenz de Tejada I. Tadalafil enhances the inhibitory effects of tamsulosin on neurogenic contractions of human proe and bladder neck. // J Sex Med. 2012. Vol. 9, N 9. P. 2293-2306.
7. Oger S, Behr-Roussel D, Gorny D, Lebret T, Denoux Y, Alexandre L, Giuliano F. Combination of alfuzosin and tadalafil exerts an additive relaxant effect on contractions of human proe and bladder neck. // J Sex Med. 2012. Vol. 9, N 9. P. 2293-2306.
8. Ourad W, Chaïbi P,Thomas C, Lahlou A, Hached D, Bussy C, Piette F, Robain G. Anatomo-physiological aspects of the lower urinary tract in men and modifications to ageing. // Presse Med. 2003. Vol. 32, N 23. P. 1081-1084.
9. Нестеров А.В., Гаврилов И.Ю., Селектор Л.Я. Фурье-анализ вариаций биоимпеданса пальца человека. БЭБиМ, 2010. Т.150, N 7. C. 31-37.
10. Мудрая И.С., Ибрагимов А.Р., Кирпатовский В.И., Ревенко С.В., Несторов А.В., Гаврилов И.Ю.. Оценка функционального состояния мочевого пузыря крыс методом Фурье-импедансной цистометрии. // Экспериментальная и клиническая урология. 2010. N 3. C. 21-27.
11. Есилевский Ю.М. Действие ингибиторов фосфодиэстеразы 5-го типа на гемодинамику пузырно-уретрального сегмента. // Мат. XIII Конгресса Российского общества урологов. Москва. 2013. С. 319-320.
12. Shibata Y, Kashiwagi B, Ono Y, Fukabori Y, Suzuki K, Honma S, Yamanaka H. The evaluation of rat proe blood flow using a laser speckle flowmetry: a comparative study using the microsphere method in castrated and androgen-replenished rats. // Urol Res. 2004. Vol. 32, N 1. P. 44-48.
13. Bertolotto M, Trincia E, Zappetti R, Bernich R, Savoca G, Cova MA. Effect of Tadalafil on proe haemodynamics: preliminary evaluation with contrast-enhanced US. // J Pharmacol Exp Ther. 2011. Vol. 339, N 3. P. 870-877.
14. K-E Andeon. The pharmacological perspective: role for the sympathetic nervous system in micturition and sexual . // Proe Cancer and Proic Diseases. 1999. Vol. 2, Suppl 4. P. 5-8.
15. Roosen A, Blake-James BT, Wood D, Fry CH. Clinical and experimental aspects of Adreno-muscarinic synergy in the bladder base and proe. // Neurourol Urodyn. 2009. Vol. 28, N 8. P. 938-943.
16. White CW, Short JL, Haynes JM, Matsui M, Ventura S. Contractions of the mouse proe elicited by acetylcholine are ted by M(3) muscarinic receptors. // J Pharmacol Exp Ther. 2011. Vol. 339, N 3. P. 870-877.
Ключевые слова: физиология и патофизиология мочевой системы, острая задержка мочи, доброкачественная гиперплазия предстательной железы, экспериментальное моделирование заболеваний
Источник
Склероз шейки мочевого пузыря – это рубцовая деформация уретро-везикального перехода, обусловленная травматическими воздействиями, воспалительными процессами. Проявляется затруднением мочеиспускания, вялостью струи мочи, дизурическими явлениями. Диагностируется при помощи урофлоуметрии, ретроградной и микционной уретрографии, УЗИ мочевыводящих органов, МСКТ цистоуретрографии, задней уретроскопии, цистоскопии. Лечится оперативно путем трансуретральной резекции склерозированного участка. Хирургическое вмешательство дополняют антибактериальной и противовоспалительной терапией, при выраженной обструкции или обтурации предваряют эпицистостомией.
Общие сведения
По результатам исследований в сфере клинической урологии, склеротическая деформация с сужением просвета мочепузырно-уретрального сегмента выявляется у 0,4-1,5% пациентов, перенесших операцию по поводу доброкачественной гиперплазии простаты. Менее распространены случаи заболевания, обусловленные другими причинами. Вероятность развития склероза зависит от способа выполнения аденомэктомии. Реже всего рубцовая деформация возникает после ТУР гольмиевым лазером и биполярной плазменно-кинетической резекции, чаще всего – после чрезпузырной аденомэктомии. Обычно заболевание диагностируют у мужчин в возрасте после 45 лет, идиопатическая врожденная форма болезни может проявляться даже у младенцев.
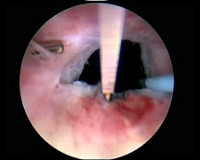
Склероз шейки мочевого пузыря
Причины
Заболевание имеет полиэтиологическую основу, может быть как приобретенным, так и врожденным. Склеротические процессы в области шейки пузыря обычно вторичны, развиваются на фоне другой урологической патологии или под действием различных повреждающих факторов. Непосредственными причинами возникновения склероза в зоне мочепузырного треугольника являются:
- Хирургическое лечение урологических заболеваний. Обычно склеротические изменения выявляются у пациентов, перенесших открытые и эндоскопические операции по поводу аденомы предстательной железы. Реже интенсивное склерозирование начинается после лучевой терапии рака мочевого пузыря или простаты.
- Воспаление органов мочевыделительной системы. Вероятность склероза в области мочепузырно-уретра льного перехода увеличивается при хронических простатитах и циститах. В таких случаях регенеративная фаза воспаления принимает патологический характер, в пораженных участках формируется плотная соединительная ткань.
- Дизэмбриогенез. Идиопатическая форма склероза мочепузырной шейки носит название болезни Мариона. Патология встречается редко, характеризуется кольцевидным фиброзом подслизистого и мускульного слоев на выходе из мочевого пузыря. Факторы, способствующие возникновению врожденного склероза, пока не установлены.
Анатомической предпосылкой к развитию заболевания являются особенности строения стенки пузыря в области мочепузырного треугольника. Соединительная ткань собственной пластинки под уротелием этой зоны отличается меньшей рыхлостью, из-за чего слизистая оболочка менее растяжима и практически не имеет складок. В результате склеротические изменения плохо компенсируются и быстро проявляются клинически.
Патогенез
Механизм склерозирования шейки мочевого пузыря основан на чрезмерном разрастании соединительнотканных элементов при патологической регенерации поврежденных тканей. Как правило, предрасполагающими факторами к появлению склеротических изменений являются нарушение энергетического метаболизма в стенке органа, локальная воспалительная реакция, клеточная дистрофия, микроциркуляторные нарушения, характерные для доброкачественной гиперплазии предстательной железы. Иногда процесс провоцируется действием прямых повреждающих факторов (операционной травмы, лучевого излучения).
Склероз мочепузырной стенки формируется поэтапно. Сначала после фагоцитоза разрушенных клеток и коллагеновых волокон макрофагами в зоне повреждения происходит активная пролиферация фибробластов, усиливается синтез коллагена. В условиях ишемии, посттравматического воспаления, дисциркуляторных явлений нарушается баланс между коллагеногенезом и коллагенолизисом с нарастанием избытка соединительной ткани, преобладанием массы волокон над клеточными элементами, уменьшением количества специализированных клеток. В результате шейка мочевого пузыря подвергается фиброзированию, склерозированию или рубцеванию с частичным сужением (стриктурой) или полным перекрытием (облитерацией) просвета, что проявляется соответствующей клинической картиной.
Симптомы
Основным клиническим признаком заболевания является нарастающее ухудшение оттока мочи вплоть до ее полной острой задержки. На начальных этапах патологического процесса пациенты жалуются на затруднения при мочеиспускании, отмечают вялость мочевой струи. По мере прогрессирования склероза и увеличения количества остаточной мочи в полости органа у больных появляется ощущение неполного опорожнения мочевого пузыря. О присоединении воспаления свидетельствуют частые позывы к мочеиспусканию, болезненное отхождение мочи, повышение температуры тела до субфебрильных цифр.
Осложнения
Нарушение оттока мочи постепенно приводит к увеличению ее остаточного объема и застою в вышерасположенных органах мочевыделительной системы. В крайних случаях расширение мочеточников и чашечно-лоханочной системы завершается развитием двухстороннего уретерогидронефроза и хронической почечной недостаточности. Наличие пузырно-мочеточникового рефлюкса способствует восходящему распространению уроинфекций с возникновением уретерита, пиелонефрита.
На фоне мочепузырного застоя мочи чаще наблюдаются хронические циститы, могут сформироваться микродивертикулы. У некоторых пациентов происходит сморщивание мочевого пузыря. Длительное нарушение мочеиспускания способствует появлению невротических расстройств, депрессии, социальной дезадаптации пациентов.
Диагностика
Обследование мужчин с подозрением на склероз шейки мочевого пузыря включает инструментальные методы, позволяющие выявить признаки сужения участка пузырно-уретрального перехода, исключив другие причины обструкции. Важную роль в диагностическом поиске играет связь патологического процесса с проведенной операцией на простате, лучевой терапией тазовых органов, урологическими инфекциями. Наибольшей информативностью обладают:
- Уродинамические исследования. При сохраненном мочеиспускании пациентам обычно назначают урофлоуметрию. Длительное нарастание и уменьшение объемной скорости тока мочи подтверждает обструкцию нижних отделов мочевыделительной системы, однако не позволяет выявить точное место стеноза. Поэтому методика обычно предваряет проведение других инструментальных исследований.
- Уретрография. Рентгенологический метод дает возможность обнаружить препятствие току мочи в области перехода мочевого пузыря в уретру, при этом уретральный канал остается полностью проходимым. Чаще применяется ретроградная уретрография, визуализирующая заполнение мочеиспускательного канала рентген-контрастным раствором, реже – микционное исследование процесса мочевыделения.
- Эхография. С помощью УЗИ мочевого пузыря оценивают анатомические особенности строения органа, в том числе пузырно-уретрального сегмента, определяют его вместимость и объем остаточной мочи, который при склерозе шейки обычно превышает 20 мл. Дополнительное ультразвуковое исследование почек, мочеточников, простаты (при ее наличии), уретры позволяет установить другие причины нарушения мочеиспускания.
- Мультиспиральная компьютерная томография. МСКТ цистоуретрография, обеспечивающая создание трехмерной модели пораженной области – один из наиболее точных неинвазивных методов диагностики склероза. Используя МСКТ, можно точно определить место стриктуры нижних мочевыводящих путей, выраженность склеротических изменений, толщину стенки везикально-уретрального перехода.
- Эндоскопия. Визуализация пораженной области при уретроцистоскопии дает возможность не только выявить участок стриктуры, но и оценить состояние слизистой оболочки, степень рубцовых изменений. При достаточном для прохождения эндоскопа просвете шейки осматривается полость мочевого пузыря. Обследование может дополняться биопсией для гистологического исследования тканей.
Общий анализ мочи при склерозе мочепузырной шейки играет вспомогательную роль, направлен на выявление возможных сопутствующих воспалительных процессов. Заболевание дифференцируют с аденомой предстательной железы, ложным ходом из мочеиспускательного канала в мочевой пузырь, предпузырем мочевого пузыря, склерозом простаты, злокачественными и доброкачественными опухолями мочевого пузыря. По показаниям врач-уролог может назначить консультацию онколога, андролога.
Лечение склероза шейки мочевого пузыря
Эффективная консервативная терапия заболевания не предложена. Единственный метод восстановления проходимости уретро-везикального сегмента – хирургическое иссечение рубцовой ткани. Эффект от ликвидации стриктуры с помощью бужирования временный, проведение этого вмешательства зачастую приводит к возникновению различных осложнений.
На этапе предоперационной подготовки и в послеоперационном периоде пациенту проводится антибактериальная терапия для профилактики инфекционных осложнений. При наличии признаков воспаления и болевого синдрома возможно дополнительное назначение нестероидных противовоспалительных средств. Для быстрой разгрузки мочевыделительной системы при значительной обструкции шейки предварительно может выполняться открытая или троакарная эпицистостомия.
Наиболее эффективным и наименее травматичным вмешательством для восстановления нормального пассажа мочи является ТУР шейки мочевого пузыря. При трансуретральной резекции склерозированные ткани полностью удаляются лазерными либо электрокоагуляционными ножами, что позволяет устранить обструкцию. Открытые инвазивные операции на мочепузырной шейке из-за травматичности и высокого риска осложнений в настоящее время практически не применяются.
Прогноз и профилактика
Эффективность хирургического лечения склеротической деформации мочепузырной шейки достигает 91%, однако при значительном сужении ее просвета возрастает риск послеоперационных рецидивов. Профилактика склероза направлена на адекватную своевременную терапию урологических заболеваний, щадящее выполнение аденомэктомии, других вмешательств на простате и мочевом пузыре. Для предотвращения рецидива обструкции после ТУР рекомендовано использование современных высокоэнергетичных генераторов, работающих в режиме менее травматичного биполярного резания и коагуляции.
Источник
