Метод лечения при инвазивном раке мочевого пузыря
Табл. 10.1. Рекомендации по ТУР
Таблица 10.2. Выводы по дистанционной ЛТ
Таблица 10.3. Рекомендации
Таблица 10.4. Выводы по ХТ
Таблица 10.5. Рекомендации
Таблица 10.6. Выводы по мультимодальному лечению ИРМП
Таблица 10.7. Рекомендации
10. СТРАТЕГИИ СОХРАНЕНИЯ МОЧЕВОГО ПУЗЫРЯ ПРИ ЛОКАЛИЗОВАННОЙ ОПУХОЛИ
10.1. Трансуретральная резекция опухоли мочевого пузыря
Почти половине пациентов с первоначальным диагнозом ИРМП стадии рТ0 или рТ1, подтвержденной при повторной резекции, после проведения только ТУР опухоли мочевого пузыря в дальнейшем требуется выполнение радикальной цистэктомии по поводу развития рецидива, при этом уровень смертности, связанной с заболеванием, в данной группе достигает 47 % [1, 2].
При проведении диагностической ТУР наличие или отсутствие рецидива считается ключевым моментом в выборе решения об отказе от выполнения радикальной цистэктомии [3, 4]. Недавно опубликованы результаты 15-летнего наблюдения в проспективном исследовании, проведенном Solsona [3] и включавшем 133 пациента после радикального ТУР мочевого пузыря с отрицательным результатом биопсии [5]. Больным регулярно выполнялась цистоскопия с биопсией и в зависимости от результата проводилось дополнительное лечение. Только в 6,7% случаев при первичном ТУР стадия была недооценена, у 30% больных были рецидив неинвазивного РМП и им проводилась внутрипузырная терапия, у 30% отмечалось прогрессирование (n=40), 27 из них умерли от РМП. Показатели 5-, 10- и 15-летней канцер-специфической выживаемости составили 81,9; 79,5 и 76,7% соответственно, а выживаемости без прогрессирования при сохраненном мочевом пузыре – 85,5; 64,9 и 57,8%.
Таким образом, применение только ТУР в качестве терапевтического подхода возможно при наличии опухолей, рост которых ограничен поверхностным мышечным слоем, а также в том случае, если при осуществлении диагностических биопсий не обнаруживается остаточная опухоль [6]. ТУР следует использовать в качестве единственного лечебного метода только у больных, отказывающихся от выполнения открытой операции или имеющих противопоказания к цистэктомии и комбинированной терапии для сохранения мочевого пузыря [7].
10.2. Дистанционная лучевая терапия
Поля облучения обычно включают только мочевой пузырь с запасом 1,5-2 см, при этом предполагается обязательное движение органов [1-4]. Ни разу не было продемонстрировано повышения эффективности ЛТ при увеличении полей облучения. СОД ЛТ при РМП составляет 60-66 Гр, после чего проводят дополнительное облучение мочевого пузыря или внутриполостную БТ. Ежедневная доза обычно составляет 1,8-2 Гр, при этом курс ЛТ не следует растягивать более чем на 6-7 нед – таким образом минимизируется возможность возникновения репопуляции опухолевых клеток. Использование современных стандартов и методов ЛТ приводит к развитию тяжелых поздних осложнений менее чем у 5 % больных, у которых отсутствуют признаки наличия опухоли [5-9]. Помимо эффективности применения ЛТ, к важным прогностическим факторам результатов лечения относят следующие:
- размер опухоли;
- наличие гидронефроза;
- завершенность предшествующей ТУР МП.
Уровень 5-летней общей выживаемости у больных ИРМП находится в пределах 30-60% в зависимости от достижения полного ответа на предшествующую ЛТ, при этом выживаемость, связанная с заболеванием, составляет от 20 до 50 % [10-14].
Прогностические факторы успешного лечения изучались в исследовании, проведенном одной итальянской клиникой и включавшем 459 пациентов, получавших ЛТ (примерно 30 % из них были в тяжелом состоянии с РМП стадии Т1), со средним периодом наблюдения 4,4 года. С помощью многовариантного анализа выживаемости установлены следующие статистически значимые факторы:
- возраст;
- категория Т (для всех показателей эффективности лечения);
- доза облучения опухоли (только для показателей безрецидивной выживаемости) [15].
С учетом данных доступных исследований был выполнен Кокрейновский анализ, продемонстрировавший, что проведение радикальной цистэктомии приводит к улучшению общей выживаемости по сравнению с применением только ЛТ [16].
ДЛТ может служить альтернативным методом лечения для пациентов с противопоказаниями к выполнению радикальной операции. Это было показано на примере группы, состоявшей из 92 пожилых или ослабленных пациентов (медиана возраста – 79 лет) с РМП стадии Т2N0-1М0. СОД – 55 Гр за 4 нед. Частота достижения полной ремиссии по данным цистоскопии через 3 мес составила 78 %, 3-летняя выживаемость без местного рецидива – 56 %, а 3-летняя общая выживаемость – 36 %. У 81 % пациентов емкость мочевого пузыря была сопоставима с показателями до начала лечения [17].
Схожие отдаленные результаты получены Chung и соавт. [18]. Всего 340 пациентов с ИРМП проводилась только ДЛТ, ДЛТ с одновременной ХТ или неоадъювантная ХТ с последующей ДЛТ. Общая частота полного ответа составила 55%, а 10-летняя болезнь-специфическая и общая выживаемость – 35 и 19% соответственно. Полный ответ в группе только ДЛТ наблюдался в 64% случаев, в группе ДЛТ с одновременной ХТ – в 79% (n=36), а в группе неоадъювантной ХТ – в 52% (n=57), хотя в последней группе у большинства больных были стадии T3 и T4. Молодой возраст, более низкая стадия опухоли и отсутствие карциномы in situ статистически значимо коррелировали с улучшением выживаемости. Так, в группе с РМП стадии T2 5-летняя общая выживаемость составила 44%, а болезнь-специфическая – 58%. Плохим прогностическим фактором было развитие рецидива в течение 2-3 лет. Авторы пришли к выводу, что проведение ДЛТ в виде монотерапии обосновано только у тщательно отобранных пациентов.
10.2.1. Выводы и рекомендации по дистанционной лучевой терапии (табл. 10.2, 10.3)
10.3. Химиотерапия
Сама по себе ХТ, как правило, не приводит к достижению стойких полных ремиссий. В ряде исследований сообщается о том, что частота полного ответа при ХТ достигает 56 %, но к данному показателю следует относиться взвешенно, поскольку возможность допуска ошибки при стадировании превышает 60 % [1, 2]. Ответ на ХТ считается прогностическим фактором результатов лечения и продолжительности жизни [3], хотя его точность может снижаться в случае, если не были учтены все показания и противопоказания.
В нескольких проспективных исследованиях были представлены результаты ХТ при операбельных (неоадъювантный метод) и неоперабельных первичных опухолях [4-7]. В ходе проведения ряда проспективных исследований после применения 2-3 циклов неоадъювантной ХТ MVAC (метотрексат, винбластин, адриамицин) или CMV (цисплатин, метотрексат, винбластин) наблюдалось снижение стадии первичной опухоли [4-6]. В исследованиях II и III фазы полный морфологический ответ первичной опухоли мочевого пузыря был достигнут в 12-15 % случаев после ХТ MVAC и в 12-22 % – после GC (гемцитабин, цисплатин) [4-6, 8-16]. В последних исследованиях при проведении неоадъювантного курса ХТ GC в сочетании с радикальной цистэктомией показан меньший процент отрицательных результатов морфологического исследования, что может объясняться недостаточной плотностью дозы и нецелесообразно отстроченной операцией [17]. Эффективность терапии с сохранением мочевого пузыря оценивают только при помощи цистоскопии, КТ и тщательного наблюдения. Этому подходу свойственна неточность в определении стадии, вследствие чего существует риск развития местного рецидива и/ или последующего метастазирования.
В тщательно отобранных случаях стратегия сохранения мочевого пузыря, включающая ТУР и системную цисплатинсодержащую ХТ (желательно с MVAC), позволяет получить длительную выживаемость с сохраненным мочевым пузырем [18]. Тем не менее этот метод нельзя рекомендовать для применения в клинической практике.
10.3.1. Выводы и рекомендации по химиотерапии инвазивного рака мочевого пузыря (табл. 10.4, 10.5)
10.4. Мультимодальная стратегия сохранения мочевого пузыря
Комбинированный подход к лечению ИРМП включает ТУР первичной опухоли, ХТ и ЛТ [1, 2].Обоснование для выполнения ТУР и ЛТ -достижение локального контроля над опухолью, а целью проведения системной ХТ, чаще всего с применением метотрексата, цисплатина и винбластина (MCV), считается элиминация микрометастазов. Во многие протоколы входит использование цисплатина и/или 5-фторурацила, а с недавнего времени и гемцитабина в комбинации с ЛТ, поскольку они выступают в роли радиосенсибилизирующих препаратов. Частота полного ответа после проведения ТУР с последующей ХТ на основе цисплатина в комбинации с ЛТ составляет 60-80%.
В небольшом исследовании I/II фазы особо подчеркивалась роль гемцитабина в комбинированной терапии, с 5-летней общей выживаемостью 70,1%, и болезнь-специфической выживаемостью 78,9% [3].
В другом исследовании со средним периодом наблюдения 42 мес сравнивали ТУР + химиолучевую терапию (n=331) и ТУР + ЛТ (n=142) [4]. В целом частота полного ответа была высокой (70,4%), однако в группе химиолучевой терапии показано выраженное преимущество в выживаемости (медиана 70 мес) по сравнению с группой ЛТ (медиана 28,5 мес). Отдаленные результаты зависят от стадии, лимфатической инвазии, наличия резидуальной опухоли и первоначального ответа, который оценивали при повторном ТУР.
Важность радикальности первичного ТУР также подтверждена в японском исследовании, включавшем 82 пациентов, которым выполняли ТУР в комбинации с химиолучевой терапией [5]. Первоначальная морфологическая полная ремиссия была относительно низкой (39%) при отсутствии радикального первичного ТУР. Клинические показатели полного ответа (84%) и выживаемости (5-летняя общая 77,7%, без прогрессирования – 64,5%) были высокими, хотя некоторым больным проводилась спасительная терапия. У пациентов с первичным РМП стадии cT2 отмечалась статистически значимо более высокая выживаемость по сравнению с больными со стадией cT3-4 и рецидивным РМП.
В ряде небольших серий подтверждена потенциальная эффективность мультимодального лечения [6-9]. Показатели 5-летней общей выживаемости составили около 70%, хотя протоколы лечения и критерии отбора больных различались между исследованиями. Прогноз пациентов с рецидивом РМП и прогрессированием неинвазивного рака до инвазивного был неблагоприятным. Низкая стадия и радикальный ТУР остаются важными прогностическими факторами. Пациентам, у которых на фоне комбинированной терапии не достигнуто полного ответа, рекомендуется выполнять раннюю цистэктомию. Примерно 40-45% больных могут прожить 4-5 лет с сохраненным мочевым пузырем [2].
В исследованиях по мультимодальной стратегии сохранения мочевого пузыря и цистэктомии получены сравнимые отдаленные показатели 5-летней выживаемости на уровне 50-60%. Тем не менее эти два подхода никогда напрямую не сравнивались, к тому же для проведения исследований с использованием комбинированного лечения необходим тщательный отбор пациентов [2, 10-12].
Мультимодальные стратегии сохранения мочевого пузыря требуют очень тесного взаимодействия разных специалистов и высокого уровня комплаентности пациента. Даже при достижении полного ответа на фоне мультимодальной терапии мочевой пузырь остается потенциальным источником рецидива. Примерно у половины больных можно безопасно сохранить мочевой пузырь. Важным прогностическим признаком служит отсутствие опухоли (статус Т0) при повторных ТУР первичной опухоли с проведением последующего химиолучевого лечения. Однако даже в этом случае сохраняется пожизненный риск возникновения внутрипузырных рецидивов опухоли, что требует тщательного наблюдения и осуществления множественных инвазивных процедур.Установлено, что задержка в выполнении цистэктомии из-за проведения мультимодальной терапии повышает риск поражения ЛУ на 26%, поэтому цистэктомия становится необходимой при неэффективности органосохраняющего лечения.
10.4.1. Выводы и рекомендации по мультимодальному лечению ИРМП (табл. 10.6, 10.7)
- ВВЕДЕНИЕ В ПРОБЛЕМУ, ЭПИДЕМИОЛОГИЯ И ФАКТОРЫ РИСКА
- КЛАССИФИКАЦИЯ
- ДИАГНОСТИКА И СТАДИРОВАНИЕ
- РЕЦИДИВ ПОСЛЕ ЛЕЧЕНИЯ НЕИНВАЗИВНОГО РАКА МОЧЕВОГО ПУЗЫРЯ
- РАДИКАЛЬНЫЕ ОПЕРАЦИИ И МЕТОДЫ ДЕРИВАЦИИ МОЧИ
- НЕОАДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ
- НЕРЕЗЕКТАБЕЛЬНЫЕ ОПУХОЛИ
- НЕОАДЪЮВАНТНАЯ ЛУЧЕВАЯ ТЕРАПИЯ ПРИ ИНВАЗИВНОМ РАКЕ МОЧЕВОГО ПУЗЫРЯ
- СТРАТЕГИИ СОХРАНЕНИЯ МОЧЕВОГО ПУЗЫРЯ ПРИ ЛОКАЛИЗОВАННОЙ ОПУХОЛИ
- АДЪЮВАНТНАЯ ХИМИОТЕРАПИЯ
- МЕТАСТАТИЧЕСКАЯ БОЛЕЗНЬ
- КАЧЕСТВО ЖИЗНИ
- НАБЛЮДЕНИЕ
Источник
Рак мочевого пузыря входит в число наиболее распространенных онкологических заболеваний. В России он составляет 4,5% от всех злокачественных опухолей, ежегодно диагностируются более 10 тысяч новых случаев. Наиболее распространено заболевание среди людей старше 67 лет, мужчины болеют примерно в 4,5 раза чаще по сравнению с женщинами.
В Европейской клинике можно получить лечение при раке мочевого пузыря по современным международным стандартам. Наши врачи выполняют хирургические вмешательства любой сложности, применяют противоопухолевые препараты последнего поколения с доказанной эффективностью.
Классификация и стадии рака мочевого пузыря
Подавляющее большинство злокачественных опухолей мочевого пузыря представлено уротелиальным раком (другое название – переходно-клеточный рак). Он развивается из клеток, которые образуют слизистую оболочку органа – уротелий (переходно-клеточный эпителий). Также уротелием выстлан мочеиспускательный канал, мочеточники, почечные лоханки, поэтому здесь могут встречаться такие же опухоли.
В 1-2% случаев (по данным Американского онкологического сообщества – American Cancer Society) в мочевом пузыре встречается плоскоклеточный рак (состоит из плоских клеток, напоминающих те, что входят в состав эпидермиса кожи), в 1% случаев – аденокарциномы (злокачественные опухоли из железистых клеток), менее чем в 1% случаев – мелкоклеточный рак (из нейроэндокринных клеток). Крайне редко в мочевом пузыре обнаруживают саркомы – злокачественные опухоли из соединительной ткани.
Классификация рака мочевого пузыря по стадиям осуществляется в соответствии с общепринятой системой TNM. Буквой T обозначают характеристики первичной опухоли, N – наличие очагов поражения в регионарных лимфоузлах, M – наличие отдаленных метастазов в других органах.

В упрощенном варианте, в зависимости от характеристик T, N и M, выделяют пять основных стадий рака мочевого пузыря:
- Стадия 0 – неинвазивная карцинома, она находится только в пределах слизистой оболочки и не прорастает глубже в стенку органа. Это так называемый рак на месте. Все остальные стадии – это инвазивный рак.
- Стадия I – опухоль углубилась в стенку мочевого пузыря, но не достигла мышечного слоя (T1). Нет очагов поражения в регионарных узлах (N0) и отдаленных метастазов (M0).
- Стадия II – опухоль проросла в мышечный слой органа (T2), но не проросла сквозь него. N0, M0.
- Стадия III – злокачественная опухоль проросла сквозь стенку мочевого пузыря и распространилась на окружающую его жировую клетчатку (T3) или в соседние органы (T4a). Опухолевые клетки на этой стадии могут распространяться в регионарные лимфоузлы (N1-3), отдаленных метастазов нет (M0).
- Стадия IV – злокачественная опухоль проросла в стенку таза или живота (IVA), либо имеются метастазы в отдаленных лимфоузлах, других органах (IVB). При этом первичная опухоль может иметь любые размеры, распространяться или не распространяться в регионарные лимфатические узлы.
Методы диагностики
К сожалению, не существует эффективных методов скрининга, которые можно было бы регулярно проводить у всех людей с целью ранней диагностики рака мочевого пузыря. Симптомы заболевания неспецифичны и могут напоминать проявления других патологий, например, цистита, аденомы простаты. Из-за этого злокачественные опухоли нередко диагностируют на поздних стадиях, когда лечить их уже намного сложнее.
Важно внимательно относиться к своему здоровью, обращать внимание на любые симптомы, которые сохраняются в течение длительного времени, и при их возникновении сразу обращаться к врачу.
При подозрении на рак мочевого пузыря применяют следующие виды диагностики:
- Цитологическое исследование мочи – её изучение под микроскопом на предмет наличия опухолевых клеток. Этот анализ иногда помогает диагностировать рак на ранних стадиях, но он не идеален.
- Исследование мочи на онкомаркеры – вещества, повышение уровней которых может свидетельствовать о злокачественной опухоли. Это также не совсем надежный тест.
- Цистоскопия – эндоскопическое исследование мочевого пузыря, когда в орган вводят специальный инструмент – цистоскоп – с видеокамерой. Наиболее информативна так называемая цистоскопия с синим светом. В мочевой пузырь вводят специальный препарат, который накапливается в опухолевых клетках и заставляет их флуоресцировать («светиться») в лучах синего света.
- Биопсия – исследование, во время которого получают фрагмент патологически измененной ткани и изучают в лаборатории под микроскопом. Это самый надежный способ разобраться, присутствуют ли в патологическом образовании раковые клетки, и является ли оно злокачественным. Материал для биопсии можно получить во время цистоскопии.
- Внутривенная пиелография. Пациенту внутривенно вводят раствор рентгеноконтрастного препарата, который затем начинает выводиться почками и «прокрашивает» мочевыводящие пути на рентгеновских снимках. Это помогает обнаружить опухоли.
- Ретроградная пиелография – исследование, во время которого рентгеноконтрастный раствор вводят через катетер, установленный в мочевом пузыре или мочеточнике.
- Ультразвуковое исследование помогает оценить размеры опухоли, выяснить, не распространилась ли она за пределы мочевого пузыря, проверить состояние почек. Под контролем УЗИ в обнаруженную опухоль можно ввести иглу и провести биопсию.
- Компьютерная томография и МРТ помогают оценить размеры, расположение, количество опухолевых очагов, обнаружить распространение рака на соседние органы, в лимфатические узлы, выявить метастазы. Под контролем КТ также можно провести биопсию с помощью иглы.
- Рентгенографию применяют для поиска метастазов в легких, костях.
Лечение рака мочевого пузыря
Тактику лечения при раке мочевого пузыря составляет команда врачей, в которую входят клинические онкологи, хирурги, урологи, химиотерапевты, радиотерапевты и другие специалисты.
Как выбирают лечение при раке мочевого пузыря?
Тактика лечения рака мочевого пузыря зависит от многих факторов: стадии опухоли, ее типа и молекулярно-генетических характеристик, общего состояния здоровья пациента, его возраста, наличия у него сопутствующих заболеваний. Прибегают к различным видам хирургических вмешательств, пациенту может быть назначена лучевая терапия, химиотерапия, иммунотерапия (в том числе введение препаратов внутрь мочевого пузыря).
Хирургическое лечение
В большинстве случаев злокачественную опухоль мочевого пузыря удается удалить хирургически. Есть разные виды операций, врач выбирает подходящую, в зависимости от стадии рака.
Иногда можно прибегнуть к трансуретральной резекции опухоли. Во время этого вмешательства не нужно делать разрез. Через мочеиспускательный канал (чаще всего пациент находится под общим наркозом) вводят специальный инструмент – резектоскоп. Он представляет собой петлю, которую накидывают на опухоль и отсекают ее. Для того чтобы уничтожить оставшиеся раковые клетки, прибегают к фульгурации (прижиганию током высокой частоты) или используют лазер.
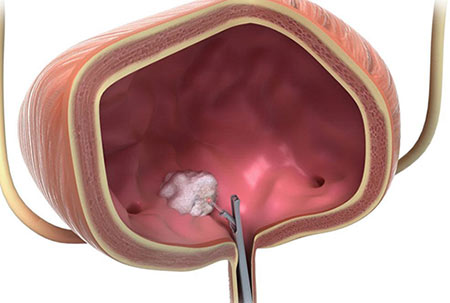
Трансуретральная резекция для лечения рака мочевого пузыря показана в двух случаях:
- Для того чтобы удалить поверхностно расположенные опухоли на ранних стадиях.
- Для того чтобы диагностировать рак, разобраться, насколько глубоко он прорастает в стенку мочевого пузыря.
Если опухоль проросла в мышечный слой стенки органа, но имеет небольшие размеры, можно выполнить резекцию – удалить только часть мочевого пузыря. На оставшуюся часть накладывают швы, и она продолжает выполнять свои функции, но в ней не может поместиться прежний объем мочи, и человеку приходится чаще посещать туалет. У резекции есть один большой недостаток: высок риск рецидива.

Большинству больных приходится выполнять цистэктомию – полностью удалять мочевой пузырь. Вместе с ним удаляют близлежащие лимфоузлы, у мужчин – семенные пузырьки и простату, у женщин – матку с шейкой и придатками, верхнюю часть влагалища. Операцию выполняют разными способами: через разрез, лапароскопически, в некоторых клиниках прибегают к роботизированной хирургии. После цистэктомии пациент остается без мочевого пузыря. Для того чтобы восстановить отток мочи, прибегают к разным вариантам реконструктивных операций:
- Врач может удалить часть сигмовидной кишки, сформировать из нее новый мочевой пузырь и соединить его с мочеточниками. Из участка кишки на поверхность кожи выводят отверстие: через него оттекает моча. При этом на коже постоянно придется носить мешочек для сбора мочи и периодически опорожнять его.
- Более совершенный вариант оперативного лечения – когда хирург формирует в кишке специальный клапан. Этот клапан перекрывает отверстие и не дает моче вытекать. Когда пациент хочет помочиться, он вставляет в отверстие катетер, клапан открывается, и моча вытекает по катетеру.
- Наиболее современная операция – когда хирург подсоединяет к одному концу кишки мочеточники, а к другому – мочеиспускательный канал. У большинства пациентов в течение нескольких месяцев восстанавливается способность к самостоятельным мочеиспусканиям, но зачастую остается недержание мочи по ночам.
Иногда запущенный рак, который не может быть удален хирургически, приводит к недержанию мочи или, напротив, создает препятствие для ее оттока. В таких случаях прибегают к паллиативным хирургическим вмешательствам.
Химиотерапия
Химиопрепараты при злокачественных опухолях мочевого пузыря могут решать разные задачи:
- Неоадъювантную химиотерапию проводят до хирургического вмешательства. Благодаря препаратам опухоль уменьшается, и ее становится проще удалить.
- Адъювантная химиотерапия применяется после операции. Если в организме пациента остались раковые клетки, химиопрепараты их уничтожают, за счет этого снижается риск рецидива.
- Химиолучевая терапия – когда химиопрепараты назначают «в помощь» лучевой терапии. За счет этого повышается эффективность лечения рака.
- Паллиативная химиотерапия – один из основных методов лечения на поздних стадиях, когда опухоль неоперабельна, имеются отдаленные метастазы. Химиопрепараты помогают продлить жизнь пациента и избавить от некоторых симптомов.
Злокачественные новообразования мочевого пузыря лечат цисплатином, гемцитабином, винбластином, метотрексатом, доксорубицином, карбоплатином, доцетакселом, паклитакселом. Эти препараты назначают в различных сочетаниях. Если пациент не может переносить два и более препарата из-за побочных эффектов, назначают один препарат, чаще всего цисплатин или гемцитабин.
На ранних стадиях проводят внутрипузырную химиотерапию: химиопрепарат вводят внутрь мочевого пузыря через мочеиспускательный канал.
Лучевая терапия
Показания к лечению лучевой терапией при злокачественных опухолях мочевого пузыря:
- Лечение опухоли на ранних стадиях, если пациенту противопоказана операция, либо если во время хирургического вмешательства удален не весь мочевой пузырь.
- Для борьбы с симптомами, вызванными злокачественной опухолью.
Иммунотерапия рака мочевого пузыря
Иммунитет человека умеет уничтожать не только болезнетворные микроорганизмы, проникшие извне, но и собственные клетки, в генах которых возникли «ошибки». Именно из-за таких «ошибок» нормальная клетка превращается в раковую. Однако, опухолевые клетки умеют «обманывать» иммунитет, и используют для этого сложные молекулярные механизмы.
Так, иммунная система использует некоторые молекулы (они называются контрольными точками), чтобы подавлять собственную активность и не атаковать нормальные ткани организма. На поверхности иммунных клеток находится белок PD-1, который, взаимодействуя с белком PD-L1 на поверхности других клеток, подавляет иммунную реакцию. Для того чтобы снять блок с иммунной системы, для лечения применяют две группы иммунопрепаратов:
- Блокаторы PD-1: пембролизумаб (Кейтруда), ниволумаб (Опдиво).
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенцио), дурвалумаб (Имфинци).
Все эти препараты вводят внутривенно через каждые 2-3 недели. Обычно их назначают пациентам, у которых опухоль не реагирует на химиотерапию и продолжает прогрессировать.
Спустя несколько недель после трансуретральной резекции могут быть назначены внутрипузырные введения вакцины БЦЖ. Она стимулирует местные иммунные механизмы, которые уничтожают оставшиеся опухолевые клетки. БЦЖ вводят в мочевой пузырь через мочеиспускательный канал, обычно раз в неделю в течение шести недель.
Каким будет план лечения на разных стадиях рака мочевого пузыря?
Лечебная тактика на разных стадиях выглядит примерно следующим образом:
- На стадии 0 (когда опухоль находится в верхнем слое слизистой оболочки): трансуретральная резекция с последующим введением в мочевой пузырь вакцины БЦЖ или химиопрепаратов.
- На стадии I (опухоль в слизистой оболочке, которая не вросла в мышечный слой стенки) лечение начинают с трансуретральной резекции, но ее проводят не для того, чтобы вылечить пациента, а чтобы определить стадию рака. Далее может быть проведена повторная трансуретральная резекция с последующим введением в мочевой пузырь БЦЖ или химиопрепаратов. При больших, множественных и агрессивных опухолях рекомендуется удалить мочевой пузырь. Если операция противопоказана из-за слабого здоровья пациента, назначают лучевую или химиолучевую терапию, но шансы на успешное лечение в таком случае ниже.
- На стадии II (опухоль проросла в мышечный слой) удаляют мочевой пузырь, до или после операции проводят курс лечения химиотерапией. У немногих пациентов удается удалить только часть мочевого пузыря. Иногда при небольших опухолях проводят трансуретральную резекцию с последующей химиотерапией и лучевой терапией, но это сомнительный подход, не все врачи с ним согласны.
- На стадии III (опухоль распространяется за пределы мочевого пузыря) выполняют цистэктомию, проводят курс адъювантной или неоадъювантной химиотерапии. Если пациент не может перенести операцию, врач может назначить трансуретральную резекцию, химиотерапию, лучевую терапию, иммунотерапию.
- На стадии IVA (опухоль прорастает в стенку брюшной полости, таза) лечение начинают с курса химиотерапии или химиолучевой терапии. Когда опухоль уменьшается в размерах, может быть проведено хирургическое вмешательство. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты.
- На стадии IVB (имеются отдаленные метастазы) лечение начинается с химиотерапии или химиолучевой терапии. Если пациент не может перенести химиотерапию, назначают лучевую терапию, иммунопрепараты. Проводят паллиативные хирургические вмешательства, направленные на восстановление оттока мочи или борьбу с недержанием.
Как лечить опухоли мочевого пузыря с метастазами?
На момент постановки диагноза у 10-15% больных со злокачественными новообразованиями мочевого пузыря уже имеются отдаленные метастазы. У 30% пациентов после радикального лечения (полного удаления опухоли) происходит рецидив в мочевом пузыре или в виде метастазов.
Бороться с метастазировавшим раком сложно. Обычно радикальное хирургическое лечение и наступление ремиссии невозможно. Лечение начинают с химиотерапии. Учитывают состояние здоровья пациента и молекулярно-генетические характеристики опухолевых клеток:
- Если больному не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин или DDMVAC (уплотненная доза MVAC): метотрексат + винбластин + доксорубицин (адриамицин) + цисплатин.
- Больному противопоказан цисплатин, но не противопоказан карбоплатин: гемцитабин (Гемзар) + карбоплатин.
- Больному противопоказан цисплатин, и в опухолевых клетках обнаружен маркер PD-L1: гемцитабин (Гемзар) + карбоплатин, атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
- Больному противопоказаны все препараты платины: атезолизумаб (Тецентрик), пембролизумаб (Кейтруда).
Если на фоне применения препаратов первой линии заболевание продолжает прогрессировать, назначают препараты второй линии:
- После лечения препаратами платины: пембролизумаб (Кейтруда), атезолизумаб (Тецентрик), ниволумаб (Опдиво), дурвалумаб (Имфинзи), авелумаб (Бавенцио), эрдафитиниб (Балверса – для пациентов, у которых обнаружены мутации FGFR2 и FGFR3).
- После лечения ингибиторами контрольных точек, если пациенту противопоказан цисплатин: гемцитабин (Гемзар) + карбоплатин.
- После лечения ингибиторами контрольных точек, если пациенту не противопоказан цисплатин: гемцитабин (Гемзар) + цисплатин, DDMVAC.
Параллельно с противоопухолевыми препаратами может применяться лучевая терапия.
Какие методы лечения рака мочевого пузыря наиболее эффективны?
На этот вопрос нет однозначного ответа. Всё зависит от стадии, типа, молекулярно-генетических характеристик опухоли, состояния здоровья пациента, наличия и отсутствия у него противопоказаний.
Оптимальные методы лечения злокачественных опухолей мочевого пузыря прописаны в специальных документах – протоколах. Они составлены на основе результатов многочисленных клинических исследований с участием тысяч пациентов по всему миру и регулярно пересматриваются, обновляются.
Врачи в Европейской клинике руководствуются последними версиями американских, европейских, израильских протоколов лечения.
Насколько эффективны современные методы лечения, каков прогноз?
В среднем в течение 5 лет остаются в живых 77% пациентов, в течение 10 лет – 70%, в течение 15 лет – 65%. Пятилетняя выживаемость при злокачественных опухолях мочевого пузыря зависит от стадии:
- Стадия 0-98%.
- Стадия I-88%.
- Стадия II-63%.
- Стадия III-46%.
- Стадия IV-15%.
В настоящее время проводятся клинические исследования, врачи ищут более эффективные способы борьбы с заболеванием, а значит, есть надежда, что в ближайшем будущем эти показатели улучшатся.
Источник
