Лучевая терапия простаты и мочевого пузыря
Методика облучения рака простаты
Объёмное планирование полей облучения проводят на основе КТ, выполненной в том положении, в котором больного будут облучать. Выделяют клинический объём (объём опухоли), который вместе с окружающими здоровыми тканями составляет терапевтический объём. Многолепестковые коллиматоры автоматически придают полю облучения нужную форму. Визуализация полей облучения позволяет в режиме реального времени сопоставлять фактические поля с симуляционными и исправлять отклонения, превышающие 5 мм. Объёмное планирование помогает повысить дозу и, соответственно, эффективность облучения, не увеличивая риск возникновения осложнений. Модуляция интенсивности облучения возможна на линейном ускорителе, оснащённом современным многолепестковым коллиматором и специальной программой: движение створок коллиматора равномерно распределяет дозу в поле облучения, создавая вогнутые изодозные кривые. Лучевую терапию (независимо от методики) планируют и проводят врач-радиолог, дозиметрист, инженер-физик и программист.
Лучевая терапия при раке простаты Т1-2с N0 M0
Для больных низкого онкологического риска Т1-2b индекс Глисона менее 6, уровень ПСА менее 10 нг/мл) при дистанционном облучении доза составляет 70-72 Гр, её повышение уже не улучшает результаты.
При умеренном риске (Т2b, уровень ПСА – 10-20 нг/мл или индекс Глисона – 7) повышение дозы до 76-81 Гр заметно улучшает 5-летнюю безрецидивную выживаемость, не вызывая тяжёлых поздних лучевых реакций. Рандомизированные испытания показали, что в группе умеренного риска оправдано повышение дозы облучения. В одном из исследований сравнивали действие дозы 70 и 78 Гр (соответственно при обычном и объемном планировании) у 305 больных с опухолями Т1-3 и уровне ПСА более 10 нг/мл. При медиане времени наблюдения 40 мес 5-летняя безрецидивная выживаемость составила соответственно 48 и 75%, В другое испытание были включены 393 больных с опухолями Т1b-2b (в 15% наблюдений индекс Глисона был менее 6, уровень ПСА – менее 15 нг/мл). В первой группе больным проводили облучение предстательной железы протонным пучком в дозе 19,8 изоГр с последующим облучением большего объёма железы в дозе 50,4 Гр. Во второй группе доза облучения протонным пучком была увеличена до 28,8 изоГр. При медиане времени наблюдения 4 года 5-летняя безрецидивная выживаемость в первой группе была достоверно выше, чем во второй. Оптимальная доза пока не определена, но для повседневной практики можно рекомендовать дозу 78 Гр.
В группе высокою риска (Т2с, индекс Глисона более 7 или уровень ПСА более 20 нг/мл ) повышение дозы облучения увеличивает безрецидивную выживаемость, но не предотвращает рецидивы за пределами малого таза. По данным рандомизированного испытания, включившего 206 больных (содержание ПСА 10-40 нг/мл, индекс Глисона – не менее 7 или выход опухоли за капсулу; медиана времени наблюдения – 4,5 года), присоединение в течение 6 мес гормонотерапии к лучевой терапии с объёмным планированием достоверно повышает выживаемость, снижает риск смерти от опухоли и продлевает время до начала гормонотерапии.
Адъювантная лучевая терапия рака предстательной железы Т3
Применение адъювантной лучевой терапии более успешно у пациентов с признаками экстракапсулярного прорастания или с положительным хирургическим краем, чем у больных с инвазией в семенные пузырьки или лимфогенным метастазированием. Если опухоль выходит за капсулу предстательной железы (рТ3), риск местного рецидива достигает 10-50%. Как упоминалось выше, риск зависит от уровня ПСА, индекса Глисона, а также наличия опухолевых клеток в крае резекции. Больные хорошо переносят адъювантную лучевую терапию: возникновение тяжёлых осложнений со стороны мочевых путей возможно в 3,5% случаев; недержание мочи и стриктуры в зоне анастомоза возникают не чаще, чем без облучения. Пятилетняя безрецидивная выживаемость составляет 12,2% (в контрольной группе – 51,8%).
Если через 1 мес после операции уровень ПСА ниже 0,1 нг/мл и обнаружено прорастание капсулы или семенных пузырьков (рТ3N0), опухолевые клетки в крае резекции, показана адъювантная лучевая терапия. Её начинают сразу после нормализации мочеиспускания и заживления раны (через 3-4 нед). Другой вариант – динамическое наблюдение в сочетании с облучением (при уровне ПСА более 0.5 нг/мл). поскольку при содержании ПCA более I нг/мл эффективность лучевой терапии достоверно падает. Доза облучения па ложе удалённой простаты должна составлять не менее 64 Гр. Обычно лучевую терапию проводят непосредственно после операции.
[6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16]
Лучевая терапия при опухолях T3-4 N0 М0 и T1-4 N1 M0
К сожалению, несмотря на успехи ранней диагностики, такие опухоли в России наблюдают чаще, чем в развитых странах. Ввиду высокого риска микрометастазования в поле облучения нужно включать не только увеличенные (N1), но и внешне неизменённые тазовые лимфатические узлы (N0). Изолированное применение лучевой терапии в таких случаях малоэффективно, поэтому, учитывая гормонозависимый характер РПЖ, её сочетают с гормонотерапией.
Множество исследований подтверждает преимущество комбинированного лечения: снижение риска отдалённого метастазирования (за счёт уничтожения микрометастазов), усиление действия на первичную опухоль – потенциальный источник новых метастазов (путём усиления апоптоза на фоне облучения).
Профилактическое облучение тазовых лимфатических узлов
Метастазирование в тазовые лимфатические узлы ухудшает прогноз, однако рандомизированные испытания, проведённые в 1970-80-е гг., не подтвердили эффективность их профилактического облучения. Лучевое воздействие на лимфатические узлы не влияет на риск возникновения местного рецидива и выживаемость. Оценить риск метастазирования в лимфатические узлы позволяют номограммы Партина и специальная формула;
риск метастазов (%) = 2/3 ПСА + (индекс Глисона 6) х 10.
Возможна также биопсия лимфатических узлов во время лапароскопии или лапаротомии.
Модуляция интенсивности облучения
Модуляция интенсивности облучения позволяет повышать дозу до 80 Гр при равномерном распределении в опухоли и без дополнительного повреждения здоровых тканей. Наибольший опыт использования модуляции имеет Онкологический центр Слоуна-Кеттеринга в Нью-Йорке: в 1996-2001 гг. 772 больных получили здесь лучевую терапию в дозе 81-86,4 Гр. При медиане времени наблюдения 2 года (6-60 мес) риск развития среднетяжёлого лучевого проктита составил 4%, цистита – 15%; трёхлетняя безрецидивная выживаемость в группах низкого, среднего и высокого риска – соответственно 92, 86 и 81%, Метод позволяет увеличивать фракции облучения, тем самым сокращая сроки лечения (например, 70 Гр подводят 28 фракциями по 2,5 Гр за 5,5 нед).
Источник
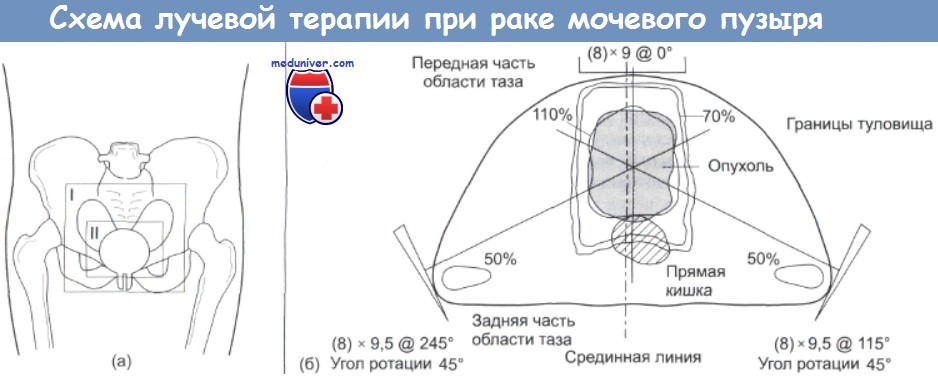
Лучевая терапия рака мочевого пузыряУчитывая эффективность радикальной лучевой терапии в лечении карциномы мочевого пузыря, правомерно задать вопрос, а нельзя ли вообще отказаться от цистэктомии как от метода первичного лечения? На этот вопрос попытались ответить в Великобритании, проведя большие совместные исследования. Были отобраны 200 больных, которые получили только курс лучевой терапии (60 Гр на протяжении 6 недель), или предоперационное облучение (40 Гр на протяжении 4 недель). Через месяц больным во второй группе провели радикальную цистэктомию. Спустя пять лет в этой группе была обнаружена тенденция в сторону увеличения выживаемости (38%) по сравнению с группой, получившей только курс радкальной лучевой терапии (29%). Хотя общий результат не достиг статистически достоверного уровня, сочетание предоперативного облучения и последующей операции оказалось более эффективным на контингенте больных молодого возраста мужского пола. Различие между группами может быть завышено, поскольку 20% больных из группы, произвольно отобранной для проведения лучевой терапии и последующей операции, не смогли завершить курс лечения. После лучевой терапии у некоторых больных отмечались случаи рецидивов опухоли, и поэтому им была проведена «спасительная цистэктомия» со впечатляющим результатом: 52% для 5-летней выживаемости. Такие же результаты были получены в США и в Дании. Недавно несколько больших коллективов сообщили о результатах радикальной лучевой терапии, которые оказались близкими к полученным после операции. Биологическая эффективность лучевой терапии при лечении рака мочевого пузыря иллюстрируется также феноменом «снижения стадии развития опухоли», который наблюдается после облучения. В нескольких исследованиях показано, что при исследовании образцов опухоли, взятых у больных после проведения курса лучевой терапии, индекс Р-стадии часто оказывается ниже, чем можно было предположить, исходя из первоначальной оценки состояния опухоли (Т-стадии). Например, в исследовании из клиники Royal Marsden этот эффект подтвердился почти для половины (47%) образцов ткани мочевого пузыря, взятых после лучевой терапии. С помощью лучевой терапии также достигается стерилизация лимфатических узлов, пораженных опухолью. В том же исследовании частота метастазирования узлов после облучения оказалась равной 23%, в то время как для необлученной опухоли в стадии Т3 ожидаемая величина должна быть порядка 40-50%. Лишь у 8% больных, перенесших лучевую терапию, было отмечено поражение регионарных лимфатических узлов, требующее проведения цистэктомии. Это позволяет предполагать, что лучевая терапия перед операцией будет особенно полезна для тех больных, у которых узлы поражены либо в ограниченной степени, либо в них присутствуют микрометастазы.
(а) Облучаемая область в вертикальной проекции, I – на первой стадии проводится облучение мочевого пузыря и тазовых лимфатических узлов; II – на второй стадии мочевой пузырь облучается в радикальной дозе. Облучение на первой стадии проводится с заполненным мочевым пузырем, для того, чтобы свести к минимуму радиационное поражение тонкого кишечника, (б) Схема радикального облучения во второй стадии (размеры нолей указаны в см). Подробное объяснение см. в тексте По-видимому, к числу наиболее важных результатов всех этих исследований относится вывод о том, что в случаях, когда наблюдается снижение стадии развития опухоли, 5-летняя выживаемость больных составляет 51%. Для больных, у которых этот эффект не проявлялся, 5-летняя выживаемость оказалась на уровне 22%. Хотя цистэктомия остается широко распространенным методом лечения больных с опухолями в стадии Т3, представленные выше данные, а также другие результаты позволяют предполагать, что лучевая терапия столь же эффективна, и обладает существенным преимуществом, поскольку является безболезненной процедурой. Качество жизни больных, которые перенесли операцию отвода мочи, хуже, чем у пациентов с сохраненным мочевым пузырем. Наряду с общими трудностями, больные страдают от запаха, утечки мочи, психологических трудностей, мешающих приспособиться к стоме, а также от ощущения чувства потери сексуальной привлекательности. При проведении операции на должном уровне остроту многих проблем удается снизить, однако больные, безусловно, нуждаются в поддержке и в проведении с ними разъяснительной работы как в предоперационном периоде, так и после операции. Для проведения сеансов лучевой терапии рака мочевого пузыря требуется высоковольтное оборудование. Обычно применяется метод многопольного облучения с использованием трех или четырех полей. Необходимо уделять внимание тщательному планированию схемы и режима облучения. Существуют различные точки зрения в отношении целесообразности облучения тазовых лимфатических узлов и самого мочевого пузыря. Хотя трудно продемонстрировать увеличение выживаемости больных после облучения тазовых лимфатических узлов, описанный выше феномен снижения стадии развития опухоли свидетельствует в пользу сторонников их облучения. Последствия облучения тазовой области сказываются сильнее, даже если оно проводится в относительно умеренной дозе – 40 Гр. При поражении лимфатических узлов общая 5-летняя выживаемость составляет менее 10%. Это позволяет предполагать, что при обнаружении поражения узлов распространение опухоли обычно продолжается. Большинство современных исследований (в том числе, проведенных MRC и EORTC), свидетельствуют в пользу применения новых и более обоснованных схем химиотерапии, которые используются совместно с облучением небольших участков тела. Эти схемы вполне подходят для тех же больных, у которых после облучения тазовой области проявился феномен «снижения стадии развития опухоли». Вопросы химиотерапии рака мочевого пузыря подробно рассматриваются ниже. После лучевой терапии, наряду с проявлением терапевтического эффекта, снимаются такие симптомы, как боли и гематурия. Она является наиболее ценным паллиативным методом, который применяется даже на поздних стадиях рака мочевого пузыря (стадия IV), когда практически не остается надежды на излечение.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021 – Также рекомендуем “Химиотерапия рака мочевого пузыря” – Вернуться в оглавление раздела “Онкология” Оглавление темы “Опухоли мочеполовой системы”:
|
Источник
Существуют разные виды лечения рака простаты у мужчин, врач выбирает тактику с учетом ряда факторов. В первую очередь ориентируются на стадию опухоли. Если она не выходит за пределы предстательной железы, возможно хирургическое лечение. Если имеются метастазы в лимфатических узлах, костях и других органах, хирургическое лечение не приведет к выздоровлению.
Также необходимо учитывать сопутствующие проблемы со здоровьем, а они, как правило, имеются, потому что злокачественные опухоли предстательной железы чаще диагностируются у мужчин пожилого возраста. Такие пациенты часто страдают артериальной гипертензией, имеют в анамнезе перенесенный инсульт или инфаркт. В таких случаях операция часто бывает противопоказана.
Современные методы лечения рака простаты
Лечение при онкологии простаты может включать хирургическое вмешательство, лучевую терапию, химиотерапию, гормональную терапию. В некоторых случаях врач придерживается тактики активного наблюдения.
Активное наблюдение
У некоторых мужчин в силу возраста или сопутствующих проблем со здоровьем лечение может привести к осложнениям и побочным эффектам, которые бывают более серьезны, чем проблемы, создаваемые самим раком. В таких случаях врач может придерживаться активного наблюдения. Такая тактика возможна в следующих случаях:
- Пациент не испытывает симптомов.
- По прогнозам опухоль будет расти медленно.
- Опухоль имеет небольшие размеры.
- Рак не распространяется за пределы предстательной железы.
Тактика активного наблюдения предполагает осмотры врача и анализы крови на простатспецифический антиген каждые полгода. Раз в год врач может назначить биопсию простаты.
Хирургическое лечение рака предстательной железы
При раке простаты выполняют радикальную простатэктомию – операцию, во время которой удаляют предстательную железу и окружающие ткани, включая семенные пузырьки.
Радикальная простатэктомия может быть выполнена разными способами:
- Позадилобковую простатэктомию выполняют через продольный разрез от пупка до лобка. Обычно пациента выписывают из клиники через несколько дней после операции, восстановительный период продолжается несколько недель.
- При промежностной простатэктомии делают дугообразный разрез между мошонкой и анусом. Эта операция более быстрая по сравнению с позадилобковой простатэктомией, но во время нее затруднен доступ к лимфатическим узлам, и она чаще приводит к проблемам с эрекцией.
- Лапароскопическая простатэктомия выполняется с помощью специальных инструментов через проколы в брюшной стенке. Она сопровождается меньшим кровотечением и меньшей травматизацией тканей по сравнению с открытыми вмешательствами, укорачивается восстановительный период. Но риск осложнений примерно тот же.
- Роботизированная простатэктомия проводится с применением робота да Винчи. По сути это то же лапароскопическое вмешательство, но хирург держит инструменты не сам, а управляет движениями робота через специальный пульт. Благодаря этому движения инструментов более точные. Но нет доказательств того, что это помогает снизить риск осложнений.
Возможные осложнения после радикального удаления простаты: недержание мочи, эректильная дисфункция, небольшое укорочение полового члена, паховая грыжа, бесплодие, лимфедема (отек из-за удаления лимфатических узлов).
Лучевая терапия при раке простаты
Лучевая терапия может быть назначена в качестве альтернативы хирургическому лечению. По эффективности она зачастую не уступает операции. Другие показания:
- В сочетании с гормональной терапией при раке, который распространился за пределы предстательной железы.
- При рецидиве рака.
- В качестве паллиативного лечения на поздних стадиях. Это помогает сдержать рост опухоли и увеличить продолжительность жизни пациента.
При раке простаты применяют два вида лучевой терапии: внешнюю и внутреннюю (брахитерапию). Внешнее облучение бывает разных видов:
- Трехмерная конформная лучевая терапия использует компьютерные технологии, чтобы определить точное местоположение предстательной железы и опухоли. Это помогает уменьшить повреждение окружающих здоровых тканей.
- Интенсивно-модулированная лучевая терапия – более совершенная разновидность 3D-конформной лучевой терапии. Аппарат не только облучает опухоль под разными углами, но и регулирует интенсивность излучения. Это позволяет подавать на простату еще большую дозу, избегая облучения здоровых тканей.
- Стереотаксическая терапия использует современные технологии, чтобы доставить всю дозу излучения туда, где находится злокачественная опухоль. Она позволяет сократить курс лучевой терапии, в итоге он продолжается дни вместо недель.
При брахитерапии небольшую гранулу, которая является источником излучения, помещают непосредственно в предстательную железу. Этот метод лечения применяется у мужчин с раком простаты на ранних стадиях, который медленно растет. На более поздних стадиях брахитерапию иногда применяют в сочетании с внешней лучевой терапией.
Химиотерапия при раке простаты
Химиотерапия не является основным методом лечения рака предстательной железы, но иногда она может быть полезна. Химиопрепараты назначают в сочетании с гормональными препаратами или в случаях, когда гормональная терапия не работает.
При раке простаты применяют препараты: доцетаксел, кабазитаксел, митоксантрон, эстрамустин.
Гормональная терапия при раке простаты
Известно, что мужские половые гормоны – андрогены – стимулируют рост рака предстательной железы. Цель гормональной терапии состоит в том, чтобы снизить уровень андрогенов в организме или не допустить их взаимодействия с раковыми клетками.
Гормональная терапия останавливает рост опухоли на некоторое время. В качестве монотерапии она не способна вылечить. Показания к ее назначению:
- Наличие противопоказаний к хирургическому лечению и лучевой терапии.
- Распространенный рак простаты, когда операция и лучевая терапия неэффективны.
- При агрессивных опухолях, когда высок риск рецидива, гормональную терапию назначают вместе с лучевой терапией.
- Ее могут назначить и до лучевой терапии, чтобы затормозить рост опухоли и улучшить результаты лечения.
Лечение рака простаты постоянно совершенствуется. Совсем недавно в результате крупного исследования было доказано негативное воздействие гормональной терапии пациентам с рецидивирующим процессом и низким уровнем ПСА. Врачи Европейской клиники внимательно следят за подобными изменениями и предлагают своим пациентам только то лечение, которое отвечает современным стандартам.
Лечение рака простаты 4 стадии
При IV стадии рак простаты распространяется на мочевой пузырь, прямую кишку, лимфоузлы, появляются удаленные метастазы в костях и различных органах. Но даже на этой стадии, в зависимости от распространенности процесса, иногда можно добиться ремиссии. В случаях, когда рак неизлечим, паллиативное лечение поможет на некоторое время сдержать его рост и продлить жизнь больного.
Обычно лечение рака предстательной железы 4 стадии включает следующие мероприятия:
- Гормональная терапия, в некоторых случаях – в сочетании с химиотерапией.
- Хирургическое лечение. Если рак не распространился на лимфоузлы, и нет удаленных метастазов, можно провести радикальную простатэктомию. В других случаях для борьбы
- с симптомами прибегают к паллиативному вмешательству – трансуретральной резекции простаты (ТУРП).
- Если пациенту противопоказаны все виды лечения, и у него нет выраженных симптомов, возможно активное наблюдение.
Лечение метастазов рака простаты в кости
Если обнаружены метастазы в костях, назначают гормональную терапию, лучевую терапию, химиотерапию. Кроме того, в лечении метастаз в кости при раке простаты применяют бисфосфонаты (препараты, которые замедляют разрушение кости), деносумаб (тот же эффект, что у бисфосфонатов, но другой механизм действия), препараты гормонов коры надпочечников (уменьшают боли), обезболивающие средства.
Преимущества лечения рака предстательной железы в Европейской клинике
Главные отличия Европейской клиники:
- Мы всегда действуем в интересах пациента. Когда врач выбирает методы лечения, он стремится к тому, чтобы достичь максимального эффекта с минимальными рисками для больного.
- В Европейской клинике с пациентом работает команда врачей: клинический онколог, онкоуролог, химиотерапевт, онколог-радиолог.
- Простатэктомия – серьезное вмешательство. Мы заботимся о безопасности пациентов, поэтому перед хирургическим вмешательством проводится тщательное обследование, больного консультирует терапевт, невролог, кардиолог, анестезиолог-реаниматолог.
- У нас можно получить второе мнение авторитетных врачей из Европы, Израиля, США.
- В Москве и Краснодаре мы проводим лечение рака простаты по международным протоколам, в соответствии с принципами доказательной медицины.
Отзывы пациентов о лечении рака простаты в Европейской клинике
Я был на наблюдении в районной клинике многие годы и был готов к тому, что у меня рано или поздно найдут рак простаты. Он был у моих деда и отца. Они оба умерли не от него, но всё равно достаточно тревожно. Так вот, полгода назад онкомаркеры таки показали опухоль. Клинику я выбирал исключительно по интернету, составил список из пяти, на мой взгляд, лучших, а потом обзванивал. В итоге, остановился на Европейской клинике. Когда приехал на приём – сразу стало как-то спокойно. Меня принял Аветис Агванович, очень обстоятельно и подробно объяснил мой диагноз, его перспективы и способы его лечения. Сразу видно, что специалист владеет вопросом «на отлично». Сделали кое-какие анализы и процедуры. Резать пока не стали. Возможно, и не придётся. Сейчас я полностью владею ситуацией, точно знаю, что там у меня происходит, а главное, точно знаю, что есть отличный врач, который помнит меня лично и готов реагировать в любой нужный момент. Спасибо, Аветис Агванович, и до следующего осмотра! Игорь Андреевич Щ.
Источник

