Лимфоцеле после удаления мочевого пузыря
© С. Х. Аль-Шукри, Е. С. Невирович, И. В. Кузьмин, А. Г. Борискин
Кафедра урологии Санкт-Петербургского государственного медицинского университета имени акад. И. П. Павлова
Проведен анализ результатов радикальной простатэктомии (РПЭ) у 128 больных, проходивших лечение в клинике урологии СПбГМУ им. акад. И.П.Павлова с 2005 по 2012 годы. Возраст больных от 52 до 81 года (в среднем – 66,0 лет). Интраоперационная летальность отсутствовала. Интраоперационные осложнения включали травму прямой кишки у 4 пациентов (2,3%) и повреждение мочеточника у 1 пациента (0,7%). К поздним осложнениям относились стриктура пузырноуретрального анастомоза – у 5 больных (3,9%), недержание мочи более 12 месяцев после операции – у 5 больных (3,9%). Проведенный статистический анализ не выявил факторов, достоверно влияющих на развитие стриктуры анастомоза. Отмечено, что уровень интраоперационной кровопотери и продолжительность операции достоверно коррелировали с длительностью восстановления удержания мочи после радикальной простатэктомии.
Ключевые слова: радикальная простатэктомия, осложнения; кровотечение; стриктура анастомоза; недержание мочи.
Введение
Радикальная простатэктомия (РПЭ) является одним из ведущих методов лечения локализованных форм рака предстательной железы. Достигнутые в последнее время успехи в развитии урологии позволили значительно улучшить результаты операции. Так, десятилетняя общая выживаемость больных после операции превышает 90% [4]. В этой связи возрастает значимость проблемы улучшения качества жизни больных, перенесших РПЭ [1; 2]. На качество жизни пациентов в большой мере влияют последствия интраоперационных осложнений. Именно этой проблеме уделяется повышенное внимание многих исследователей [3; 8]. Известно, что одним из самых частых интраоперационных осложнений РПЭ многие годы являлось кровотечение [11]. Однако улучшение хирургической техники, особенно при манипуляциях в области дорзального венозного комплекса, методов его лигирования и прошивания, применение современных методов гемостаза («Liga Sure», «Garmonic») позволило значительно снизить объем кровопотери и соответственно время проведения оперативного пособия. При этом такие последствия РПЭ, как стриктура пузырно-уретрального анастомоза и недержание мочи, встречаются еще достаточно часто, а механизмы их возникновения до конца не ясны [5].
Задачей настоящего исследования явилось выявление интраоперационных факторов, влияющих на развитие ранних и поздних осложнений РПЭ.
Пациенты и методы обследования
Проведен анализ результатов 128 РПЭ, выполненных в клинике урологии СПбГМУ им. акад. И. П. Павлова с 2005 по 2011 годы по поводу локализованного рака предстательной железы. Средний возраст больных составил 66 лет и находился в диапазоне от 52 до 81 года. Средний период наблюдения за пациентами в послеоперационном периоде составил 48 месяцев (от 8 до 88 месяцев).
Всем пациентам РПЭ проводили по стандартной методике, описанной P. Walsh [13]. В первые годы выполнения РПЭ анастомоз уретры с мочевым пузырем ушивали отдельными швами рассасывающейся мононитью (монокрил 3/0) с установкой по уретре катетера Foley 20 Fr, который удаляли на 12-14-е сутки после операции. Начиная с 2008 года для этой цели использовали непрерывный шов по методу Veldhoven (нить 3/0), а катетер удаляли на 7-8-е сутки после операции. Большинству больных (78 из 128, 60,9%) выполняли нервосберегающую РПЭ. 5 больных (3,9%) до РПЭ перенесли трансуретральную резекцию предстательной железы по поводу ДГПЖ.
Общая характеристика наблюдавших больных с раком предстательной железы, перенесших РПЭ, представлена в таблице 1. Большинство больных (76,6%) были оперированы в период с 2008 по 2011 годы. Разделение на два периода выполнения РПЭ связано с тем, что вследствие улучшения хирургической техники, накопления хирургического опыта, внедрения современных технологий гемостаза удалось значительно снизить объем интраоперационной кровопотери и время проведения оперативного вмешательства.
Таблица 1. Общая характеристика больных с раком предстательной железы, перенесших РПЭ (n = 128)
| Показатель | Количество больных | |
| n | % | |
Уровень ПСА | ||
| < 4 нг/мл | 6 | 4,7 4,7 |
| 4-10 нг/мл | 56 | 43,7 |
| > 10 нг/мл | 66 | 51,6 |
Стадия рака предстательной железы | ||
| Т1 | 61 | 47,6 |
| Т2 а | 20 | 15,6 |
| Т2 в | 43 | 33,6 |
| Т3 | 4 | 3,2 |
У 61 (47,6%) больного была стадия опухолевого процесса Т1, у 20 (15,6%) – стадия Т2а, у 43 (33,6%) – стадия Т2b, у 4 (3,2%) – стадия Т3.
Уровень ПСА до 10 нг/мл и более 10 нг/мл в дооперационном периоде имели примерно одинаковое число пациентов – соответственно 62 (48,4%) и 66 (51,6%). При этом у 6 (4,7%) больных уровень ПСА не превышал 4 нг/мл. Неоадьювантную и адьювантную терапию проводили соответственно 9 (7%) и 12 (9,4%) пациентам. Неоадьювантную терапию проводили не в нашем лечебном учреждении.
Уровень ПСА до 10 нг/мл и более 10 нг/мл в дооперационном периоде имели примерно одинаковое число пациентов – соответственно 62 (48,4%) и 66 (51,6%). При этом у 6 (4,7%) больных уровень ПСА не превышал 4 нг/мл. Неоадьювантную и адьювантную терапию проводили соответственно 9 (7%) и 12 (9,4%) пациентам. Неоадьювантную терапию проводили не в нашем лечебном учреждении.
Результаты
Изучена частота интраоперационных, ранних и поздних послеоперационных осложнений РПЭ. К интраоперационным мы относили осложнения, возникшие непосредственно во время оперативного вмешательства, к ранним – развившиеся в течение 1 месяца после РПЭ, к поздним – развившиеся более чем через 1 месяц после операции (стриктуры пузырно-уретрального анастомоза и недержание мочи).
Интраоперационные и ранние послеоперационные осложнения
Средний уровень интраоперационной кровопотери составил 480 мл и находился в диапазоне от 200 мл до 2000 мл. При этом во время РПЭ, выполнявшихся в период с 2005 по 2008 годы, средний объем кровопотери составил 600 мл, а в период с 2008 по 2011 годы – 360 мл. Интраоперационное повреждение стенки прямой кишки имело место у 4 (3%) больных: у 3 больных в период с 2005 по 2008 годы и у 1 пациента в период с 2008 по 2011 годы. Травма прямой кишки потребовала ушивания дефекта двухрядным викриловым швом без наложения колостомы. Интраоперационное травматическое повреждение мочеточника отмечено только у 1 (0,7%) пациента, что потребовало выполнения уретероцистонеоанастомоза.
В таблице 2 представлены осложнения РПЭ, разделенные на несколько групп: интраоперационные, ранние и поздние послеоперационные, а также осложнения, непосредственно не связанные с выполнением РПЭ. Необходимо отметить, что летальных исходов во время оперативного вмешательства, а также в раннем послеоперационном периоде не было.
К ранним послеоперационным осложнениям были отнесены несостоятельность пузырноуретрального анастомоза и лимфорея, потребовавшие длительного (более 14 дней) дренирования предпузырного пространства (сavum Retzii), а также лимфоцеле. Отдельно выделены осложнения, непосредственно не связанные с хирургическим вмешательством – обострение хронического пиелонефрита и уретрит.
Наличие поздних осложнений были оценены у всех 128 больных. При наличии жалоб на слабую струю мочи или затрудненное мочеиспускание пациентам проводили урофлоуметрию и измеряли объем остаточной мочи. При скорости потока мочи (Qmax) менее 10 мл/с и объеме остаточной мочи более 100 мл выполняли ретроградную уретроцистографию. Стриктура пузырноуретрального анастомоза была выявлена у 5 (3,9%) больных, сужение наружного отверстия уретры у 1 (0,8%) больного. Всем 5 больным со стриктурой пузырно-уретрального анастомоза производили внутреннюю оптическую уретротомию с лазерной абляцией рубцово измененных тканей. У 1 больного после данной процедуры отмечено недержание мочи, которое было устранено после проведения курса тренировки тазовых мышц по методу А. Кегеля [12]. Больному со стриктурой наружного отверстия уретры произведена меатотомия. По-видимому, возникновение стриктуры наружного отверстия уретры у этого пациента связано с частичной травматизацией слизистой мочеиспускательного канала при катетеризации.
Таблица 2. Характер и частота осложнений радикальной простатэктомии (n = 128)
| Период выполнения РПЭ | Всего | ||
| 2005- 2008 | 2008- 2011 | ||
| n = 30 | n = 98 | n = 128 | |
Интраоперационные осложнения | |||
| Повреждения прямой кишки | 3 (10%) | 1 (1%) | 4 (3,1%) |
| Повреждение мочеточника | 1 (3,3%) | 1 (0,8%) | |
Ранние послеоперационные осложнения | |||
| Несостоятельность анастомоза | 3 (10%) | 1 (1%) | 4 (3,1%) |
| Лимфорея | 6 (20%) | 2 (2%) | 8 (6,3%) |
| Лимфоцеле | 1 (1%) | 1 (0,8%) | |
Осложнения, непосредственно не связанные с выполнением РПЭ | |||
| Хронический пиелонефрит | 3 (10%) | 2 (2%) | 5 (3,9%) |
| Уретрит | 1 (3,3%) | 0 (0%) | 1 (0,8%) |
Поздние послеоперационные осложнения | |||
| Стриктуры анастомоза | 3 (10%) | 2 (2%) | 5 (3,9%) |
| – ранее 6 месяцев после РПЭ | 1 (3,3%) | 0 (0%) | 1 (0,8%) |
| – позднее 6 месяцев после РПЭ | 2 (6,7%) | 2 (2%) | 4 (3,1%) |
| Стриктуры наружного отверстия уретры | 1 (3,3%) | 0 (0%) | 1 (0,8%) |
| Недержание мочи | 3 (10%) | 2 (2%) | 5 (3,9%) |
Результаты статистического анализа не выявили достоверной корреляционной связи между развитием пузырно-уретрального анастомоза и возрастом больного, объемом кровопотери, длительностью операции, назначением неоадьювантной терапии, предшествовавшей трансуретальной резекцией предстательной железы, сохранением сосудисто-нервных пучков и стадией рака предстательной железы.
Для анализа качества удержания мочи больными после перенесенной РПЭ мы использовали такой критерий, как количество урологических прокладок, используемых больным в сутки. Только у 5 (3,9%) из 128 пациентов через 12 месяцев после РПЭ имели место симптомы стрессового недержания мочи. При этом у 90 (70,3%) пациентов удержание мочи восстановилось в течение 3 месяцев после операции, у 18 (14,1%) – в течение 6 месяцев после операции, а у 11 (8,6%) – в течение 12 месяцев после операции. У 4 (3%) больных было выявлено ургентное недержание мочи, связанное с гиперактивностью мочевого пузыря. После проведенной антихолинергической терапии удержание мочи восстановилось у всех пациентов. Пациентам, у которых стрессовое недержание мочи сохранялось более 12 месяцев после РПЭ (5 человек), выполняли слинговую операцию. У всех из них был отмечен положительный эффект от данной операции. При этом у 4 пациентов недержание мочи было устранено полностью, а у 1 пациента существенно уменьшилось (2 урологические прокладки в сутки). Проведенный корреляционный анализ показал зависимость между вероятностью развития недержания мочи в послеоперационном периоде, с одной стороны, и величиной интраоперационной кровопотери и длительностью операции, с другой.
Обсуждение
В настоящей работе исследована частота и ранних, и поздних осложнений РПЭ, а также сделана попытка выявить факторы, спосбствующие развитию этих осложнений.
Интраоперационные осложнения встречаются, по различным оценкам, в 0,8-3,7% случаев [9]. Наиболее частым осложнением во время РПЭ является кровотечение. При том, что уровень интраоперационной кровопотери в нашем исследовании оказался в общем невысоким, отмечено, что во время операции 2008-2011 годов объем кровопотери был почти в два раза ниже, чем в во время операций 2005-2008 годов. Накопление опыта выполнения РПЭ, знание особенностей дорзального венозного комплекса, методов лигирования и прошивания последнего, а также внедрение и использование современных методов лигирования и коагуляции сосудов позволяют получить более детальную визуализацию операционного поля, сократить продолжительность операции и величину интраоперационной кровопотери. Все эти факторы могут стать ключевыми моментами для предотвращения возможных ранних и поздних осложнений РПЭ. Использование непрерывного шва при формировании пузырно-уретрального анастомоза позволило снизить процент развития послеоперационной несостоятельности анастомоза и уменьшить время дренирования мочевого пузыря по уретре до 7 суток.
Поздние осложнения, такие как стриктура анастомоза и недержание мочи, существенно снижают качество жизни больных, перенесших РПЭ [8]. Частота стриктуры пузырно-уретрального анастомоза в позднем послеоперационном периоде, по данным разных исследователей, различна – от 0,48% до 32% [7; 10]. Среди наблюдаемых нами больных частота стриктур пузырно-уретральных анастомозов составила 3,9%. Мы не выявили факторов, влияющих на развитие этого осложнения, хотя у больных перенесших до РПЭ трансуретральную резекцию предстательной железы, во время операции после удаления простаты мы нередко обнаруживали рубцовые изменения шейки мочевого пузыря, которые потенциально могли бы способствовать развитию стриктуры анастомоза. Частота другого осложнения РПЭ, недержания мочи, по данным литературы, варьирует в пределах от 5,0% до 19,9% через 12 месяцев после операции [7; 10]. В нашем исследовании мы обнаружили недержание мочи в этот период только у 3,9% пациентов. В качестве факторов, способствующих развитию послеоперационного недержания мочи, отмечены длительность оперативного вмешательства и величина интраоперационной кровопотери. В этой связи представляется очевидным, что по мере накопления хирургического опыта и навыков выполнения РПЭ риск возникновения послеоперационного недержания мочи будет снижаться.
Заключение
Таким образом, результаты проведенного исследования показали низкую частоту ранних и поздних осложнений РПЭ, выполнявшихся в клинике урологии СПбГМУ им. акад. И. П. Павлова. Полученные данные свидетельствуют о том, что частота осложнений оперативного вмешательства снижается по мере накопления опыта оперирующих хирургов.
Список литературы
1.Arai Y., Egawa S., Tobisu K. et al. Radical retropubic proectomy: trends, morbidity and mortality in Japan // BJU Int. 2000. Vol. 85. P. 287-294.
2. Benoit R. M., Naslund M. J., Cohen J. K. Complications after radical retropubic proectomy in the Medicare population // Urology. 2000. Vol. 56. P. 116-120.
3. Catalona W. J., Carvalhal G. F., Mager D. E., Smith D. S. Potency, continence and complication rates in 1,870 consecutive radical retropubic proectomies // J Urol. 1999. Vol. 162. P. 433-438.
4. Davidson P. J., van den Ouden D., Schroeder F. H. Radical proectomy: prospective assessment of mortality and morbidity // Eur Urol. 1996. Vol. 29. P. 168-173.
5. Dillioglugil O., Leibman B.D, Leibman N. S. et al. Risk factors for complications and morbidity after radical retropubic proectomy // J. Urol. 1997. Vol. 157. P. 1760-1767.
6. Han M., Partin A. W., Pound C. R. et al. Long-term biochemical disease-free and cancer-specific survival following anatomic radical retropubic proectomy. The 15-year Johns Hopkins experience // Urol. Clin. North. Am. 2001. Vol. 28. P. 555-565.
7. Lepor H., Nieder A. M., Ferrandino M. N. Intraoperative and postoperative complications of radical retropubic proectomy in a consecutive series of 1,000 cases // J. Urol. 2001. Vol. 166. P. 1729-1733.
8. Leandri P., Rosol G., Gautier J. R., Ramon J. Radical retropubic proectomy: morbidity and quality of life. Experience with 620 consecutive cases // J. Urol. 1992. Vol. 147. P. 883-887.
9. Mangram A. J., Horan T. C., Pearson M.L. et al. Guideline for prevention of surgical site infection, 1999. Hospital Infection Control Practices Advisory Committee // Infect Control Hosp Epidemiol. 1999. Vol. 20. P. 250-280.
10. Murai M. Summary and characteristics of ‘General rule for clinical and pathological studies on proe cancer.’ 3rd edition // Nippon Rinsho. 2002. Vol. 60 (Suppl. 11). P. 39-43.
11. Myers R. P. Improving the exposure of the proe in radical retropubic proectomy: longitudinal bunching of the deep venous plexus // J. Urol. 1989. Vol. 142. P. 1282-1284.
12. Tienforti D., Sacco E., Marangi F. et al. Efficacy of an assisted low-intensity programme of perioperative pelvic muscle training in improving the recovery of continence after radical proectomy: a randomized controlled trial // BJU Int. 2012. Feb 14. doi: 10.1111/j.1464-410X.2012.10948.x. [Epub a of ].
13. Walsh P. C. Radical proectomy for the treatment of localized proic carcinoma // Urol. Clin. North. Am. 1980. Vol. 7. P. 583-591.
Early and late complications of radical Proectomy
Al-Shukri S.Kh., Nevirovich E. S., Kuzmin I. V., Boriskin A. G.
Summary. The analysis of radical proektomiya (RPE) results at 128 patients taking place of treatment in the clinic of urology of SPbGMU named after academician I. P. Pavlov since 2005 till 2012 is carried out. Age of patients was from 52 to 81 year (averagely – 66.0 years). The intraoperative mortality was absent. The intraoperative complications included the injury of rectum at four patients (2.3%) and damage of the ureter at one patient (0.7%). The late complications included a stricture of vesicourethral anastomosis – at five patients (3.9%), an urine incontinence later than 12 months after the operation – at five patients (3.9%). The carried-out istical analysis didn’t reveal any factors which are istically influenced to the anastomosis stricture development. It is noted that the level of intraoperative hemorrhage and the operation’s duration authentically cor with the duration of urinary retention recovery after radical proektomy.
Key words: radical proektomy; complica tions; bleeding; anastomosis stricture; urine incontinence.
Источник
Основное лечение мышечно-инвазивного рака мочевого пузыря является хирургическое удаление мочевого пузыря.
Причины при которых может рекомендоваться удаление всего пузыря:
- Наличие мышечно-инвазивной опухоли
- Наличие опухоли, которая агрессивно растет, которая имеет множественные злокачественные очаги (мультифокальная) или поверхностная, но имеет рецидивы после химиотерапии или иммунотерапии
- Наличие постоянных болей и кровотечения у пациентов с неизлечимым заболеванием.
Оценить риск удаления мочевого пузыря, можно путем прохождения медицинской комиссии в составе (например, уролог, онколог, хирург, анестезиолог, терапевт).
Важны также такие факторы, как ваш биологический возраст (общесоматическое состояние, ваше самочувствие, измеряемое как состояние работоспособности или ожидаемая продолжительность жизни) и другие заболевания, которые у вас имеются (диабет, сердечные заболевания, гипертоническая болезнь и т.д.). Пациенты старше 80 лет труднее переносят такие операции и имеют более длительный восстановительный период.
Ранние операции на брюшной полости или лучевая терапия затрудняют хирургическое вмешательство, но редко являются причиной отказа от хирургического вмешательства. Избыточный вес не влияет на выживание после операции, но влияет на риск осложнений в послеоперационном периоде.
Удаление мочевого пузыря включает удаление мочевого пузыря, нижний отдел мочеточников и тазовых лимфатических узлов. В зависимости от таких факторов, как расположение опухоли и метод дальнейшего отведения мочи, часть прилежащих половых органов (простата и семенные пузырьки у мужчин, вся уретра, матка у женщин) удаляются.
Как проводится удаление мочевого пузыря?
Удаление мочевого пузыря осуществляется через разрез в брюшной полости (открытый) пациент под общей анестезией (сочетание внутривенных препаратов и ингаляционных газов). Мочевой пузырь, нижний отдел мочеточников, расположенные близко к мочевому пузырю, тазовые лимфатические узлы и (часть) прилежащих половые органы удаляются. Теперь должен быть сформирован другой метод хранения и отведения мочи.
Стандартная методика на данный момент – открытая хирургия. Тем не менее, это может быть сделано менее инвазивно (лапароскопическая или роботизированная хирургия). В настоящее время в специализированных центрах, имеющих специальное оборудование и опытных специалистов, малоинвазивные операции считаются методом выбора для удаления мочевого пузыря.
Как подготовиться к процедуре?
При поступлении в стационар врач информирует вас о том, как нужно готовиться до и что делать после операции.
Часть вашей кишки будет использоваться для создания мочевого резервуара. Врач подробно объяснит, как подготовиться к данной процедуре.
Перед операцией врач подробно проинформирует вас о том, как подготовиться к анестезии. Если вы принимаете какие-либо лекарственные препараты, сообщите об этом своему врачу. Возможно, потребуется отмена некоторых препаратов за несколько дней до операции.
В течение первых нескольких дней вы находитесь под динамическим наблюдением. Врач подробно проинформирует вас о послеоперационном периоде.
Во время госпитализации вы узнаете, как обращаться с уростомой. После того, как вы научитесь использовать и опорожнять уростому, будет установлена дата выписки.
Химиотерапия перед удалением мочевого пузыря
Химиотерапию проводят перед удалением мочевого пузыря, чтобы потенциально уменьшить опухоль и убить опухолевые клетки, которые уже проникли в кровь или лимфатические узлы.
Химиотерапию перед операцией можно рекомендовать пациентам с мышечно-инвазивной формой. Это также необходимо, при опухолях большого размера (> 3 см) или если есть признаки распространения рака на лимфатические узлы (метастазы). Решение о проведении химиотерапии принимается врачебной комиссией (включая онколога, уролога и радиолога). Необходима адекватная функция почек.
Положительная реакция на химиотерапию улучшает выживаемость, но не исключает необходимость хирургического вмешательства.
Химиотерапия после удаления мочевого пузыря
Если опухоль большая (> 3 см), не может быть полностью удалена или распространяется на лимфатические узлы (определяется патологоанатомом), показана химиотерапия после удаления мочевого пузыря. Рак, который распространился на лимфатические узлы, указывает на системное заболевание и может потребоваться системное лечение (с химиотерапией) в определенных случаях.
Отведение мочи: недержание или удержание.
Важно понять двухэтапный подход к удалению мочевого пузыря. Сначала удаляют мочевой пузырь и лимфатические узлы. Затем, мочу нужно отвести. Это может быть достигнуто несколькими способами. Вообще мы различаем варианты, которые являются недержанием (непрерывный поток мочи сразу выходит за пределы тела), и удержание (моча, хранится в организме и отводится при необходимости). Биологический возраст, функция почек и другие заболевания, качество жизни пациента имеют решающее значение при выборе тактики операции. Чтобы определиться, какой вариант лучше подходит в вашей конкретной ситуации, вы должны знать и понимать ограничения после каждого вида операции и побочные эффекты.
В дополнение к вашим личным предпочтениям важна способность физически и морально привыкнуть, и уметь обращаться с таким отведением мочи.
Перемещение мочеточников
Выведение мочеточников через кожу (уретерокутанеостомия).
Перемещая мочеточники или вместе или отдельно через кожу сбоку живота для отведения мочи от почек (стома) (рис.1), моча может просто вытекать через стому в мешок. Это отведение мочи является самым простым. Хотя он редко используется. Данный метод безопасен и доступен для пациентов, с отягощенным анамнезом (предшествующие операции, множественные проблемы со здоровьем, паллиативный уход) или у пациентов, которые не могут позаботиться о себе после операции. Основные осложнения встречаются редко, однако рецидивирующие инфекции и затягивание отверстия (стеноз) являются общими и могут потребовать лечения. Пациентам часто необходимо стентирование мочеточника, который необходимо регулярно менять.
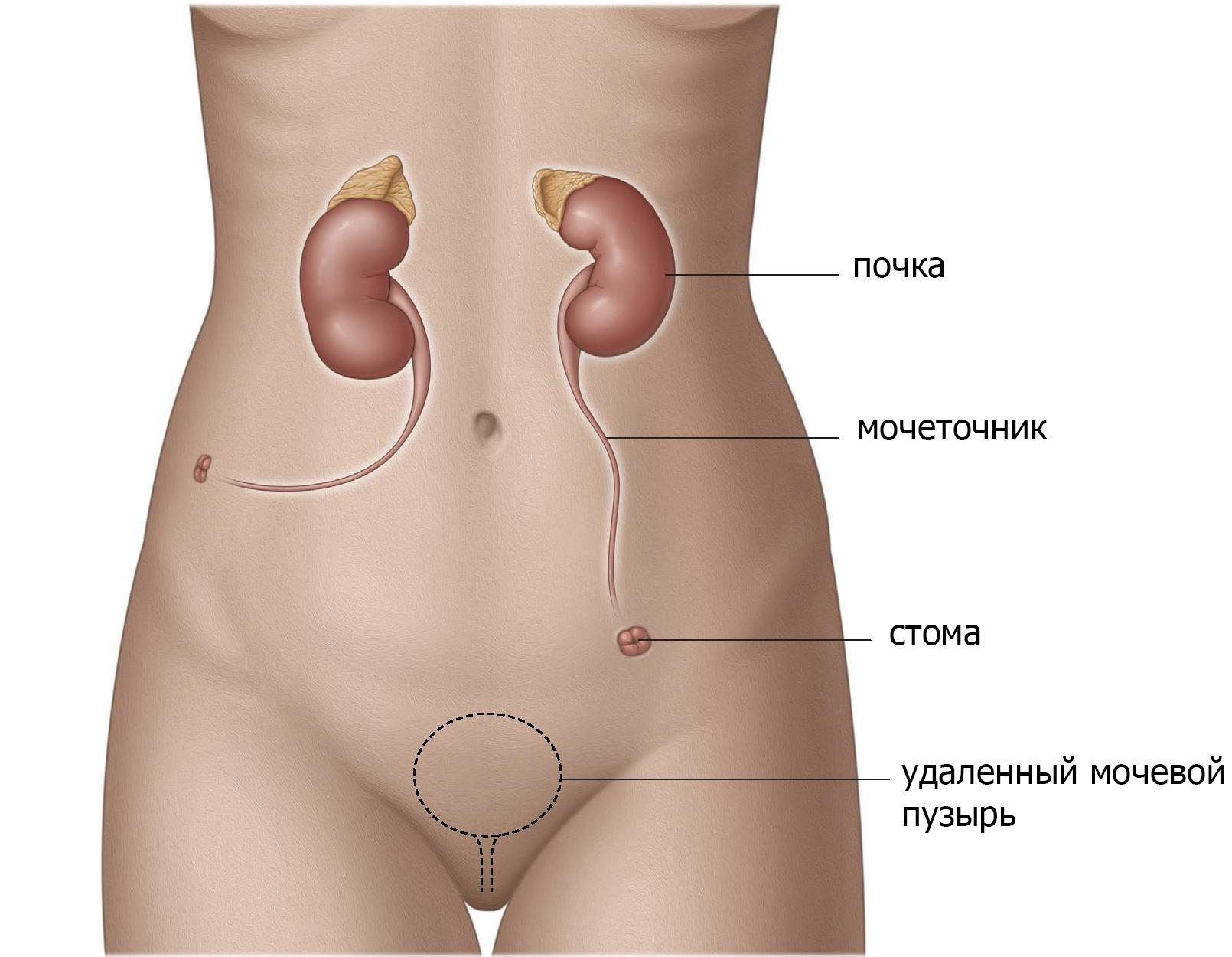
Рис. 1 уретерокутанеостома
Установить часть тонкой кишки между мочеточниками и кожей (подвздошный канал).
Подвздошный канал можно создать, поместив тонкую кишку между мочеточниками и кожей (рис.2). Эта «кишечная стома» создает большее расстояние между почками и кожей и снижает риск инфицирования. Другим преимуществом для пациентов является то, что эта стома легче обрабатывается и имеет меньше осложнений, таких как сужение выводного отверстия (стеноз). Данная операция технически относительно проста и надежна и поэтому является наиболее часто используемой.
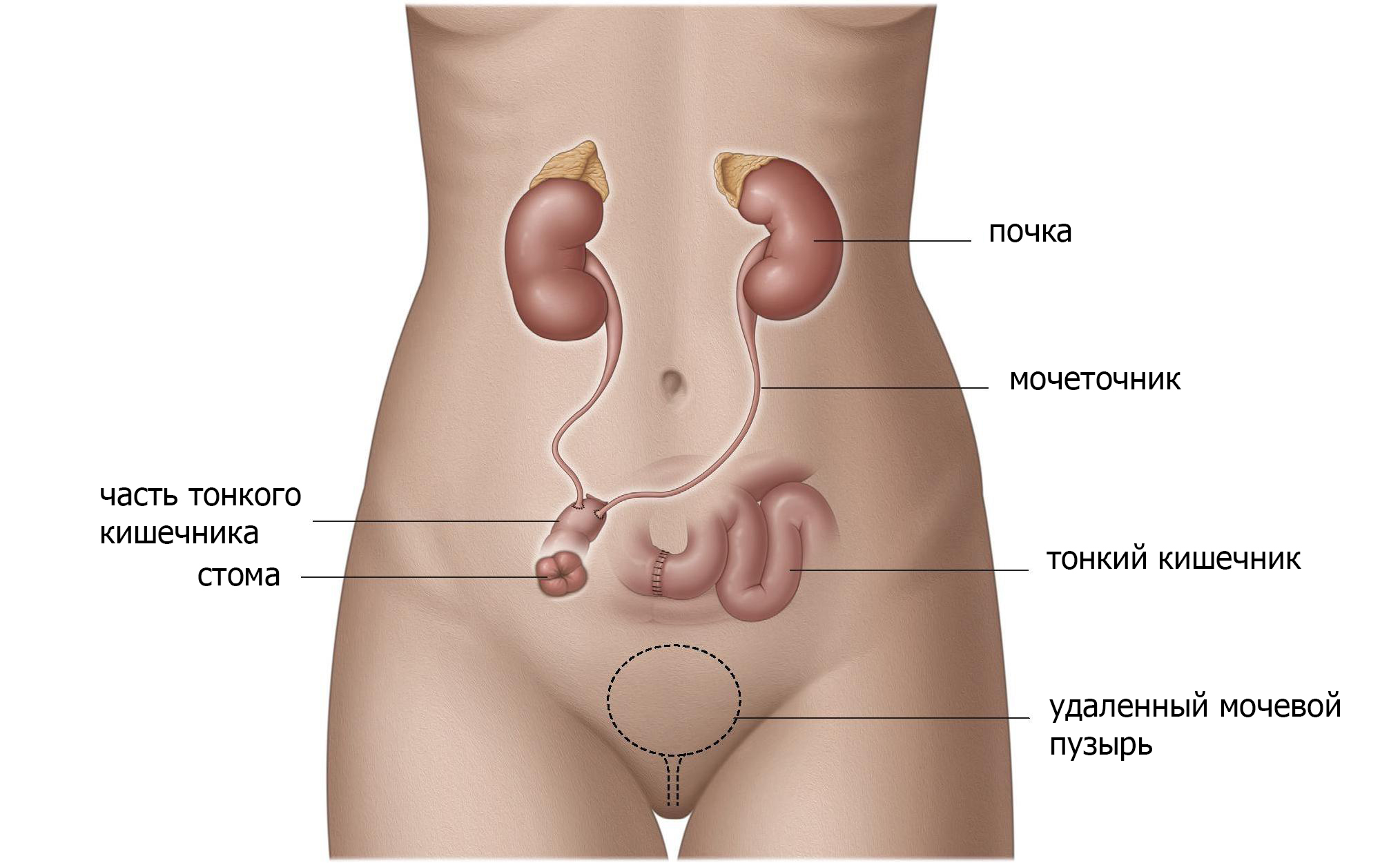
Рис. 2 Подвздошный канал
Выбирая данный вид отведения мочи, вы должны знать, что привыкнуть к жизни со стомой требует много времени и усилий.
Вновь сформированный мочевой пузырь. Создание резервуара внутри тела
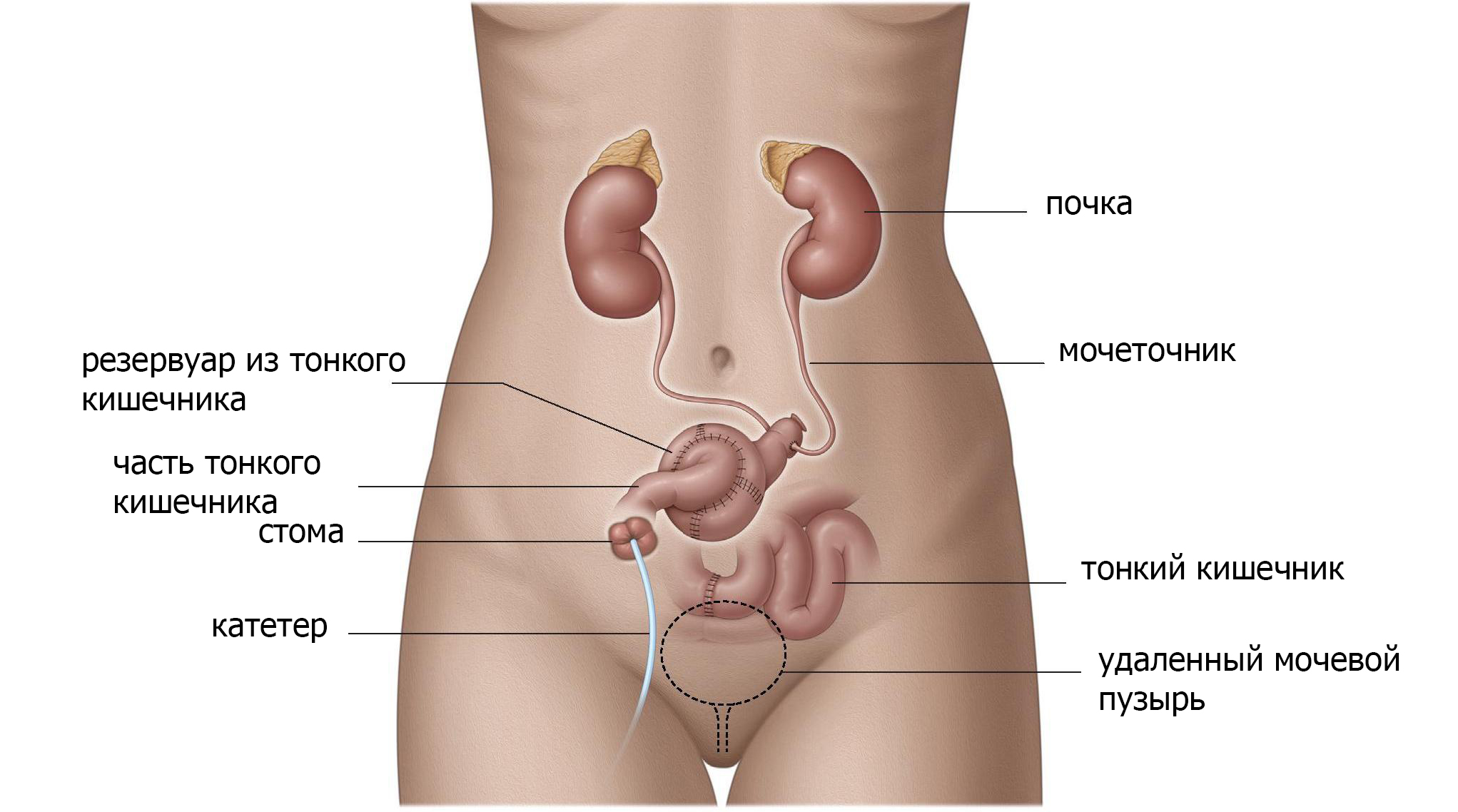
Используя тонкую кишку или толстую кишку, а иногда и аппендикс, создается резервуар в брюшной полости, а затем соединяется с кожей с помощью клапанного механизма (рис. 3). С таким резервуаром низкого давления, моча может быть сохранена в теле. Цель этой процедуры – позволить контролировать опорожнение или обратный поток мочи в почки (рефлюкс). Резервуар опорожняется прерывистой катетеризацией небольшим пластиковым катетером каждые 2-6 часов. Отверстие может находиться где угодно на нижней части живота или в пупке.
Если выбран данный вид операции, вам потребуется регулярно катетеризировать и опорожнять данный резервуар. Функция печени и почек должна быть адекватной из-за реабсорбции мочевых компонентов (соли, мочевой кислоты, воды) в кишечной оболочке резервуара, что вызывает дополнительную нагрузку на эти органы.

Рис. 3 Резервуар из кишечника
Осложнения включают инфекции, недержание мочи, грыжу, рефлюкс, затягивание отверстия (стеноз), а также синдром короткой кишки, метаболический и электролитный дисбаланс.
Поскольку эта операция имеет технические сложности, особенно при создание клапанного механизма, который не всегда бывает удачным, данный метод используется редко.
Имплантация мочеточников в прямую кишку (уретероректонеостомия)
Когда мочеточники имплантируют в прямую кишку, моча хранится в ампуле прямой кишки (рис.4). Анальное отверстие и тазовое дно становятся органом удерживающим мочу и должны функционировать должным образом. Данный вид отведения приводит к смешиванию фекалий с мочой, поэтому опорожнение и дефекация происходят одновременно. Этот метод имеет высокий уровень инфецирования, поэтому используется редко и только при определенных обстоятельствах. Краткосрочные осложнения включают повторяющиеся инфекции (включая воспаление брюшной стенки и почек), затягивание отверстия в прямой кишке (стеноз). Долгосрочные осложнения включают недержание мочи, раздражение кишечника и связанный с этим рак толстой кишки.
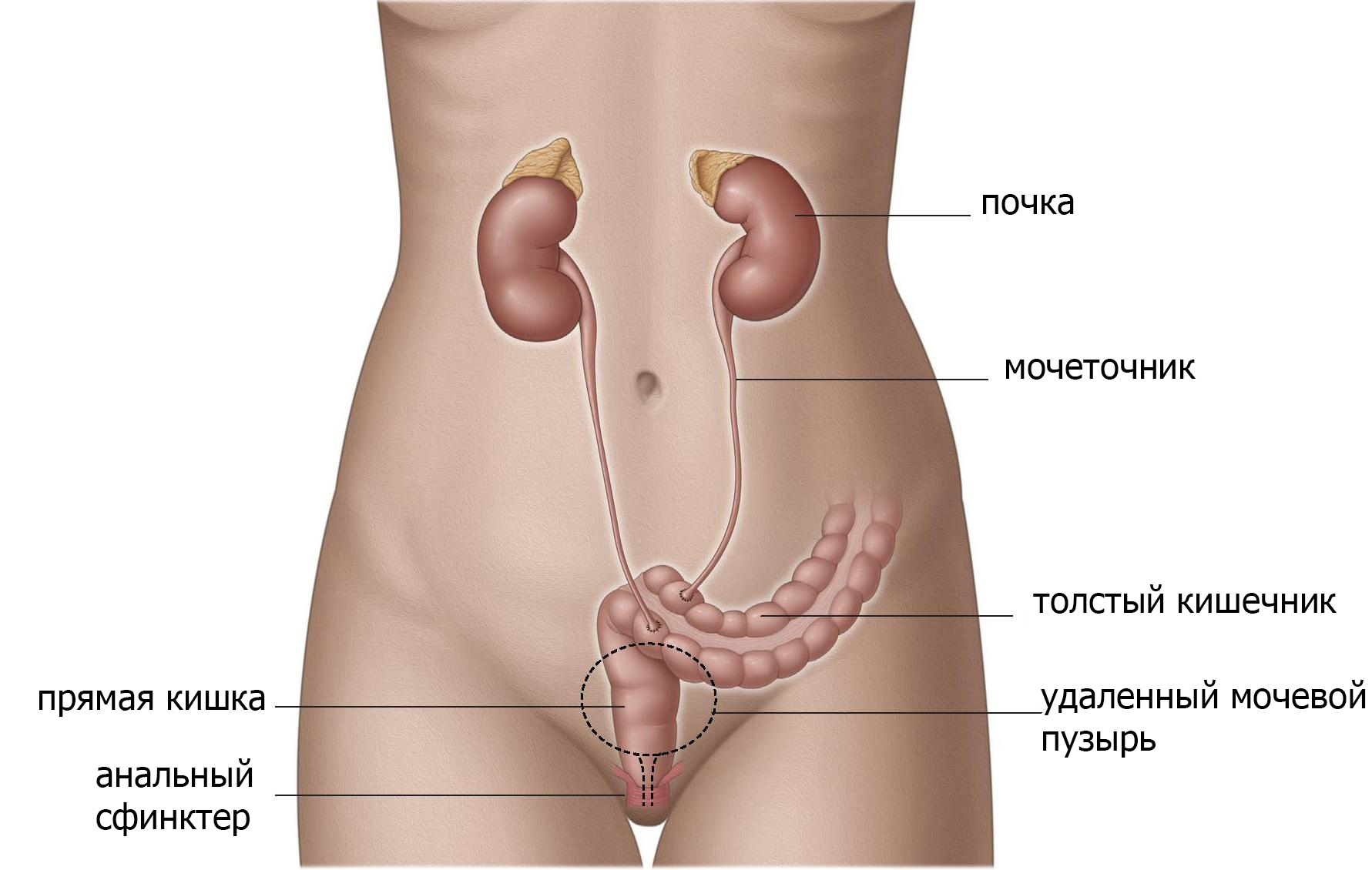
Рис. 4 Уретероректонеостома
Формирование мочевого пузыря из тонкой кишки
Новый мочевой пузырь может быть сформирован из тонкой кишки, которая изолируется от пищеварительного тракта (рис.5). Резервуар сформирован из тонкого кишечника и помещен в малый таз в качестве замены мочевого пузыря. В зависимости от используемой методики резервуар имеет сфероидальную форму, «W» или «V». Мочеточники прикреплены с обеих сторон, а нижний конец соединен с уретрой. Мочевой сфинктер сохраняется. При данный виде операции моча должна накапливаться а затем выводиться наружу как и при здоровом мочевом пузуре.
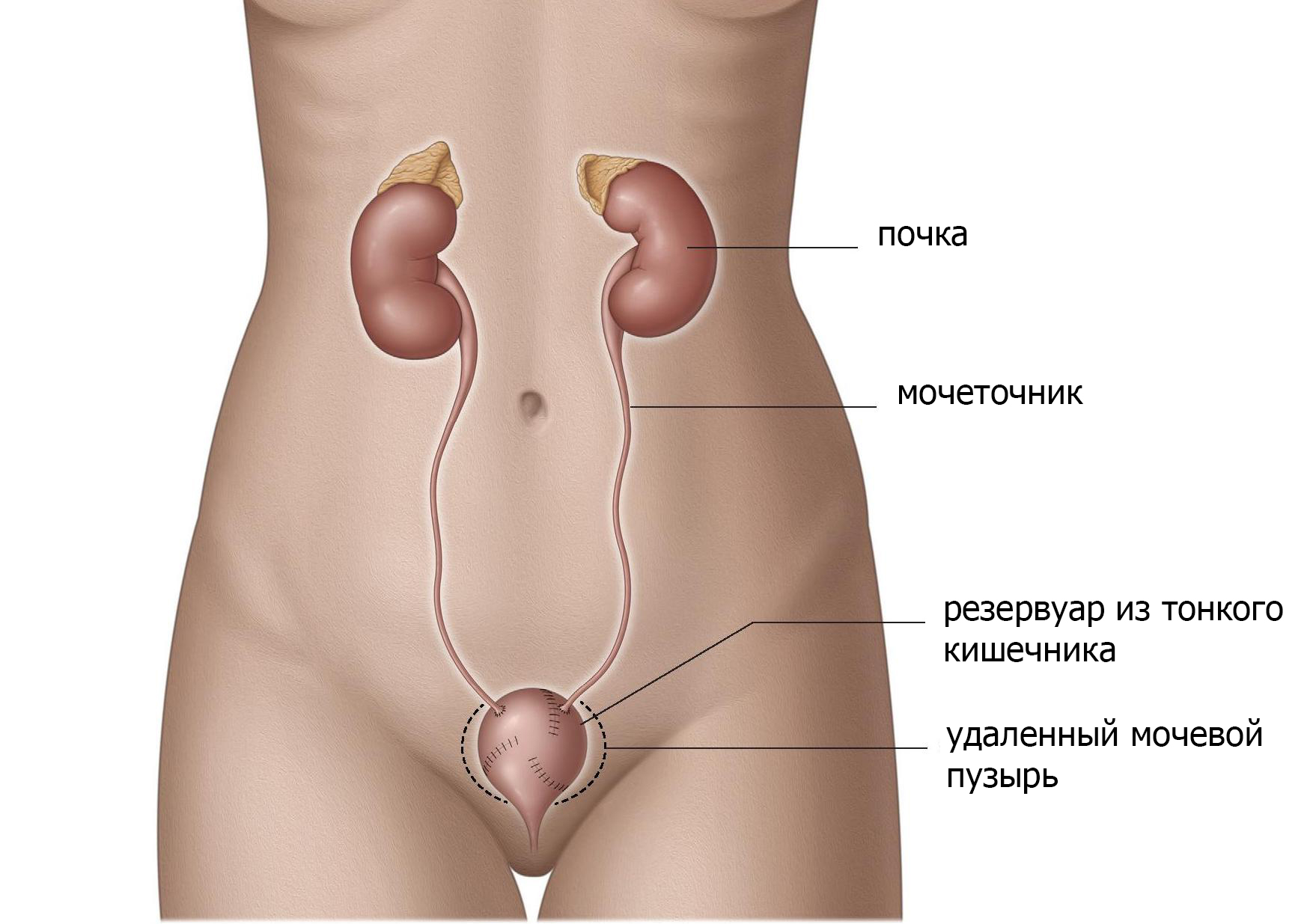
Рис. 5 мочевой пузырь из тонкой кишки
Вы не почувствуете наполнения мочевого пузыря или позыв к мочеиспусканию с пузырем из тонкого кишечника, поэтому опорожнение необходимо проводить каждые 2-4 часа. Пузырь освобождается, расслабляя мышцы тазового дна и сокращая брюшную полость (метод Вальсальвы). Нажатие на живот обеими руками может помочь для полного опорожнения. У 20% женщин необходимо выполнять периодическую самокатетеризацию для полного опорожнения, у мужчин этого не требуется.
При данном виде операции требуется удовлетворительная функция почек и печени, нормальное состояние мышц тазового дна. Осложнения после данного вмешательства включают в себя повторяющиеся инфекции (включая воспаление брюшной стенки и почек) и недержание мочи.
Долгосрочные осложнения включают затягивание отверстия в области анастамоза, изменения верхних мочевых путей, недержание мочи, синдром короткой кишки и грыжу, а также метаболический и электролитный дисбаланс.
Регулярный анализ крови поможет оценить количество мочевой кислоты которая реабсорбируется используемым участком кишечника, вызывая дисбаланс pH, который часто требует медикаментозного лечения пероральными препаратами (бикарбонат натрия – пищевая сода).
Для вновь образованного резервуара требуется время для его укрепления и начала работы. Для увеличить емкость сформированного пузыря, вам нужно будет его тренировать. Врач предоставит вам инструкции по тренировке мочевого пузыря. В начале недержание мочи может случиться из-за послеоперационного отека тазового дна.
Источник
