Как вылечить экстрофию мочевого пузыря

Экстрофия мочевого пузыря – это порок развития мочеполовой системы, при котором формирование мочевого пузыря и передней брюшной стенки в его проекции остается незавершенным. С рождения наблюдается открытая и вывернутая наружу слизистая оболочка задней стенки мочевого пузыря, а также постоянное отделение и стекание мочи из открывающихся в нижней части органа протоков мочеточников. Экстрофия мочевого пузыря часто сочетается с пороками наружных и внутренних половых органов, мочеточников и почек. Диагностируется по характерным внешним признакам, дополнительно проводится рентгенологическое и УЗИ-обследование. Лечение оперативное, выполняются реконструктивно-пластические и заместительные операции.
Общие сведения
Экстрофия мочевого пузыря – одна из наиболее часто встречаемых аномалий развития мочеполовой системы. Частота в популяции – 1 случай на 30-50 тысяч новорожденных, примерно 1/5 часть пациентов имеет сочетанные пороки развития. В большей степени страдают мальчики, по данным разных авторов распространенность патологии среди них в 2-6 раз выше, чем среди девочек.
Специалисты в сфере педиатрии и хирургии сталкиваются с большими трудностями в лечении экстрофии мочевого пузыря, хотя первые операции для коррекции этой аномалии были предложены еще в 1960-х годах. Реконструкция и пластика не приводят к излечению. Сохраняющееся недержание мочи значительно ухудшает качество жизни ребенка, а частые восходящие инфекции становятся причиной хронической почечной недостаточности, представляющей серьезную опасность для жизни.
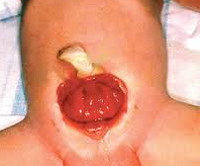
Экстрофия мочевого пузыря
Причины
Конкретной причины данной аномалии развития не выявлено, патология считается мультифакториальной. Доказана генетическая предрасположенность к некоторым сочетанным порокам органов брюшной полости, в числе которых присутствует и экстрофия мочевого пузыря. Кроме того, повышает риск развития аномалии воздействие различных токсических и инфекционных агентов во время беременности, в частности, курение, внутриутробные инфекции, некоторые медикаменты и т. д. Травмы плода также могут способствовать нарушению правильного эмбриогенеза с развитием пороков.
Патогенез
Основной патогенетический момент экстрофии мочевого пузыря – задержка обратного развития клоакальной перегородки, которая препятствует внедрению мезодермального листка между наружным и внутренним эмбриональными слоями. Это приводит к тому, что процесс формирования стенок мочевого пузыря оказывается незавершенным, и орган остается открытым и вывернутым наружу. Описанные процессы в норме протекают на 4-6 неделе эмбрионального развития, поэтому воздействие тератогенных факторов наиболее опасно в самом начале беременности. Впрочем, это касается не только экстрофии мочевого пузыря, но и большинства пороков развития.
Симптомы
Проявления порока визуально заметны сразу после рождения. Неонатолог при осмотре новорожденного обращает внимание на ярко-красную слизистую оболочку мочевого пузыря, которая замещает отсутствующую часть передней брюшной стенки. Слизистая, как правило, имеет обычную морфологию, но возможно и псевдопапилломатозное изменение. В нижней части заметны отверстия мочеточников, из которых постоянно выделяется моча.
С течением времени основной проблемой при экстрофии мочевого пузыря становится раздражение окружающих тканей мочевыми солями, постоянная мацерация вокруг открытого участка и в области бедер. Инфицирование слизистой оболочки мочевого пузыря является причиной восходящей инфекции мочеточников и почек.
Экстрофия мочевого пузыря часто сочетается с аномалиями верхних мочевыводящих путей. Кроме того, экстрофии всегда сопутствует расхождение лобкового симфиза. Вследствие анатомических различий у мальчиков и девочек наблюдаются разные изменения в соседних органах. У мальчиков встречается расщепление пещеристых тел или их редукция, у девочек – расщепление клитора, аномалии развития влагалища.
Диагностика
В последние годы активно развиваются методы антенатальной диагностики данного порока. Экстрофия мочевого пузыря может быть заметна уже на втором УЗИ-скрининге, однако такое случается не всегда. Часто аномалия развития обнаруживается только после рождения. Поскольку симптоматика специфична, диагноз не вызывает сомнений.
Обязательно проведение рентгенографии брюшной полости для выявления сочетанных пороков, в первую очередь, в мочевыделительной системе, но также в кишечнике и спинном мозге (наиболее характерные сочетания с экстрофией мочевого пузыря). С этой же целью проводится УЗИ. Рекомендована экскреторная урография, которая позволяет убедиться в целостности и правильном развитии мочеточников и почек.
Лечение экстрофии мочевого пузыря
Лечение оперативное. Тип операции зависит от степени экстрофии мочевого пузыря, а именно – от размеров вывернутой части органа и, соответственно, отсутствующего сегмента передней брюшной стенки, а также от сопутствующих пороков развития. Если размер дефекта не превышает 4 см, проводится реконструктивно-пластическое вмешательство, цель которого – закрытие дефекта с помощью близлежащих тканей и восстановление целостности мочевого пузыря. Этого достаточно, поскольку гистологически орган развит правильно, несмотря на патологию в анатомии.
В случае больших размеров дефекта создается искусственный мочевой пузырь, который может выполнять функцию резервуара и опорожняться по желанию. Также часто мочеточники выводятся в сигмовидную кишку (уретеросигмостомия) – это обязательная мера в случае их расщепления.
Большую проблему для детских хирургов представляет расхождение костей таза при экстрофии мочевого пузыря. Накопленный врачебный опыт говорит о высокой частоте неудовлетворительных результатов операций, что связано с большим количеством сочетанных пороков и значительным дефектом передней брюшной стенки.
Прогноз и профилактика
Прогноз для выздоровления сомнительный. Неоперированные пациенты редко доживают до 10 лет. Что касается успеха оперативного лечения, то 20-80% проведенных вмешательств приводят лишь к незначительному улучшению. Нарушения уродинамики продолжают прогрессировать, сохраняется недержание. Риск развития восходящей инфекции остается высоким.
Профилактика экстрофии мочевого пузыря возможна в антенатальном периоде, еще лучше – на этапе планирования беременности, чтобы максимально исключить воздействие тератогенных факторов, особенно на этапе закладки основных органов и систем, то есть в первые 4-8 недель внутриутробного развития.
Источник
Медицинский эксперт статьи
х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
При первичных формах эписпадии всегда обнаруживают дорсальную девиацию полового члена с углами последней, превышающими 50°. При ятрогенных девиациях наиболее часто отмечают комбинированную дорсолатеральную деформацию с осевой ротацией кавернозных тел. По данным С. Woodhouse (1999), дорсальную деформацию наблюдают у 77% взрослых пациентов, односторонний фиброз кавернозных тел – в 9% случаев, а у 14% пациентов обнаруживают двустороннее поражение кавернозных тел. Сложные деформации у взрослых пациентов считают результатом предшествующих реконструктивных вмешательств, в том числе и с использованием кавернозных тел, в частности белочной оболочки в качестве пластического материала.
Как правило, лечение экстрофии мочевого пузыря (пластика передней брюшной стенки, формирование мочевого пузыря) и устранение недержания мочи выполняют в раннем детском возрасте. Уретропластика, коррекция девиации полового члена – второй этап, осуществляемый у 5-7-летних детей. Большинство авторов придерживаются концепции полной анатомической реконструкции тазового кольца при первичном формировании мочевого пузыря. Только такой подход позволяет повысить эффективность коррекции недержания мочи и сохранить емкость мочевого пузыря, что, в свою очередь, избавляет пациента от калечащих деривационных методик – уретеросигмостомии, уретероректостомии и др. По мнению P. Sponseller (1995), наилучших результатов достигают при использовании латеральной поперечной остеотомии. Существующие методики пластик, устраняющих недержание мочи, весьма многочисленны. В России широкое распространение получили методики В.М. Державина и пластика сфинктера no Young-Dees. Последнюю в различных модификациях широко используют в Европе. Некоторые авторы рекомендуют укрепление тазового дна синтетической петлёй, окутывание сформированной шейки мочевого пузыря силиконовой манжеткой, лоскутом сальника и лоскутом детрузора, подвешиванием мочеиспускательного канала на петле к передней брюшной стенке. Применяют различные варианты слинговых операций – ТVТ и др. Выполнение петлевой пластики шейки мочевого пузыря и мышц тазового дна принесло положительные результаты. Также применяют операции Гебеля-Штеккеля, укрепление шейки мочевого пузыря демукознрованной створкой последнего. Относительно удовлетворительные результаты были получены при использовании петлевой пластики мышц тазового дна. Описано имплантация искусственного сфинктера мочевого пузыря у пациентов более зрелого возраста, но, если учитывать предшествующие оперативные вмешательства, этот вид лечения сопряжён с риском развития эрозии мочеиспускательного канала и неполноценности сфинктера. В педиатрической практике и у пациентов более зрелого возраста для коррекции недержания мочи применяют периуретральные подслизистые инъекции тефлона и коллагена. Тем не менее, несмотря на значительные успехи пластической реконструктивной хирургии в коррекции экстрофни и эписпадии, отрицательные результаты функциональной реконструкции мочевого пузыря наблюдают довольно часто и проблема недержания мочи у таких пациентов остается актуальной.
В 1895 г. J. Cantwell впервые выполнил уретропластику при тотальной эписпадии. Суть методики состояла в полной мобилизации дорсальной уретральной пластинки и расположении тубуляризированного мочеиспускательного канала под кавернозными телами, которые были предварительно ротированы в дорсальном направлении и соединены в средней трети. Многие существующие в настоящее время методики – различные модификации операции Cantwell. Частота осложнений при этом типе вмешательств – около 29%.
В 1963 г. Е. Michalowski и W. Modelski предложили многоэтапный вариант коррекции эписпадии. С этого времени было разработано множество вариантов поэтапной уретропластики с использованием кожных, препуциальных и островковых лоскутов. Различные методики коррекции экстрофии и эписпадии были заимствованы из техники выполнения уретропластик, применимых при гипоспадии, например накладные уретропластики с использованием лоскута из слизистой оболочки щеки. Многообразное оперативное лечение эписпадии и экстрофии мочевого пузыря неоднозначное по результатам, не лишены недостатков и сопряжены с осложнениями, наблюдаемыми при оперативной коррекции гипоспадии. Наибольшее число последних возникает при выполнении методики Тирша-Янга и использовании перемещённого островкового лоскута крайней плоти. По данным P. Caione (2001), частота осложнений составляет 66% и 73% соответственно. По результатам исследований, при экстрофии частота осложнений достигает 64% против 33% при тотальной эписпадии в сочетании с недержанием мочи.
Для устранения деформации при эписпадии и экстрофии в редких случаях применяют методы корпоропластики, используемые при приобретённых деформациях, например при болезни Пейрони. Отличия заключаются в том, что их, как правило, применяют только при выраженной асимметрии кавернозных тел и в качестве пластического материала используют только кожный лоскут и твёрдую мозговую оболочку. В подавляющем большинстве случаев выполняют методику вентральной ротации кавернозных тел, впервые предложенную S. Koff (1984). В последующем её модифицировали. В настоящее время она известна как корпоропластика Cantwell-Ransley и состоит в ротации кавернозных тел и наложении каверно-каверностомы в точке максимальной девиации.
Всё более широкое распространение приобретает методика, предложенная М. Mitchell и D. Bagli в 1996 г. и состоящая в выполнении полной пенильной препаровки и создании новых анатомических взаимоотношений между уретрой и кавернозными телами.
Принцип оперативной коррекции эписпадии по методу Mitchell основан на том, что анатомия полового члена при этой аномалии отлична от таковой при гипоспадии в связи с различным эмбриогенезом этих состояний.
Гипоспадия представляет собой фиксацию на пути нормального развития урогенитального тракта, в то время как эписпадия – грубое искажение нормального его развития. При эписпадии уретральная пластинка полностью сформирована, деформирующий процесс приводит лишь к нарушению её закрытия. Кавернозные тела расщеплены, но имеют нормальную иннервацию и кровоснабжение, хотя особенности последнего остаются предметом дальнейшего изучения.
В отличие от способа S. Perovic (1999), при использовании метода Mitchell-Bagli не происходит нарушения гланулоапикальных взаимоотношений. Интерес представляет предложенная P. Caione в 2000 г. модификация операции Mitchell, состоящая в создании полумуфты, имитирующей наружный сфинктер, из промежностного мышечного комплекса и парапростатических тканей в области шейки мочевого пузыря.
Частота осложнений после операции Mitchell и различных её модификаций составляет 11%, а частота развития свищей неоуретры – 2,4% против 5-42% при операции Cantwell-Ransley.
Достаточно сложными и до конца не решёнными остаются проблемы коррекции длины полового члена. К сожалению, выполняемые в детском возрасте вмешательства, направленные на максимально возможное выделение кавернозных тел, вплоть до отделения их от нижней ветви лобковой кости, в совокупности с коррекцией искривления по Cantwell-Ransley, не дают значимого увеличения длины полового члена. Более того, полная мобилизация кавернозных тел сопряжена с риском повреждения кавернозных артерий.
[1], [2], [3], [4], [5], [6], [7], [8]
Метод одномоментной урогенитальной реконструкции (операция Ковалёва-Королёвой)
В 1998 г. В. Ковалёвым и С. Королёвой было предложено оперативное лечение эписпадии и экстрофии мочевого пузыря у взрослых. Его отличительная особенность – одномоментное выполнение удлиняющей уретро-. корпоро-, глануло-, спонгио-, сфинктеро- и абдоменопластики.
Во всех случаях была использована техника полной пенильной препаровки. При сохранности уретральной пластинки выполняли её отделение от кавернозных тел, мобилизацию до области семенного бугорка или мочевого пузыря. В дальнейшем производили препаровку кавернозных тел с иссечением хорды и рубцовых тканей. Собственную уретральную пластинку тубуляризируют, выполняют билатеральные корпоротомии. Считают оправданным и целесообразным выполнение нескольких билатеральных корпоротомии (не менее двух), так как после мобилизации уретральной пластинки, иссечения хорды и рубцовых тканей единичной срединной корпоротомии для полной коррекции деформации полового члена бывает недостаточно. Это связано с комбинированным характером пенильной девиации, а также с непосредственным участием интракорпоральных факторов в её формировании у взрослых пациентов. В качестве пластического материала для корпоропластики используют аутовенозный лоскут (v. saphena magna), для чего выполняют соответствующий доступ на медиальной поверхности бедра. После выполнения корпоротомии разница в длине тубуляризированной уретральной пластинки и кавернозных тел становится очевидной. С целью удлинения мочеиспускательного канала осуществляется забор островкового васкуляризированного лоскута на питающей ножке. Двухуровневая корпоропластика позволяет одновременно устранить девиацию и увеличить длину полового члена. Выделенный островковый лоскут тубуляризируют и выполняют анастомоз с тубуляризированной собственной уретральной пластинкой (уретро-неоуретроанастомоз). Протяжённость наращиваемой части мочеиспускательного канала (неоуретры) зависит от наличия пластического материала и длины кавернозных тел после корпоропластики и составляет от 2 до 6 см. Формирование артифициального произвольного сфинктера мочевого пузыря осуществляют с помощью ротации васкуляризированного мышечного лоскута прямой мышцы живота и её транспозиции в зону шейки мочевого пузыря с созданием вокруг неё мышечной муфты. Абдоменопластику выполняют с помощью фиксации лоскута прямой мышцы живота в пубикальной зоне, что способствует восполнению имеющегося вследствие диастаза лонных костей дефекта лона, дополнительной герметизации швов мочевого пузыря и мочеиспускательного канала, улучшению трофики тканей, а также придаёт вертикальную направленность мышечным волокнам при их транспозиции в область шейки. По окончании оперативного вмешательства производят ротацию кавернозных тел и вентральную транспозицию неоуретры с формированием наружного отверстия на головке полового члена. В некоторых случаях при дефиците пластического материала и недостаточной длине неоуретры наружное отверстие формируют по типу венечной гипоспадии. Питающая ножка уретрального лоскута при смещении его на полярную поверхность полового члена не только улучшает трофику неоуретры и герметизирует швы после тубуляризации лоскута и уретральных анастомозов, предотвращая таким образом образование свищей, но и обеспечивает косметический эффект наличия спонгиозного тела мочеиспускательного канала (спонгиопластика). Косметический эффект тем более выражен, чем больше толщина питающей ножки. Кожный дефект восполняют с помощью местных тканей и перемещённых васкуляризированных лоскутов.
В послеоперационном периоде необходимо назначать антикоагулянты, дезагреганты, ангиопротекторы, антиоксиданты, озонотерапию, лазертерапию, вакуумную терапию для улучшения микроциркуляции и трофики лоскутов. Альфа-адреноблокаторы применяли для устранения гиперрефлексии мочевого пузыря и симпатического констрикторного влияния. Кроме того, выполняли тренировку произвольного артифициального сфинктера мочевого пузыря. В реабилитационную программу включали сексологический тренинг, различные методики психотерапии, медикаментозную коррекцию психоэмоциональных расстройств.
Результаты и обсуждение
Оценку результатов оперативного лечения эписпадии и экстрофии мочевого пузыря проводили в сроки от одного до десяти лет. Всего были прооперированы 34 пациента. Критериями оценки исходов оперативных вмешательств служили функциональные и эстетические результаты. Сфинктеропластику выполняли в 73,5% наблюдений при сохранной резервуарной функции мочевого пузыря, а удлиняющую уретро- и корпоропластику всем пациентам, в том числе и перенёсшим различные виды кишечной деривации мочи, поскольку даже при отсутствии естественного акта мочеиспускания формирование мочеиспускательного канала как эякуляторного канала – важный компонент социальной и сексуальной реабилитации. Косметический эффект оценивали на основании внешнего вида полового члена, его длины, формы головки, отсутствия или наличия деформации. С помощью описанного метода было достигнуто удлинение полового члена на 2-2,5 см, что позволило в ряде случаев использовать экстендер и добиться дополнительного удлинения на 1 см.
Визуальное выпрямление полового члена в расслабленном состоянии достигнуто у всех больных. У 80% больных угол эректильной деформации не превышал 20%, что расценивали как функционально незначимую, не требующую коррекции. В нескольких наблюдениях рецидив девиации составил от 30 до 45°. Трое пациентов были оперированы повторно (удлиняющая корпоропластика). Коническая головка отмечена в 36% наблюдений. Это считают не осложнением, а характерной особенностью оперативного лечения эписпадии и экстрофии мочевого пузыря. Все пациенты были удовлетворены эстетическими результатами лечения эписпадии и экстрофии мочевого пузыря.
Функциональный результат оценивали по сохранности эректильной и эякуляторной функции, качеству мочеиспускания, состоятельности континентного механизма. Отсутствие послеоперационной эректильной дисфункции при этом обширном и сложном оперативном лечении эписпадии и экстрофии мочевого пузыря можно объяснить особенностями сосудистой архитектоники аномального полового члена и оперативной техникой, состоящей в создании доступа к белочной оболочке на этапе корпоропластики в аваскулярной зоне. У 47,1% пациентов отмечена астеническая эякуляция, 20,6% указали на ретардированную эякуляцию.
Полноценное функционирование артифициального мышечного сфинктера отмечено у 80% больных. В 20% наблюдений отмечалось подтекание и частичное недержание мочи в ортостазе, что также было расценено как положительный результат (по сравнению с исходным тотальным недержанием мочи). Оперативное лечение эписпадии и экстрофии мочевого пузыря позволило пациентам отказаться от постоянного использования памперсов и перейти на эпизодическое (при физической активности) применение пенильного зажима.
Ишемия головки (20,5%) и некротические изменения кожи полового члена (11,8%) оказались самыми частыми специфическими осложнениями при вышеуказанном типе оперативного лечения эписпадии и экстрофии мочевого пузыря и закономерным следствием нарушения трофики тканей в результате многочисленных предшествующих операций и собственно реконструкции. Однако их не считают функционально значимыми, так как на фоне полноценной комплексной терапии во всех случаях удалось сохранить головку и кожу полового члена, не прибегая к дополнительным пластическим операциям.
Уретральные свищи (в качестве послеоперационного осложнения) были обнаружены у 6% больных. Этот показатель ниже, чем при других вариантах корпороуретропластик, но выше, чем при первично выполняемых операциях по поводу экстрофии и эписпадии в детском возрасте, что можно объяснить, как правило, увеличенным объемом повторного оперативного лечения эписпадии и экстрофии мочевого пузыря.
Социальная адаптация достигнута у всех больных. Все пациенты имели гетеросексуальную ориентацию. 88% больных после проведённого комплексного лечения эписпадии и экстрофии мочевого пузыря были способны к проведению коитуса, т.е. полностью сексуально адаптированы. Остальные пациенты использовали альтернативные способы сексуальных отношений. Постоянного сексуального партнёра имели 44% больных. Четверо из них создали семьи, у троих родились дети. Средний балл удовлетворённости жизнью составил 17±2,5(70,8% максимально достижимого балла).
Заключение
Полную одномоментную урогенитальную реконструкцию (операцию Ковалёва Королёвой) при экстрофии мочевого пузыря и тотальной эписпадии у взрослых пациентов считают патогенетически обоснованным методом. С точки зрения сохранности эректильной функции она безопасна и оправданна. Особенности вентрализации мочеиспускательного канала способствуют снижению частоты возникновения осложнений (например, свищей мочеиспускательного канала), чаще встречающихся при использовании других методов. Использование полной пенильной препаровки и нескольких типов лоскутов для органной реконструкции предоставляет возможность свободно ротировать удлинённые кавернозные тела вместе с головкой полового члена, укреплять шейку мочевого пузыря, удлинять уретру и осуществлять ее транспозицию, что позволяет создать новые синтопические соотношения, максимально приближенные к анатомической норме
Необходимо отметить, что при этом методе реконструкции не происходит нарушения гланулоапикальных взаимоотношений, что, безусловно способствует уменьшению числа осложнений, связанных с трофическими расстройствами головки. Одномоментное выполнение полной урогенитальной реконструкции позволяет максимально использовать пластический материал и обеспечивает удовлетворительный косметический и функциональный результат. Создание артифициального мышечного сфинктера посредством транспозиции лоскута прямой мышцы живота обосновано не только с функциональной (механизм континенции и улучшение локальной трофики), но и с косметической точки зрения. После проведённой одномоментной урогенитальной реконструкции у всех больных с эписпадией и экстрофией произошло значимое повышение уровня социальной и сексуальной адаптации, что нашло отражение в расширении диапазона социальных и половых контактов, а также в увеличении спектра коммуникаций. В основе этого лежит не только устранение первичного психотравмирующего фактора, но и повышение самооценки пациентов после удачно проведённой операции. У больных, перенёсших различное деривационное лечение эписпадии и экстрофии мочевого пузыря, восстановление мочеиспускательного канала в качестве эякуляторного канала с учётом сохранности либидо, эякуляции и оргазма считают важным и неотъемлемым этапом социальной реабилитации.
Социальная и сексуальная адаптация пациентов с экстрофией и тотальной эписпадией требует сочетанного применения методов пластической реконструктивной хирургии и психологической реабилитации. Использование психо- и фармакотерапии для достижения оптимального психоэмоционального фона позволяет быстрее достичь сексуальной и социальной адаптации этой категории больных.
[9], [10], [11], [12], [13], [14], [15], [16]
Источник
