Энтони атала мочевой пузырь

Доктор Энтони Атала отвечает на вопросы
Как начинались ваши работы по выращиванию органов из тканей?
Отрасль регенеративной медицины не нова, она зародилась еще в 30-е годы XX века. В течение этих лет исследователи выделили три основные проблемы. Первая: клетки человеческого тела вне самого тела растут по-другому, не так, как внутри тела. Вторая: для создания искусственных органов нужны особые биосовместимые материалы, которые приживаются в организме пациента, не вызывая отторжения, – что-то вроде хирургической нити для швов. И третья: нам нужно, чтобы имплантируемые органы и ткани интегрировались в систему человеческого тела кровеносными сосудами, так как ни один орган не работает без кровоснабжения.
Мы начали свои работы около 20 лет назад. Сначала мы научились качественно выращивать клетки вне тела пациента: если сначала мы вообще не умели выращивать клетки мочевого пузыря «в пробирке», то теперь специальные методы позволяют нам взять участок ткани площадью меньше половины почтовой марки и через 60 дней заполнить аналогичными клетками футбольное поле. Второй этап работы – подбор правильных факторов роста, обеспечивающих моделирование естественного роста. И теперь мы можем выращивать клетки самых разных типов вне человеческого организма. Для этого нужно извлечь кусочек ткани из организма, затем в соответствующих условиях размножить клетки и создать условия, в которых они сформируют полноценный орган, нарастая послойно, один слой за другим.
Первой нашей выращенной тканью была ткань хряща. Это плоская ткань – ее создали достаточно просто. Была хорошая поддержка нашей работы государством, регуляторными органами. После этого мы вырастили кожу – также плоскую ткань, состоящую из одного типа клеток. Эти медицинские технологии сейчас уже широко доступны на рынке медицинских услуг.
Нам также удалось вырастить сосуды – более сложные образования. Они отличаются тем, что являются уже трубчатыми органами и состоят из двух типов клеток: один из них находится внутри, выстилая внутреннюю поверхность сосуда, а другой снаружи – это мышечные клетки внешних стенок.
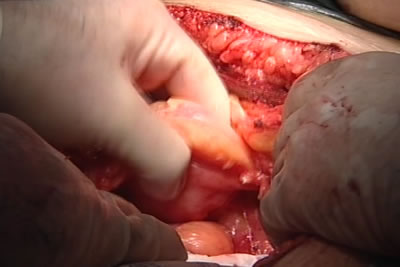
Третий тип органов – так называемые полые органы (например, мочевой пузырь и матка), они находятся в постоянном движении и состоят из более двух типов клеток. Эти органы сложнее реконструировать, так как они постоянно контактируют с мозгом и должны быть интегрированы в общую систему. Однако и в выращивании этих органов у нас большой прогресс. Мы берем фрагмент такой ткани у пациента, размножаем его вне организма, затем переносим на каркас из биосовместимого материала, чтобы вырастить полноценный орган, причем один тип клеток покрывает каркас, а другой находится внутри. Через 6-8 недель орган готов для пересадки, и мочевой пузырь мы пересаживаем так же успешно, как и хрящи, однако сама операция в этом случае гораздо сложнее. Работы по пересадке мочевого пузыря сейчас находятся в стадии клинических испытаний, всего в каждой из трех стадий по регуляторным правилам США приняли участие 10-20 человек.
Когда впервые был создан искусственный орган мочевой системы? Когда он был впервые пересажен человеку? И какова судьба этого пациента?
Биоинженерный мочевой пузырь впервые был имплантирован пациенту в 1999 году. Мы докладывали об отдаленных результатах у семи пациентов в 2006 году (в 2006 году в журнале “Ланцет” были опубликованы результаты испытания имплантатов мочевых пузырей на добровольцах). Обследование показало, что биоинженерные органы функционируют так же, как и органы, восстановленные с помощью кишечника, но без единого побочного эффекта. Эти пациенты чувствуют себя хорошо до сих пор.
Сколько времени занимает формирование мочевого пузыря?
На создание мочевого пузыря в лаборатории уходит около 6-7 недель. Этот период времени начинается небольшой биопсией c забором клеточного материала, продолжается выращиванием клеток и завершается имплантацией нового органа в тело пациента.
Вы с тех пор выполняли подобные операции? Можете ли Вы говорить о внедрении этого опыта в массовую практику?
После нашей пионерской работы мы лицензировали технологию для компании, которая продолжает проводить клинические испытания. Наша технология пока еще не прошла процедуру одобрения FDA (Управление по пищевым продуктам и лекарствам США), поэтому она недоступна для пациентов вне рамок клинических исследований.
А что дальше? Каковы стратегические цели выращивания органов?
Существует четвертый тип органов – это твердые органы, к ним относятся, например, сердце и почки. Они принципиально сложнее: на единицу объема они содержат в разы больше клеток, чем полые, трубчатые или плоские органы.
Пока нам удается выращивать их только на основе донорских органов, получаемых в результате смерти человека. Из такого органа мы сначала вымываем все клетки, оставляя лишь «скелет», то есть получаем орган, выглядящий как печень, имеющий форму печени, но печенью не являющийся. Затем на этот «скелет» мы наращиваем наши искусственно выращенные клетки.
Другая технология – 3D-печать твердых органов. В этом случае орган создается прибором, чем-то похожим на струйный принтер, только вместо чернил в него заправлены человеческие клетки разных типов, и процесс печати гораздо сложнее.
Мы изучаем несколько способов лечения почечной недостаточности – от использования 3D-печати для создания органа до инъекции стволовых клеток в орган. Основные проблемы с тканевой инженерией – это обеспечение адекватного снабжения клеток кислородом после имплантации.
Каковы основные приоритеты в развитии технологий, связанных с использованием стволовых клеток в урологии?
Стволовые клетки из мочевого пузыря (мышечные и эпителиальные) клинически используются для создания мочевого пузыря и уретры, которые имплантируются пациенту. Проекты, которые в настоящее время проходят предварительные клинические испытания, включают в себя использование мышечных клеток предшественников для лечения недержания мочи и клеток эректильной ткани для ее замещения. Кроме того, ученые из Института регенеративной медицины Wake Forest проводят клинические исследования по применению трансплантации стволовых клеток сперматогенного эпителия в качестве потенциального лечения мужского бесплодия.
Как вам удается избежать реакции отторжения трансплантата?
У нас есть порядка 20 типов биоматериалов, из которых мы комбинируем матрицу, подложку будущего органа, предварительно изучив ткани пациента. Нужно очень хорошо знать биологию клетки, чтобы культивировать точно такую же ткань.
Думаете ли вы в будущем производить искусственные органы в масштабном количестве?
Нехватка органов для пересадки пациентам, ожидающим ее, наводит на такие мысли. Для этого мы и придумали технологию печатания органа на принтере, чтобы автоматизировать процесс. Он в точности воспроизводит структуру органа, ускоряя процесс.
Какова успешность при пересадке органов, напечатанных на принтере?
Мы 12 лет адаптируем принтер к нашим потребностям. Ведь 100 % успех – это не только точно воспроизведенный орган, но и различные системы поддержки его жизнеспособности и жизнедеятельности. Здесь и вопросы неконтагиозности и безопасности для пациента. Здесь и прохождение административных и контрольных согласований с Управлением по контролю за пищевыми продуктами и лекарственными средствами США (FDA).
Можете назвать в процентном отношении частоту случаев, когда вы используете только биоматериал, а когда клетки пациента или стволовые клетки?
В первую очередь всегда стараемся использовать подложку плюс клетки пациента. Если нет такой возможности, тогда уже берем подложку и донорские стволовые клетки. Матрицу отдельно практически не используем, так как очень маленькая зона покрытия. Комбинацию подбираем очень индивидуально. Например, если нужна поджелудочная железа, то это всегда будут стволовые клетки; если уретра, мочевой пузырь – то, как правило, клетки пациента.
Как Вы относитесь к инъекциям стволовых клеток при эректильной дисфункции?
При эректильной дисфункции используют амниотические клетки или клетки красного костного мозга. Эффективность этого метода доказана у 30 % пациентов, т.е. примерно так же часто, как в группе плацебо. Нужны дополнительные исследования, чтобы можно было рекомендовать этот метод лечения всем пациентам с данным диагнозом.
Был ли у вас опыт создания сфинктера?
Сейчас ведется очень интересное клиническое исследование под контролем FDA по воссозданию сфинктера прямой кишки. В Австрии работают с мышечными клетками, ведутся работы в США и Канаде. Нужна функция мышечных волокон, объем создать легче, нужны васкуляризация и иннервация.
Как вы восстанавливаете эндотелий при пересадке сосудов?
Стараемся брать эндотелиальные клетки у самого пациента и их размножать. Когда это невозможно (если есть генетический дефект, например при мышечной дистрофии), подключаем генную инженерию, комбинируем клеточную и генную терапию.
Как Вы относитесь к технологии переноса ядерного материала в стволовые клетки?
Да, существует такой метод, еще со времен овечки Долли. Но чтобы пройти весь путь от переноса ядерного материала в первую клетку, потребуется не менее 100 яйцеклеток. Иначе говоря, это очень дорогая технология. И она уже не используется в регенеративной медицине, так как появились более эффективные способы.
Пробовали ли вы воссоздать роговицу и сетчатку глаза?
Мы работаем с тканями глаза на инженерном уровне. В нашем институте создано уже 30 тканей и органов человека. 50 % из них – это лабораторный уровень, около 25 % пересажено пациентам. Мы не торопим процессы, важно предусмотреть возможные осложнения при пересадке, обезопасить пациента. Если в новом органе стволовых клеток будет более 50 %, это вызовет резкий рост злокачественной опухоли.
На Ваш взгляд, через сколько лет такие технологии станут общедоступными?
Основное преимущество в репродукции органов и тканей, которое мы имеем на сегодня, – возможность использовать клетки пациента. Когда речь заходит о донорских стволовых клетках, подключаются иммуномодуляторы и другие сильнодействующие препараты. Много рисков для пациента. Поэтому нужно время, нужны исследования, решение FDA в конце концов. Даже путь обычной фармацевтической таблетки, к примеру таблетки от гипертонии, занимает не менее 15 лет – это от лаборатории до пациента. Плюс адаптация технологии для массового потребления – еще в среднем 14 лет. В нашем же случае все намного сложнее.
Нобелевская премия по медицине в 2012 году была вручена Шинье Яманака, который получал стволовые клетки из обычных соматических. У Вас нет планов повторить Ваш опыт с мочевым пузырем, но применения соматических клеток в качестве первичного материала?
С нашей технологией тканевой инженерии идеальным будет использование собственных стволовых клеток пациента, так как не будет проблем с отторжением. Когда это невозможно, выходом является использование стволовых клеток из другого источника.
Какие глобальные достижения в этой области за последние 5 лет Вы находите наиболее важными?
Очень важными является развитие биопечати, а также, конечно, работы доктора Яманака и других ученых в области индуцированных плюрипотентных стволовых клеток.
В вашем институте есть русские аспиранты или постдоки?
Конкретно сейчас нет, но раньше у меня работали несколько русских ребят. Сейчас они, правда, продолжают работать в США, в Россию они не вернулись. Это очень сильные ребята, с очень высоким уровнем образования, активные исследователи – было приятно с ними работать.
Как вы считаете, русские исследователи в России могли бы вести работы на таком же высоком уровне, как вы в США?
Конечно могли бы. Но в России им очень не хватает материальных ресурсов, финансирования, поддержки государства. Наш центр получает гигантскую поддержку: только пятилетний контракт с Пентагоном принес в институт $85 млн. Если бы ученые в России имели необходимые ресурсы, наука двигалась бы на совершенно другом уровне.
Сейчас в России набирают популярность банки стволовых клеток пуповинной крови. На ваш взгляд, есть ли смысл хранить кровь ребенка, поможет ли она ему в будущем?
Все зависит от того, что именно вам нужно. Сейчас существуют технологии лечения рака крови с помощью стволовых клеток пуповинной крови. Соответственно, если в вашей семье есть наследственная вероятность рака крови, то хранить стволовые клетки детей имеет смысл. Если нет – польза на сегодня не очевидна.
Источник

Ученым удалось вырастить искусственный мочевой пузырь из образцов тканей больных.
Американские ученые заявили об успешных испытаниях новой технологии, позволяющей в лабораторных условиях выращивать внутренние органы из небольших фрагментов собственных тканей больного. Отчет о семи удачных операциях по пересадке искусственно выращенного мочевого пузыря опубликован в понедельник в журнале The Lancet.
Искусственно созданные органы успешно функционировали на протяжении длительного времени: с момента первых операций, проведенных по новой технологии, прошло уже несколько лет.
По мнению координатора исследовательского проекта доктора Энтони Аталы (Anthony Atala ), новая техника поможет врачам решить проблему дефицита донорских органов. Кроме того, при пересадке органов, созданных из собственных клеток, отсутствует риск отторжения и больным нет необходимости принимать иммунодепрессанты, что избавляет их от большого числа тяжелых побочных эффектов.
Для создания искусственного мочевого пузыря группа доктора Аталы использовала клетки-предшественники, при дифференциации которых образуются мышечные клетки наружной оболочки этого органа и клетки эпителия, выстилающие его внутреннюю поверхность.
Ученым удалось разработать методику выделения клеток-предшественников и последующего выращивания из них отдельных слоев, в которых преобладали либо мышечные, либо эпителиальные клетки. Затем отдельные слои совмещались. По словам Энтони Аталы, это было похоже приготовление слоеного пирога.
Изготовленные таким образом искусственные органы были предназначены для нескольких больных в возрасте от 4 до 19 лет, страдавших дисфункцией мочевого пузыря, вызванной наследственным заболеванием. Нарушение мочеиспускания у этих больных могло привести к тяжелому поражению других внутренних органов, и прежде всего почек.
Искусственно выращенный имплантат прикреплялся к мочевому пузырю пациентов. В течение нескольких лет, прошедших после операций, медики наблюдали постепенное улучшение состояния больных.
В настоящее время группа Энтони Атвлы работает над созданием in vitro других сложных органов: сосудов, нервов, почек, печени, сердца и поджелудочной железы.
MedPortal
Код вставки на сайт
Ученым удалось вырастить искусственный мочевой пузырь из образцов тканей больных.
Американские ученые заявили об успешных испытаниях новой технологии, позволяющей в лабораторных условиях выращивать внутренние органы из небольших фрагментов собственных тканей больного. Отчет о семи удачных операциях по пересадке искусственно выращенного мочевого пузыря опубликован в понедельник в журнале The Lancet.
Искусственно созданные органы успешно функционировали на протяжении длительного времени: с момента первых операций, проведенных по новой технологии, прошло уже несколько лет.
По мнению координатора исследовательского проекта доктора Энтони Аталы (Anthony Atala ), новая техника поможет врачам решить проблему дефицита донорских органов. Кроме того, при пересадке органов, созданных из собственных клеток, отсутствует риск отторжения и больным нет необходимости принимать иммунодепрессанты, что избавляет их от большого числа тяжелых побочных эффектов.
Для создания искусственного мочевого пузыря группа доктора Аталы использовала клетки-предшественники, при дифференциации которых образуются мышечные клетки наружной оболочки этого органа и клетки эпителия, выстилающие его внутреннюю поверхность.
Ученым удалось разработать методику выделения клеток-предшественников и последующего выращивания из них отдельных слоев, в которых преобладали либо мышечные, либо эпителиальные клетки. Затем отдельные слои совмещались. По словам Энтони Аталы, это было похоже приготовление слоеного пирога.
Изготовленные таким образом искусственные органы были предназначены для нескольких больных в возрасте от 4 до 19 лет, страдавших дисфункцией мочевого пузыря, вызванной наследственным заболеванием. Нарушение мочеиспускания у этих больных могло привести к тяжелому поражению других внутренних органов, и прежде всего почек.
Искусственно выращенный имплантат прикреплялся к мочевому пузырю пациентов. В течение нескольких лет, прошедших после операций, медики наблюдали постепенное улучшение состояния больных.
В настоящее время группа Энтони Атвлы работает над созданием in vitro других сложных органов: сосудов, нервов, почек, печени, сердца и поджелудочной железы.
MedPortal
Источник
Запустить регенерацию
Первая в мире успешная трансплантация органа произошла в 1954 году – хирург Джо Маррей имплантировал почку пациенту. Благодаря этому впоследствии было спасено много людей. Но по-прежнему этих органов не хватает, и, кроме того, происходит реакция отторжения трансплантата. Поэтому мы наблюдаем огромный дефицит органов: за последние 10 лет удвоилось количество пациентов, которым нужна трансплантация, при этом само количество процедур повысилось менее чем на 1%.
Ежегодно в мире делают в среднем 100 800 пересадок органов. Чаще всего пересаживают почки (69 400 операций), печень (20 200), сердце (5 400), легкие (2 400) и поджелудочную железу (2 400). Донорство может быть родственным и посмертным, когда нужный орган берут у трупа. При этом в России, например, средний срок ожидания донорской почки – 1,5-2 года. В НИИ имени Склифосовского ежегодно выполняется около 200 операций, в то время как в листе ожидания стоит примерно 500 человек.
Природа так создала клетки, что они всегда знают, что им делать. У них есть способность регенерировать, каждая клетка имеет такой потенциал. Клетки кожи обновляются каждые две недели, клетки кишечника – в течение двух недель, а клетки мозга – каждые десять лет. Проблема заключается в том, что мы не регенерируем ткани, когда происходит болезнь, шрам или повреждение. В этот момент регенерация останавливается, и здесь может помочь регенеративная медицина. Мы берем у пациента очень маленькие мышечные ткани, затем обрабатываем эти клетки и помещаем их в зону, где находится поврежденная мышца. Это также можно применять для пациентов с ожогами: в этом случае мы берем маленький образец кожи пациента, затем обрабатываем клетки и просто с помощью спрея наносим их на поврежденные области. При этом если пациент с травмой, необходимо сначала его подлечить, избавиться от инфекции и выждать время, чтобы сам он был готов к лечению.
Вырастить новый орган
Вместо клеток можно использовать так называемую подложку – своего рода каркас здания. Ее материалы очень похожи на материалы швов. Они растворяются за несколько месяцев, безопасны для человека и клеток. Мы берем маленький образец ткани у пациента, затем обрабатываем эти клетки за пределами тела, культивируем их, используем подложку для того, чтобы они приобрели трубчатую форму, и имплантируем это пациенту. На весь процесс нужно примерно 30 дней. То же самое касается и кровяных сосудов. Мы кладем эти клетки на материал, потом тренируем этот орган. Когда сжатия станут такими, какие нам необходимы, сосуды имплантируют людям. Самый сложный орган – это цельный орган с кровообращением, как сердце, почка и печень, потому что здесь различные типы тканей, а также все они имеют очень много сосудов.

«Здоровая Москва»
Легче всего выращивать простые ткани. В клинической практике уже используется метод регенерации кожи с помощью специальных гидрогелей или клеток самого пациента.
Гордана Вуньяк-Новакович в Колумбийском университете вырастила фрагмент кости черепа, засеяв каркас стволовыми клетками.
В Университете Джона Хопкинса врачи удалили у пациентки ухо и часть черепа, пораженные опухолью. Взяв хрящевую ткань из грудной клетки, сосуды и кожу, они вырастили ей на руке новое ухо, а затем пересадили искусственный орган на место.
Успешные опыты по выращиванию и трансплантации кровеносных сосудов прошли в университетах Готенбурга (Швеция) и Райса (США). Также есть примеры выращивания мышц, клеток крови, костного мозга и зубов.
Что касается выращивания сложных органов, эксперименты пока ведутся в основном на животных. Однако есть и примеры успешных пересадок искусственно выращенных органов людям. Энтони Атала уже несколько лет проводит операции по имплантации мочевого пузыря, выращенного из клеток пациента. В 2008 году итальянский хирург Паоло Маккиарини провел трансплантацию трахеи, выращенной на основе донорского каркаса. Правда, спустя несколько лет Маккиарини оказался в центре скандала – шестеро из его пациентов умерли, а свои достижения, согласно научным отчетам, он приукрасил. Опубликованные в мае 2015 года результаты независимой экспертизы, которую провёл главный хирург Уппсальского университета Бенгт Гердин, подтвердили, что Маккиарини сфальсифицировал результаты своих исследований и совершил научное мошенничество.
Компания Advanced Cell Technology в 2002 году вырастила миниатюрную почку коровы длиной 5 см с помощью технологий клонирования, взяв клетки из уха животного. Почку имплантировали рядом с основными органами, и она начала успешно вырабатывать мочу.
Также есть положительный опыт выращивания и трансплантации печени лабораторным крысам (Массачусетский университет) и легких свиньям (Университет Техаса).
Сосуды пересаженных органов очень маленькие. Мы 30 лет назад уже начали эту работу, но у нас не было технологии. Стали думать о том, чтобы взять органы людей, которые умерли, и использовать их еще раз. Изъяли из умершего пациента печень и как бы отмыли изнутри. Через две недели печень по-прежнему выглядела как печень, но там не было внутри клеток. Однако мы смогли сохранить сосудистое дерево, такой скелет печени. Затем взяли клетки пациента, вырастили их и поместили на этот скелет. Мы создаем ткань из тела пациента и таким образом лечим его. Поэтому нет иммунного ответа вообще. Это очень большой плюс регенеративной медицины.

«Здоровая Москва»
Даже из очень плохого органа мы с помощью биопсии можем достать хорошие клетки. Но не можем делать этого при генетических заболеваниях, потому что дефект будет во всей ткани. Здесь другие технологии – мы берем клетки из этого пациента, дефекты исправляем, как бы оздоравливаем эти клетки, а затем работаем по той же стратегии. Пока, к сожалению, это экспериментально, но все равно есть надежда, что и генетические заболевания можно будет лечить.
Мы обязательно прослеживаем жизнь наших пациентов хотя бы в течение 5-8 лет после пересадки. Мы должны удостовериться, что все будет нормально, только потом можно будет говорить, что эта технология сработала и пересаженные органы нормально функционируют.
Печать органов и тестирование лекарств
Можно напечатать миниатюрное сердце, и через два часа оно уже будет сокращаться. Шесть лет назад мы начали использовать 3D-печать, потому что было необходимо масштабировать эти технологии – до этого мы все делали вручную. Но полученные с помощью печати органы не имели такую целостность, чтобы их имплантировать в тело. Тогда мы стали разрабатывать более специфичные принтеры, которые могли бы создавать ткань человека. И работали над этим 14 лет.
Первые эксперименты по биопечати проводились на обычных бытовых 3D-принтерах, которые модернизировали в рабочих условиях. В 2000 году Томас Боланд настроил аппараты Lexmark и HP так, чтобы на них можно было печатать фрагменты ДНК, а в 2003 году запатентовал технологию.
Сейчас печатью органов занимается несколько компаний. Биоинженеры компании Organovo разработали технологию, позволяющую печатать печеночную ткань. Также они напечатали почки, сохраняющие работоспособность в течение двух недель. Пока такие органы используются только для тестирования медицинских препаратов, но создатели не исключают, что скоро приступят к разработке оборудования для печати донорских органов.
Российские биоинженеры из 3D Bioprinting Solutions разработали 3D-принтер FABION и провели успешный эксперимент по печати щитовидной железы и пересадке ее подопытной мыши.
Принтеры Fripp Des, разработанные в Шеффилдском университете, печатают глазные протезы. Эта же команда разрабатывает технологии 3D-печати носов, ушей и подбородков.
Часть оборудования выпускается для собственных нужд заказчиков и не предназначена для продажи (FABION, Organovo’s NovoGen MMX). Цены на коммерческие биопринтеры начинаются от $10 тыс. (BioBots) и €5 тыс. (CEL Inkredible) до $200 тыс. и выше (EnvisionTEC’s 3D Bioplotter, RegenHU’s 3DDiscovery).
Есть пять интересных критериев 3D-принтера для печати органов. Во-первых, у них очень маленькие насадки, они могут доходить до 2 мк – это 2% от диаметра волоса человека. Второе – этот принтер дает нам точность, мы можем выкладывать клетки там, где они на самом деле нужны. Третье – это биочернила, такая жидкость, которая проходит через насадку. А потом, когда это становится желатином, уже функционирует как нормальная ткань. Следующий критерий – это микроканалы, они дают питание центральной части клеток. По сути, это заместители крови. И, наконец, программное обеспечение, позволяющее иметь трехмерное изображение. Таким образом, мы понимаем, что происходит в теле, и создаем структуру, необходимую для заданного органа. Для этого берем цифровые данные от рентгена и используем их так, чтобы создавать структуру именно для этого дефекта у конкретного пациента.

«Здоровая Москва»
У нас есть две сертифицированные системы для печати человеческих органов. Они одобрены FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов в США – «Хайтек»). За последние шесть лет мы использовали принтер, чтобы создать так называемую программу тела на чипе. Сейчас это находится на этапе разработки, потому что необходимо обеспечить жизнестойкость этих органов, но в целом мы можем сделать миниатюрные легкие, сердце, сосуды и соединить всю эту систему на чипах. Мы также можем создать миниатюрные органы размером с булавочную головку и посмотреть, как эти органы будут реагировать на лекарства. Например, если лекарство ускоряет частоту сердечных сокращений, оно ускорит ЧСС в нашем миниатюрном сердце. Таким образом можно выявить побочные эффекты лекарств, которые другими тестами не выявляются.
Избежать побочных эффектов
С помощью напечатанных миниатюрных органов можно тестировать лекарства. Например, препарат «Гисманал» (Hismanal), 11 лет находившийся на рынке по всему миру. Это антипсихотическое средство также использовалось как антигистаминное. Спустя некоторое время его применения стало понятно, что у многих пациентов возникают побочные эффекты, связанные с нарушением работы сердца. Когда лекарство тестировалось на клетке, никаких проблем не было, когда оно тестировалось на животных, никаких проблем не было. Когда проводились клинические исследования первого, второго и третьего этапа, ничего не происходило. Мы взяли это лекарство, использовали его в отношении наших органов на чипах и уже через неделю стало понятно, что это лекарство токсично для сердца.
Это связано с тем, что все по-разному реагируют на лекарства, все генетически отличаются, одно и тоже лекарство будут по-разному перерабатывать. У всех разный режим питания, разные условия жизни, разные трудности со здоровьем. Это действует как помеха для понимания того, что на самом деле лекарство делает с органами. А если мы уберем все эти помехи и посмотрим непосредственно, как лекарство действует на органы, сразу сможем выявить токсичность.
Сегодня мы разрабатываем систему, которую называем «тело на чипе». Она в частности поможет сократить токсичность лекарств – например, чтобы работать с онкопациентами. Можем взять небольшую клетку рака и вырастить его, а затем тестировать химиотерапию на чипе, перед тем как давать эту терапию пациенту. У нас был пациент с меланомой, он шесть месяцев был на химиотерапии, было потрачено много денег, а опухоль лишь выросла. Мы протестировали лекарство, которое не рассматривалось, и пациент стал его получать. Через две недели пациент впервые сказал, что его состояние улучшается, а доктор отметил, что уменьшается опухоль. Таким образом, очень полезно тестировать лекарство прежде, чем давать его пациенту.
Стволовые клетки: создать то, чего нет
Когда нужно вырастить орган, которого у пациента никогда не было или он утрачен, можно использовать стволовые клетки. Обычно мы для того, чтобы вырастить почку, берем почечную клетку, чтобы вырастить уретру, мы берем клетки уретры. Но в случае со стволовыми клетками можем взять ту, которая может стать клеткой легкого, почки или кровеносного сосуда. Есть два основных типа стволовых клеток. Один из них – человеческие эмбриональные. Они очень мощные, растут и могут превращаться во что угодно, но также могут формировать опухоли, поэтому очень трудно использовать их. С другой стороны, если говорить об этих клетках у взрослого человека, это могут быть клетки жира или костного мозга, они не будут формировать опухоли, но не так хорошо растут.
Впервые термин «стволовая клетка» использовал немецкий ученый Валентин Хаакер в конце XIX века. В 1909 году российский ученый Александр Максимов предположил, что в организме существуют клетки, остающиеся неизменными, но в нужный момент могут изменить программу и превратиться в клетки другого типа.
Эта теория получила подтверждение в 60-х годах прошлого века. Американцы Джеймс Тилл и Эрнест Маккалох облучали мышей смертельной дозой радиации, а затем пересаживали им стволовую клетку крови здоровой особи. Оказалось, что таким образом можно восстановить кровь и спасти мышей от смерти. С 1964 года этот способ стали использовать при лечении рака крови: у пациентов сначала уничтожают собственные кровяные клетки, а затем трансплантируют здоровые стволовые клетки от донора. Эффективность такого метода достигает 70-80%.
В 1981 году Мартин Эванс и Мэттью Кауфман параллельно с Гейлом Мартином выделили эмбриональные стволовые клетки из мышиных зародышей. Эти клетки могли неограниченно долго существовать вне организма без изменения свойств, а при попадании в определенные условия, например, обратно в организм, превратиться в ткани.
В 1999 году журнал Science причислил открытие стволовых клеток к трем величайшим открытиям в области биологии, после расшифровки ДНК и программы «Геном человека».
Долгое время считалось, что если стволовая клетка превратилась в клетку ткани, сделать ее снова стволовой невозможно. Однако в 2006 году японец Синъя Яманака открыл способ превращать соматические клетки обратно в стволовые. За это в 2012 году он получил Нобелевскую премию.

«Здоровая Москва»
Примерно 17 лет назад мы начали искать альтернативный источник стволовых клеток. Предположили, что есть еще один тип стволовых клеток, присутствующий в амниотической жидкости и в плаценте, которыми ребенок окружен в матке. И мы нашли эти очень мощные стволовые клетки. Они не будут формировать опухоли и могут превращаться в три основные категории ткани, которые формируют наш организм. Эти клетки можно быстро выращивать до достаточных количеств. Таким образом мы избегаем всех ограничений клеток костного мозга и других типов клеток. Сейчас они являются объектом ряда клинических исследований и пока что не используются очень широко.
Я не хочу, чтобы вы подумали, будто все проблемы уже разрешены, и можно просто взять и напечатать на принтере органы. Потребуются десятилетия для того, чтобы эти технологии могли развиваться. Это очень сложно, и нужно много времени, чтобы мы смогли разработать тот самый рецепт, который позволит технологиям работать оптимально. Кроме того, это дорогостоящие технологии, их будет трудно реплицировать, но точно можно сказать, что в них есть потенциал. И для нас в этом обещание регенеративной медицины – делать жизнь пациентов лучше.
Источник
