Экзофиты в мочевом пузыре
 Мочевой пузырь выполняет важную функцию – выводит мочу из организма. Опухолью называется образование в стенке мочевого пузыря, растущее во внутреннюю его полость. Патология становится последствием перерождения здоровых тканей в онкологические. При онкологическом процессе в слизистой или стенках органа диагностируется рак мочевого пузыря (РМП). Заболевание встречается в 2-5% случаев, чаще у мужчин возрастом старше 65 лет.
Мочевой пузырь выполняет важную функцию – выводит мочу из организма. Опухолью называется образование в стенке мочевого пузыря, растущее во внутреннюю его полость. Патология становится последствием перерождения здоровых тканей в онкологические. При онкологическом процессе в слизистой или стенках органа диагностируется рак мочевого пузыря (РМП). Заболевание встречается в 2-5% случаев, чаще у мужчин возрастом старше 65 лет.
Характер новообразования
Опухоль может иметь доброкачественный и злокачественный характер:
- Доброкачественная опухоль мочевого пузыря формируется из клеток, которые не способны разрастаться в соседние. Новообразование не предоставляет опасности для пациента, после операции нет риска повторного развития онкологии.
- Злокачественная неоплазия формируется из раковых клеток, которые могут проникать в лимфатические протоки и кровеносные сосуды. Биологические жидкости могут переносить их по всему организму и провоцировать развитие метастазов.
Формы рака мочевого пузыря
Патология, в зависимости от гистологического строения тканей новообразования, может иметь одну из форм рака:
- Переходно-клеточный рак. Диагностируется в большей части случаев. Неоплазия находится на оболочке мочевого пузыря, ограничивается эпителиальными клетками. Лечится легко и не переходит за пределы пораженного органа.
- Плоскоклеточный рак. Формируется из железистого слоя. Диагностируется в 2-3% случаев. Может возникать по причине продолжительного воспалительного процесса в мочевом пузыре.
- Аденокарцинома. Формируется из железистых тканевых соединений. Встречается реже всего. Чаще проявляется в виде папиллярных разрастаний, легко распространяется на кости, печень, легкие.
 Причины развития заболевания
Причины развития заболевания
Опухоль мочевого пузыря не имеет триггерных причин. Патология возникает вследствие разных вредных факторов, которые нарушают работу мочевыделительной системы или мочевого пузыря.
К факторам риска, которые могут стать причиной развития рака органа относят:
- Вирус папилломы человека.
- Мочеполовой шистосомоз.
- Питье хлорированной воды.
- Воспаление органа при цистите.
- Продолжительный контакт с канцерогенами.
- Курение, стресс и другие факторы, которые приводят к онкологии.
 Симптомы рака мочевого пузыря
Симптомы рака мочевого пузыря
На первоначальных этапах развития заболевание протекает без проявления характерных симптомов. Одним из самых главных признаков при первой стадии РМП является примесь крови в моче. Есть две формы патологии:
- Микрогематурия: определяется при микроскопии. Не видима глазом, обнаруживается случайно при сдаче общего анализа мочи.
- Макрогематурия: проявляется в виде кровяных капель в моче, иногда в форме сгустков.
При наличии ракового процесса в мочевом пузыре, появляется расстройство акта мочеиспускания. По частоте это второй признак патологии. Пациенты отмечают учащенные позывы к мочеиспусканию (от 10-ти раз в сутки и более), болезненность при опорожнении мочевого пузыря. Подобные симптомы характерны в большей степени для аденомы простаты, поэтому пациенты чаще всего обращаются на консультацию с подозрением на данную патологию.
При распространении онкологии на шейку мочевого пузыря и на область устьев мочеточника, появляются признаки задержки мочи, почечные колики. Увеличение опухоли приводит к появлению боли над лобком. При возникновении подобных симптомов, у пациента так же отмечаются проявления, описанные выше.
 Стадии заболевания
Стадии заболевания
Рак мочевого пузыря имеет несколько стадий развития, учитывая степень поражения:
- Стадия 1. Онкологические клетки находятся в эпителиальном слое. Метастазирование отсутствует.
- Стадия 2. Опухоль распространяется в мышечный слой органа. Своевременное лечение снижает риск появления рецидива.
- Стадия 3. Злокачественная неоплазия затрагивает другие органы организма, поражает жировую ткань и клетчатку, лимфатические узлы.
- Стадия 4. Новообразование широко распространяются за пределы мочевого пузыря, поражает здоровые тазовые кости, брюшную полость.
Методы диагностики
Важным фактором успешного лечения опухоли мочевого пузыря – своевременное выявление болезни. Диагноз устанавливается на основе анамнеза пациента, осмотра, лабораторной и инструментальной диагностики.
Больной обязательно сдает анализ мочи и крови специфичным методом, при котором определяется концентрация белка UBS (антиген РМК). Результат, при котором уровень белка составляет в 15 раз больше от нормы свидетельствует о положительном результате. Однако стоит учитывать, что при воспалительных процессах в мочевыводящей системе может возникнуть ложноположительный результат.
Пациенту также необходимо сдать мочу для цитологического исследования на атипические клетки. Анализ позволяет оценить морфологическую структуру отдельных клеток, выявить опухолевые поражения мочевого пузыря. Цитологическое исследование является дополнительным способом диагностики высокой степени злокачественности новообразования.
УЗИ органов малого таза помогает определить характер неоплазии, параметры, очаг заболевания. Ультразвуковое исследование является информативным, если размер опухоли превышает 5 мм.
При раке мочевого пузыря проводят МРТ органов малого таза с контрастированием для определения распространения процесса в стенку органа, а также наличия лимфаденопатии. При обнаружении опухоли в области устья мочеточников выполняется МСКТ органов брюшной полости с контрастированием для исключения распространения процесса на верхние мочевые пути (мочеточник и почки).
К инструментальным методам исследования относят цистоскопию. Она позволяет определить месторасположение, параметры, характер и форму новообразования. При цистоскопии появляется возможность взять биопсию для дальнейшей гистологической экспертизы.
Лечение заболевания
Современные методики лечения рака мочевого пузыря позволяют избавить пациента от патологии даже на 3-4 стадиях ее развития. При первоначальной степени заболевания, когда раковые клетки формируются в эпителиальном слое, назначается ТУР (трансуретральная резекция) или лазерная En-block резекция стенки мочевого пузыря с опухолью. Операция позволяет безопасно удалить новообразование, помогает пациентам вернуться к привычному образу жизни.
При более опасных стадиях заболевания может проводиться операция – цистэктомия, когда врач методом лапароскопии или с помощью робота да Винчи, удаляет мочевой пузырь и тазовые лимфоузлы. У мужчин также удаляется предстательная железа и семенные пузырьки, у женщин – матка и маточные трубы, яичники.
При удалении опухоли на 1-й стадии развития количество выздоровевших – более 50%. При раке мочевого пузыря 3-й степени прогноз составляет 30%. Пациентам важно регулярно проходить обследование, чтобы своевременно определить наличие опасной патологии.
Источник
Опухолью мочевого пузыря называют доброкачественное новообразование, возникающее на его стенках. Наиболее часто патологические процессы происходят на задней и боковых стенках пузыря, шейке, в мочепузырном треугольнике (треугольник Льето), изменяя количественный и качественный состав клеток эпителия слизистых оболочек.
Доброкачественная опухоль мочевого пузыря, как правило, локализуясь на определённом участке поверхностей, изменяет его клетки, в результате чего образуются полипы, аденомы, эндометриоз, феохромоцитомы (фиброепителиомы), лейомиомы, рабдомиомы, невриномы и папилломы в мочевом пузыре, где преимущественно располагаются все опухоли мочевыделительной системы. Мужское население от 50 до 70 лет заболевает опухолевыми болезнями мочевого пузыря в 4 раза чаще, чем женское.
Эпителиального происхождения доброкачественные опухоли встречаются у 95-98% больных в виде папиллом и полипов, которые при озлокачествлениипроцесса могут перейти в разные виды рака мочевого пузыря и аденокарциному (90-96% от всех опухолей мочевого пузыря). Папиллома мочевого пузыря, невзирая на её морфологически доброкачественнуюструктуру, определяется как предраковая опухоль, потому как имеет склонность к частым рецидивами перерождению в злокачественную.
Доброкачественные опухоли мочевого пузыря отличаются отсутствием метастазирования, поражения здоровых тканей вокруг и продолжением роста после оперативного удаления. Самую большую распространенность среди мужчин после 45 лет получила аденома, хотя за последние десятки лет она значительно «помолодела».
Неэпителиального происхождения (из соединительной ткани) опухоли мочевого пузыря в виде фибром, миом, гемангиом, фибросарком – очень редко встречающиеся новообразования, хотя саркомы, дающие лимфогенные и гематогенные метастазы на ранних стадиях, определяются гораздо чаще.

Классификация опухолей мочевого пузыря
Доброкачественныеопухоли делятся на группы эпителиальногои неэпителиальногопроисхождения. К эпителиальным условно доброкачественным опухолям относятся:
- Папилломы, представляющие собой многочисленные длинные разветвленные ворсинки со множеством кровеносных сосудов, которые определяются как потенциально злокачественные, т.к. склонны к малигнизированию.
- Аденома (гиперплазия) предстательной железы, образующаяся из клеток слизистой мочевого пузыря или стромальной составляющей предстательной железы. Она имеет узелки, которые при увеличении размеров сдавливают мочевыводящий канал, мешая процессу мочеотделения.
- Эндометриозмочевого пузыря – это опухоль, являющаяся итогом гормональных нарушений, когда имеется избыток эстрогенов и дефицит прогестерона, с губчатой структурой из разнокалиберных кист на стенке, выпирающих в пузырь, на фоне повышенной отечности и гиперемии околослизистого пространства. Эндометриоз зависим от менструального цикла, имеет склонность к озлокачествлению клеток.
- Полипы – это выступающие над слизистым слоем мочевого пузыря патологические разрастания тканей.
- Феохромоцитома – нейроэндокринная опухоль в мышечном слое шейки, образовавшаяся из клеток хромаффинной ткани, выделяющей переизбыток катехоламинов.
- Типичная фиброэпителиома – нежное ворсистое новообразование на ножке, которое может размножиться.
- Атипичная фиброэпителиома – ворсинчатое образование с более грубыми ворсинками на более толстой ножке, с умеренно отечной и гиперемированной слизистой оболочкой вокруг. При объединении с папилломатозом она опасна перерождением в злокачественную опухоль.
К неэпителиальным доброкачественным опухолям мочевого пузыря относятся фибромы, миомы, фибромиксомы, гемангиомы, липомы, лимфангиомы, опухоль Абрикосова (зернистоклеточная опухоль), невриномы, встречающиеся в урологической практике относительно нечасто.
Прогноз и профилактика доброкачественных опухолей мочевого пузыря

В основной практике полипы и папилломы продолжительное время могут никак себя не проявлять, поэтому их обнаружение и лечение на запущенных стадиях озлокачествления редко даёт положительные результаты. Чтобы избежать усложнений заболевания, люди из группы риска должны периодически обследоваться, избавляться от провоцирующих опухолеобразование болезней, вести здоровый образ жизни и находиться под наблюдением врача. Послеоперационный период при неосложненных новообразованиях длится недолго, и возврат к нормальной полноценной жизни равен практически 100%.
Причины развития доброкачественных опухолей мочевого пузыря
Этиология развития опухолей мочевого пузыря окончательно не определена, однако, исходя из известных факторов, определяются следующие:
- анилиновые красители, особенно их производные – ароматические амины с их конечными метаболитами (бензидином, нафтиламином и др.), обладающие канцерогенным действием на работников лакокрасочных, бумажных, химических и резиновых производств;
- различные канцерогены окружающей среды, попадая в организм и выводясь с мочой, приобретают патологическое влияние на уротелий при застое мочи;
- курение и стаз мочи являются толчковым механизмом к образованию опухолей мочевого пузыря, когда ортоаминофенолы (продукты конечного обмена аминокислоты триптофана) вызывают разрастание клеток эпителия мочевыводящего тракта;
- возраст и пол больного, анатомические особенности строения мужской мочевыводящей системы, морфологические отличия слизистой пожилых людей, часто приводящие к застою мочи;
- наличие и частота воспалительных заболеваний уретры и мочевого пузыря, таких как шеечный цистит, простатит, мочекаменная болезнь, лейкоплакия, изъязвления мочевого пузыря;
- нарушения гормонального фона, снижение активности Т-системы иммунитета;
- паразитарные инвазии типа бильгарциоза, шистомоза и другие.
Кроме этого, существует обсуждаемая тема в мировой медицине о вирусном происхождении новообразований в мочевом пузыре.
Симптомы доброкачественных опухолей мочевого пузыря
Доброкачественная опухоль мочевого пузыря, симптомы которой обычно никак не проявляются, обнаруживается, как правило, случайно. Основные и наиболее выраженные симптомы доброкачественных опухолей:
- гематурия различных типов выраженности (микро-, макрогематурия, тотальная, терминальная): главный симптом при любой доброкачественной опухоли – это наличие крови и её сгустков в мочевой жидкости на различных этапах мочеиспускания у большинства пациентов, что отличает виды и стадии опухоли;
- дизурия – затрудненное мочеиспускание, наблюдаемое у трети пациентов с частотой, увеличивающейся в результате ухудшения состояния больного;
- вторичный цистит и восходящий пиелонефрит как результат распада новообразования;
- различной выраженности дискомфорт, жжение или болезненность при мочеиспускании;
- докучающие позывы к мочеиспусканию;
- недержание мочи у мужчин и женщин;
- ложные позывы к дефекации, боль, распространяющаяся в промежность, прямую кишку, крестец при опухоли шейки мочевого пузыря;
- нарушение опорожнения мочевого пузыря при сжимании устьев мочеточников опухолями приводит к проявлению признаков хронической почечной недостаточности, пиелонефроза и уретерогидронефроза;
- болевые ощущения, рези внизу живота, локализующиеся в лобковой, а затем и в паховой области.
Иногда, вследствие перекручивания полипа или папилломы пузыря, происходит острое нарушение кровообращения, ведущее к инфаркту новообразования, что сопровождается усилением гематурии. Доброкачественные опухоли мочевого пузыря являются катализаторами рецидивов воспалительных заболеваний мочевыводящих путей – циститов, восходящих уретеропиелонефритов.
Опасность перерождения доброкачественных тканей папиллом мочевого пузыря в злокачественные наиболее велика у заядлых курильщиков. Папилломы мочевого пузыря имеют склонность к повторному прорастанию с непредсказуемой периодикой, с каждым рецидивом становясь более злокачественными, чем прежде удаленные опухоли.
Обнаружили симптомы данного заболевания?
Звоните
Наши специалисты проконсультируют Вас!
Диагностика доброкачественных опухолей мочевого пузыря
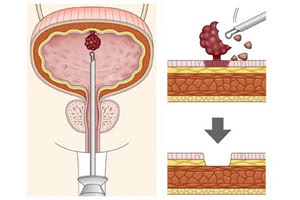
Чтобы выявить и достоверно определить наличие, тип и стадию опухоли мочевого пузыря, необходимо провести комплексную диагностику пациента всеми доступными в настоящее время методами. Особенно следует отметить следующие.
Бимануальная пальпация (ручное исследование) – обязательное исследование, однако маленькие опухоли, выросшие вовнутрь, как правило, не пальпируются, а новообразование, которое удалось пальпировать, указывает на распространившееся проникающее поражение мочевого пузыря.
Ряд клинических и биохимических анализов крови и мочи через определённые этапы времени, позволяющие провести точную оценку развития заболевания.
Рентгенологическое исследование пузыря с введением контрастного вещества (экскреторная урография) в полость пузыря для определения дефекта наполнения его мочевой жидкостью и определения состояния его слизистой оболочки. Иногда это исследование проводят в условиях двойного контрастирования, вводя кислород в мочевой пузырь и окружающую его клетчатку, чтобы уточнить степень инфильтрации стенки пузыря и распространения её на окружающие участки.
Эндоскопическое исследование полости пузыря (цистоскопия) предоставляет его внутреннюю картину, помогает с достаточной точностью определить вид опухоли, её характеристики и площадь поражения с обязательным получением тканей и мочи для бактериологического анализа.
Цитологический анализ мочевой жидкости с целью выявления атипичных клеток проводится в случаях, когда нет возможности произвести биопсию на гистологию.
Трансуретральная пункционная биопсия тканей опухоли для определения их гистологии выполняется как отдельная процедура или при трансуретральной резекции мочевого пузыря.
УЗИ (ультразвуковое исследование) пузыря и органов малого таза выявит новообразование, его вид, размеры, экспозицию и широту распространенности.
Использование магнитно-резонансной и компьютерной томография почек с введением контрастного вещества позволит обнаружить опухоль пузыря, степень её прорастания в стенки и соседние органы, развитие метастазов в регионарных лимфатических узлах.
Экскреторная томография с введением контрастных веществ в вену позволит осуществить контроль над их выходом из почек и последующим выводом из организма.
Лечение доброкачественных опухолей мочевого пузыря
Хирургическое удаление является обязательным при диагностике доброкачественных новообразований методом трансуретральной резекции, эндоскопии, электро- или лазерной коагуляции опухоли. Также предписывается полное удаления мочевого пузыря в случае значительного вовлечения его и уретры в опухолевый процесс.
Лекарственное лечение обычно бывает направлено на укрепления местного и общего иммунитета.
Противовоспалительная, противопаразитарная и противовирусная терапия назначается при необходимости.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
Источник
С. Х. Аль-Шукри, И. А. Корнеев
Кафедра урологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И. П. Павлова
Введение. В обзоре рассмотрены современные методы диагностики больных с поверхностным переходно-клеточным раком мочевого пузыря, рекомендованные Европейской ассоциацией урологов. Отражены перспективные направления проведения научных исследований, нацеленных на разработку новых диагностических тестов, позволяющих с высокой чувствительностью и специфичностью диагностировать рак мочевого пузыря на ранних этапах развития.
Ключевые слова: поверхностный рак мочевого пузыря; диагностика.
Рак мочевого пузыря (РМП) является наиболее распространенным новообразованием, поражающим мочевые пути, занимает седьмое место по частоте встречаемости среди злокачественных опухолей у мужчин и семнадцатое место – у женщин. Риск развития РМП в разных странах варьирует от 9 до 27 и от 2 до 6 на 100 000 населения у мужчин и женщин соответственно [1]. Также различается и риск смерти от РМП у мужчин и женщин и в Европейских странах составляет 8 и 3 на 100 000 населения соответственно [1].
Согласно современным представлениям примерно у трех четвертей больных с впервые диагностированным РМП новообразование является поверхностным – то есть не распространяется за пределы слизистой оболочки (стадии Та, Т1 и Тis). Несмотря на принадлежность к одной классификационной категории, биологический потенциал опухолей существенно различается. Новообразования с экзофитным ростом, имеющие папиллярное строение, развиваются медленно и редко становятся угрозой для жизни больного. Карциномы с начальными признаками роста в направлении мышечной стенки, особенно при низкой степени дифференцировки, как правило, рецидивируют и прогрессируют, приводя к местному распространению и отдаленному метастазированию. Карцинома in situ также относится к потенциально агрессивным низкодифференцированным новообразованиям. В связи с этим своевременная диагностика РМП и последующее оказание адекватной медицинской помощи являются залогом благоприятного прогноза при этом заболевании [2].
Гематурия является наиболее частым симптомом РМП. Боль и дизурия менее характерны для поверхностных карцином мочевого пузыря, однако, они могут указывать на наличие карциномы in situ или сопутствующий цистит. При сборе анамнеза следует обратить внимание на факторы риска развития РМП – курение, профессиональные вредности, а у больных с рецидивирующим течением заболевания – тщательно фиксировать все предшествующие лечебные мероприятия, результаты обследований и протоколы гистопатологических заключений [1].
Объективное обследование при поверхностном РМП выполняется у всех пациентов для получения полноценного представления о состоянии органов и систем организма, однако оно может не дать ценной информации, специфичной для опухолевого процесса [1].
Методы, позволяющие получить изображение, широко применяют при обследовании больных с подозрением на наличие РМП. Внутривенная урография позволяет определить соответствующие опухолевому поражению дефекты наполнения в чашечно-лоханочной системе почек и в мочеточниках, которые выявляют у 1,8 % больных РМП и 7,5 % пациентов с переходно-клеточными карциномами, расположенными в области мочепузырного треугольника. В последние годы на смену этому исследованию пришла компьютерная томография (КТ), для которой характерна более высокая чувствительность выявления опухолей небольших размеров и возможность получить информацию о степени их местного распространения и состоянии регионарных лимфатических узлов [3, 4].
Ультразвуковое сканирование часто применяют в качестве первичного метода визуализации мочевых путей. В последнее время чувствительность этого исследования при диагностике карцином
мочевого пузыря значительно повысилась за счет появления высокоточных современных аппаратов, способных получить изображение опухолей небольших размеров. Трансабдоминальное ультразвуковое исследование, как и рентгенологические методы диагностики, дает представление о состоянии полостных систем почек и наличии опухолей почечных лоханок и верхних отделов мочеточников [5].
Цитологическое исследование мочи позволяет с высокой вероятностью узнать о поражении уротелия, выстилающего мочевые пути, низкодифференцированной плоской опухолью – карциномой in situ. В связи с тем, что чувствительность этого исследования повышается по мере снижения степени дифференцировки РМП, отрицательный результат не позволяет исключить наличие карциномы. Недостатками этого метода также являются высокая степень субъективизма в интерпретации принадлежности полученных при заборе материала клеток к классификационным категориям, а также выраженная зависимость качества полученного для исследования материала от тщательности выполнения всех этапов подготовки препарата. Мочу для исследования следует сдавать днем, возможно также приготовление препаратов из смывов со стенок мочевого пузыря, сделанных при помощи физиологического раствора [6].
Предложенные различными исследователями молекулярные маркеры РМП в моче (NMP‑22, Immunocyt, BTA , BTA TRACK и др.), несмотря на большие ожидания, так и не позволили отказаться от цитологического исследования мочи или цистоскопии. В целом чувствительность этих новых тестов выше, чем цитологического исследования, однако они проигрывают в специфичности, так как полученные результаты зависят от множества факторов – сопутствующего воспаления, лечения при помощи вакцины БЦЖ, различаются при наличии первичных и рецидивных опухолей и др [7]. UroVision тест, основанный на идентификации микросателлитов хромосом, является наиболее перспективным на сегодняшний день [8].
Цистоскопия с трансуретральной резекцией (ТУР) папиллярного новообразования мочевого пузыря и последующим гистологическим исследованием удаленной опухолевой ткани является «золотым стандартом» диагностики папиллярных форм РМП. В ходе осмотра мочевого пузыря требуется внимательно рассмотреть все стенки и отметить места расположения выявленных опухолей на схематичном изображении – диаграмме мочевого пузыря. У больных, которым предположительный диагноз РМП был поставлен на основании явных признаков при рентгенологическом или ультразвуковом исследовании, цистоскопию в амбулаторных условиях можно не проводить и выполнить ее в условиях эндоскопической операционной, непосредственно перед ТУР. Целью ТУР при новообразованиях категорий Та и Т1 является уточнение диагноза и удаление всех видимых новообразований. Перед ТУР также следует провести бимануальную пальпацию мочевого пузыря под наркозом, а введение резектоскопа нужно осуществлять под визуальным контролем, при котором необходимо осмотреть мочеиспускательный канал на всем протяжении. Осмотр мочевого пузыря можно при наличии показаний дополнить взятием участков эпителиальной выстилки мочевого пузыря и простатического отдела уретры и завершить трансуретральной резекцией опухоли. Небольшие новообразования следует удалять единым блоком, в котором обязательно должен быть представлен участок подлежащей к опухоли стенки мочевого пузыря. Большие новообразования можно резецировать фрагментарно, однако в этом случае следует отдельно представить для патологоанатомического заключения участок мышечной стенки мочевого пузыря, расположенный под опухолью. В тех случаях, когда при бимануальной пальпации до операции было выявлено образование, после завершения операции это исследование следует повторить. Тщательное выполнение ТУР является залогом благополучного прогноза при РМП, а отсутствие в посланном для гистопатологического заключения материале мышечной ткани является фактором риска прогрессирования резидуальной опухоли [9, 10]
Показаниями к рандомизированной биопсии при РМП являются подозрение на наличие карциномы in situ мочевого пузыря, несоответствие между результатами цитологического и постхирургического гистопатологического исследований в отношении категории G, выявление новообразования T1G3 [11].
В последние годы для улучшения визуализации опухолей мочевого пузыря были предложены передовые технологии – флуоресцентная цистоскопия, цистоскопия в узком спектре, оптико-когерентная томография, конфокальная сканирующая лазерная микроскопия.
Фотодинамическая диагностика – флуоресцентная цистоскопия, которую выполняют в синем свете после предварительной экспозиции слизистой мочевого пузыря к 5‑аминолевулиновой кислоте или гексаминолевулиновой кислоте. Исследователи доказали, что такая подготовка позволяет с более высокой чувствительностью визуализировать злокачественно трансформированные зоны уротелиальной выстилки и, в частности, карциному in situ. В то же время специфичность такого исследования оказалась невысокой и в отдаленном периоде наблюдения оказалось, что в отличие от стандартной ТУР в белом свете, ТУР с флуоресцентным контролем приводит к снижению рецидивирования лишь на 9 % в течение 9 месяцев и не сказывается на прогрессировании рака и выживаемости больных [12].
Первый опыт применения цистоскопии с изображением в узком спектре, который получают, применяя светофильтры в 415 и 540 нм, дает возможность повысить частоту выявления РМП, что, однако, должно быть подтверждено последующими наблюдениями [13].
Перспективным направлением исследований, позволяющих получить высокое качество изображения, схожее с картиной, которую получают при исследовании препаратов мочевого пузыря под увеличением микроскопа, является оптикокогерентная томография (ОКТ). При ОКТ свет с длиной волны 1300 нм проникает вглубь стенки мочевого пузыря на 4 мм и отображается в приемном устройстве в виде поперечного послойного изображения с разрешением 15 нм. Комбинация этого метода с конфокальной сканирующей лазерной микроскопией, при которой может быть идентифицирована степень дифференцировки РМП, получила название оптической биопсии. При этом о ключевых диагностических признаках, играющих ведущую роль при прогнозировании клинического течения заболевания, можно судить еще на этапе диагностики [14].
В связи с тем, что существует значительный риск наличия резидуальных фрагментов поверхностных новообразований после ТУР, который особенно часто (33-53 % случаев) наблюдается при стадии Т1, а также принимая во внимание то, что при первичной диагностике у 4-50 % больных инвазивный переходно-клеточный рак ошибочно был расценен как поверхностный рак, всем пациентам, у которых при постхирургическом гистопатологическом исследовании были выявлены карциномы стадии Т1, степени G3 (за исключением карциномы in situ), показано выполнение повторной ТУР через 2-6 недель после первичной резекции. Это также следует делать в тех случаях, когда первичную ТУР полностью выполнить не удалось, а также при отсутствии фрагмента мышечной стенки в резецированном материале [15].
Патологоанатомическое заключение играет ведущую роль в диагностике РМП. В протоколе исследования каждого отправленного для изучения фрагмента должна быть описана глубина инвазии и степень дифференцировки рака, присутствие карциномы in situ или аномалий гистологического строения прилежащего к опухоли эпителия мочевого пузыря, наличие фрагментов детрузора и периваскулярной инвазии. Большинство ведущих урологических клиник проводят совместные конференции с представителями патологоанатомической службы, на которых совместно обсуждают оперированных больных для определения тактики их последующего лечения и режима послеоперационного наблюдения [16].
Принадлежность больных к группам риска рецидивирования и прогрессирования РМП в последнее время все чаще оценивают согласно предложенной Европейской организацией по исследованию и лечения рака системой балльной оценки, учитывающей глубину инвазии, степень дифференцировки, число, размер и предшествующее рецидивирование, а также наличие сопутствующей карциномы in situ [17].
Таким образом, в настоящее время ведущими профессиональными организациями на основании принципов доказательной медицины разработан и внедрен в медицинскую практику диагностический алгоритм, позволяющий выявлять РМП. Продолжается поиск новых методов, обладающих высокой чувствительностью и специфичностью, позволяющих получить раннее и более полное представление о классификационных категориях и прогнозе карцином мочевого пузыря.
Список литературы
- Аль-Шукри С. Х., Ткачук В. Н. Опухоли мочеполовых органов. СПб: Питер, 2000. С. 309.
- Корнеев И. А. Прогнозирование клинического течения поверхностного и местно-распространенного рака уротелия: Автореф. дис. д-ра мед. наук: 14.00.40 / С-Петербургский гос. мед. ун-т им. акад. И. П. Павлова. С‑Пб., 2006. С. 34.
- Palou J., Rodriguez-Rubio F., Huguet J. et al. Multivariate analysis of clinical parameters of synchronous primary superficial bladder cancer and upper urinary tract tumours // J. Urol. 2005. Vol.174 (3). P. 859-861.
- Nolte-Ernsting C., Cowan N. Understanding multislice CT urography techniques: many roads lead to Rome // Eur. Radiol. 2006. Vol.16 (12). P. 2670-2686.
- Goessl C., Knispel H. H., Millar K. et al. Is routine excretory urography necessary at first diagnosis of bladder cancer? // J. Urol. 1997. Vol.157 (2). P. 480-481.
- Têtu B. Diagnosis of urothelial carcinoma from urine // Mod Pathol. 2009. Vol. 22 (Suppl 2). S. 53-59.
- Yutkin V., Nisman B., Pode D. Can urinary biomarkers replace cystoscopic examination in bladder cancer surveillance? // Expert Rev Anticancer. 2010. Vol. 10 (6). P. 787-790.
- Schlomer B. J., Ho R., Sagalowsky A. et al. Prospective Validation of the Clinical Usefulness of Reflex Fluorescence In Situ Hybridization Assay in Patients With Atypical Cytology for the Detection of Urothelial Carcinoma of the Bladder // J. Urol. 2010. Vol. 183 (1). P. 62-67.
- Aaronson D. S., Walsh T. J., Smith J. F. et al. -analysis: does lidocaine gel before flexible cystoscopy provide pain relief? // BJU Int. 2009. Vol. 104 (4). P. 506-509; ion 509-10.
- Blick C. G., Nazir S. A., Mallett S. et al. Evaluation of diagnostic strategies for bladder cancer using computed tomography (CT) urography, flexible cystoscopy and voided urine cytology: results for 778 patients from a hospital haematuria clinic // BJU Int. 2012. Vol. 110 (1). P. 84-94.
- Mungan M. U., Canda A. E., Tuzel E. et al. Risk factors for mucosal proic urethral involvement in superficial transitional cell carcinoma of the bladder // Eur. Urol. 2005. Vol. 48 (5). P. 760-763.
- Grossman H. B., Stenzl A., Fradet Y. et al. Long-term decrease in bladder cancer recurrence with examinolevulinate enabled fluorescence cystoscopy // J. Urol. 2012. Vol. 188 (1). P. 58-62.
- Cauberg E. C., Kloen S., Visser M. et al. Narrow band imaging cystoscopy improves the detection of non-muscle-invasive bladder cancer // Urology. 2010. Vol. 76 (3). P. 658-663.
- Данильченко Д. И., Кениг Ф., Кастайн А. и др. Интравитальная оптическая биопсия рака мочевого пузыря: реальность и перспективы развития. Тезисы докладов четвертого международного урологического симпозиума «Диагностика и лечение рака мочевого пузыря», Нижний Новгород, 2005. С. 24.
- Divrik R. T., Yildirim Ü., Zorlu F. et al. The effect of repeat transurethral resection on recurrence and progression rates in patients with T1 tumours of the bladder who received intravesical mitomycin: a prospective, randomized clinical trial // J. Urol. 2006. Vol. 175 (5). P. 1641-1644.
- Lopez-Beltran A., Bassi P., Pavone-Macaluso M. et al. Handling and pathology reporting of specimens with carcinoma of the urinary bladder, ureter, and renal pelvis // Eur. Urol. 2004. Vol.45 (3). P. 257-266.
- Sylvester R. J., van der Meijden A. P., Oosterlinck W. et al. Predicting recurrence and progression in individual patients with stage TaT1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials // Eur. Urol. 2006. Vol. 49 (3). P. 466-465.
Источник
