Инвазия слизистой мочевого пузыря
Заболеваемость
В среднем заболеваемость раком мочевого пузыря в Европе составляет 19.5, а смертность ― 7.9 случаев на 100 тыс. человек в год. У 70% больных рак мочевого пузыря диагностируется в возрасте старше 65 лет.
Диагноз
Морфологический диагноз устанавливается в соответствии с классификацией ВОЗ на основании данных биопсии, полученной с помощью трансуретральной (ТУР) резекции первичной опухоли (таблица №1).
Также в соответствии с последними критериями ВОЗ опухоли должны классифицироваться как высоко- и низкодифференцированные опухоли, но могут подразделяться и согласно классификации 1973 года на высокодифференцированные, умереннодифференцированные и низкодифференцированные опухоли мочевого пузыря. В 90% случаев диагностируется переходно-клеточный рак мочевого пузыря.
Таблица №.1 ВОЗ/МОУП 1998 консенсус ВОЗ, 2004
- Уротелиальная папиллома
- Папиллярная уротелиальная неоплазма с низким злокачественным потенциалом
- Низкодифференцированная уротелиальная карцинома
- Высокодифференцированная уротелиальная карцинома
ВОЗ ― всемирная организация здравоохранения; МОУП ― международное общество урологической патологии.
Стадирование и факторы риска
Должны быть представлены полный анамнез, физикальное обследование, общий анализ крови, уровень креатинина в сыворотке крови, рентгенография органов грудной клетки, КТ-исследование органов брюшной полости и малого таза, цитологическое исследование мочи.
Дополнительные диагностические тесты (сканирование костей скелета) проводятся, при наличии клинических показаний.
Стандартным является проведение цистоскопии, ТУР с биопсией, бимануального осмотра под анестезией с определением количества и размеров образования и наличия экстравезикального распространения или инвазии окружающих органов.
Оптимальным считается отправка патоморфологу образцов опухоли, взятых у ее основания и по краям, чтобы в них обязательно присутствовали собственная пластинка и мышечная оболочка, которые помогают в точной постановке диагноза.
Также, при локализации опухоли в области треугольника или шейки мочевого пузыря или при отсутствии опухоли мочевого пузыря, биопсии должны быть взяты из простатической части уретры и данная процедура выполняется для цитологического подтверждения, так как опухоль может быть расположена в уротелии, выстилающем простатическую часть мочеиспускательного канала или протоки.
Стадирование рака мочевого пузыря базируется на результатах морфологического исследования, включающего в себя гистологический вариант рака, степень дифференцировки и глубины инвазии.
Стратификация риска должна использоваться для неинвазивного рака мочевого пузыря в соответствии с размером, степенью дифференцировки и наличием в анамнезе опухоли (таблица №2а).
Стадирование инвазивного рака мочевого пузыря проводится в соответствии с классификацией TNM, на основании которой больные распределяются в следующие группы риска (таблица №2b).
Таблица №2а. Классификация групп риска неинвазивного рака мочевого пузыря
- Группа низкого риска – Первичная, низкодифференцированная, опухоль
- Группа промежуточного риска – Низкодифференцированная, рецидивирующая, множественная или опухоль >3 см
- Группа высокого риска – Любая высокодифференцированная неинвазивная опухоль или карцинома in situ
Таблица №2b. Стадирование инвазивного рака мочевого пузыря
Стадия 1 T1 N0 МО
Стадия II Т2а-Ь N0 МО
Стадия III Т3а-Т4а N0 МО
Стадия IV T4b N0 M0
Стадия IV Любая Т N 1-3 МО
Стадия IV Любая T Любая N M1
Лечение неинвазивного рака мочевого пузыря (I стадия)
Трансуретральная резекция (ТУР) является методом выбора у больных с начальной стадией болезни. ТУР должна сопровождаться в последующем однократным введением химиопрепаратов при низком риске рецидива, многократным – при промежуточном прогнозе и введением бацилл Кальметта-Герена (БЦЖ-вакцина) при высоком риске рецидива.
Повторная ТУР является разумным выбором в группе высокого риска либо до начала внутрипузырной терапии [II, B], либо после ее окончания [III, B].
В случае карциномы in situ или безуспешной вакцинотерапией высокодифференцированной Т1 опухоли пациентам выполняется цистэктомия в связи с высоким риском прогрессирования болезни [III, B].
Лечение инвазивного рака мочевого пузыря (II и III стадии)
Радикальная цистэктомия с выполнением расширенной лимфодиссекции является стандартом лечения.
Расширенная лимфаденкэтомия показала преимущество и может являться лечебной у пациентов с метастазами или микрометастазами в нескольких лимфоузлах.
Реконструкция может быть выполнена либо в подвздошном канале, либо перемещением мочевого пузыря, в зависимости от характеристик опухоли и желания пациента.
Дистанционная лучевая терапия может рассматриваться в качестве лечебного мероприятия только в случае, если пациенту невозможно выполнить цистэктомию или органосохраняющую операцию.
Результаты двух рандомизированных исследований и мета-анализа поддерживают использование неоадъювантной химиотерапии перед цистэктомией у больных Т2-Т3 стадией. Неоадъювантная химиотерапия комбинациями на основе платиновых производных перед радикальной цистэктомией или лучевой терапией способствует улучшению показателей выживаемости [I,A].
Данные о целесообразности проведения адъювантной химиотерапии попрежнему противоречивы. Адъювантная химиотерапия не может быть рекомендована для рутинного использования в клинической практике. Однако, данные, основанные на ретроспективном анализе, демонстрируют некоторое преимущество в проведении адъювантной химиотерапии у пациентов с «положительными » лимфоузлами, это дополнительное лечение может быть рассмотрено в данном контексте.
Органосохраняющие подходы с выполнением полной ТУР и одновременной химиолучевой терапией, или дистанционная лучевая терапия в полных дозах являются обоснованной альтернативой для пациентов, не подлежащих хирургическому лечению или отказывающихся от цистэктомии [II,A].
Одновременное применение цисплатина и лучевой терапии является наиболее распространенным химиолучевым методом.
В случае отсутствия остаточной опухоли после обследования малого таза и биопсии (рТ0), в дополнение к хирургическому методу лечения рекомендуется облучение.
При проведении контрольной цистоскопии до 70% пациентов являются здоровыми (т.е. у них отсутствует опухоль). Однако в дальнейшем у 1/4 больных развивается новое поражение, требующее дополнительного лечения.
Идеальным пациентом для выполнения органосохраняющей операции является пациент со стадией Т2, размером гидронефроза, в хорошем соматическом статусе, с хорошим объемом и функцией мочевого пузыря [II, A]. В обоих случаях рекомендуется ТУР для того, чтобы обеспечить ответ и рестадировать опухоль.
Лечение метастатического рака мочевого пузыря (IV стадия)
Платиносодержащая комбинированная химиотерапия (метотрексат, винбластин, адриамицин, цисплатин или гемцитабин+цисплатин) увеличивает продолжительность жизни больных [I,A].
Добавление третьего препарата (паклитаксел) к гемцитабину и цисплатину продемонстрировало преимущество только в той подгруппе пациентов, у которых мочевой пузырь являлся первичным местом возникновения болезни и должен рассматриваться в качестве исследуемого. У пациентов, которым невозможно проведение химиотерапии, основанной на цисплатине, могут быть использованы комбинации на основе карбоплатина либо применение таксанов или гемцитабина в монорежиме. У пациентов со статусом ECOG 2 и плохой функцией почек польза от проведения химиотерапии ограничена, и такие пациенты нуждаются в выработке новых стратегий лечения.
Отдельные больные с Т4b и/или N1 стадией могут являться кандидатами для выполнения цистэктомии и лимфодиссекции или лучевой терапии после предшествующей системной химиотерапии.
Роль антиангиогенных препаратов в качестве первой и второй линий терапии продолжает изучаться в клинических исследованиях. Винфлюнин появился в качестве альтернативы использования во второй линии у пациентов при прогрессировании болезни после первой линии терапии на основе платины [I, B], обеспечивая увеличение выживаемости у данной категории больных.
Лучевая терапия с паллиативной целью может использоваться для уменьшения симптомов, ассоциированных с опухолевым процессом. Определяется роль консолидирующей лучевой терапии после проведения химиотерапии у пациентов с локорегионарными рецидивами.
Оценка эффективности
Оценка эффективности лечения с проведением повторной цистоскопии и цитологичеким исследованием является обязательной процедурой у больных после БЦЖ терапии и органосохраняющего лечения. Рекомендуется оценка эффективности в процессе проведения химиотерапии с выполнением изначальных радиографических исследований.
Наблюдение
Для пациентов, получавших дистанционную лучевую терапию, цистоскопия и цитологическое исследование мочи должны проводиться каждые 3 месяца в течение первых 2 лет и далее каждые 6 месяцев. После цистэктомии клинический контроль должен осуществляться каждые 3 месяца в течение первых 2 лет и в последующем каждые 6 месяцев в течение 5 лет.
Источник
Хронические воспалительные заболевания нижних мочевых путей у женщин чрезвычайно распространены и являются частой причиной обращения пациенток к урологу, гинекологу, терапевту и врачам других специальностей. Расстройства мочеиспускания являются причиной ежегодного обращения к врачу около 3 млн женщин в США. В России заболеваемость циститом составляет 15-20 тыс. на 1 млн человек, около 20-25% женщин переносят цистит в той или иной форме, а примерно 10% пациенток страдают хроническим циститом [1].
[1]. В России примерно 10% женщин страдают хроническим циститом
Для инфекций нижних мочевых путей (НИМП) характерно рецидивирование. Установлено, что у 50% женщин после эпизода цистита в течение года развивается рецидив, у 27% молодых женщин рецидив развивается в течение 6 месяцев после первого эпизода цистита, причем у 50% больных рецидивы отмечаются более 3 раз в год. Такая высокая частота рецидивирования объясняется следующими факторами:
– анатомо-физиологическими особенностями женского организма (короткая и широкая уретра, близость к естественным резервуарам инфекции – анусу, влагалищу), возможными аномалиями расположения наружного отверстия уретры;
– частыми сопутствующими гинекологическими заболеваниями – воспалительными процессами во влагалище, гормональными нарушениями, приводящими к нарушению биоценоза влагалища и колонизации в нем патогенной микрофлоры
– генетической предрасположенностью;
– способностью грамотрицательных микроорганизмов, вызывающих инфекционный процесс в уретре и мочевом пузыре, к адгезии к клеткам эпителия, вследствие наличия фимбрий и ворсин;
– частой ко-инфекцией атипичными микроорганизмами (уреаплазмой, хламидиями, микоплазмой и др.), приводящей к стойким морфологическим перестройкам уротелия
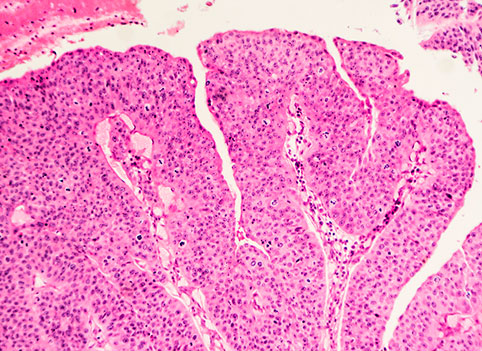
Мочевой пузырь у здоровых женщин обладает защитными механизмами, препятствующими бактериальной инвазии. В норме переходный эпителий мочевого пузыря (уротелий) выделяет на поверхность гликозаминогликановую (мукополисахаридную) субстанцию (рис. 1), препятствующую адгезии бактерий, миграции компонентов мочи в подслизистый слой. Разрушение слоя муцина приводит к усилению миграции ионов калия в интерстиций. В ряде работ показано, что миграция ионов калия в интрестиций приводит к деполяризации сенсорных нервных окончаний, спазму гладкой мускулатуры, повреждению кровеносных и лимфатических сосудов. Нормальный уровень калия в моче колеблется в пределах 20-150 ммоль/л, в случае повреждения муцинового слоя этой концентрации достаточно, чтобы вызвать стойкую дизурию.
Нередко при обследовании женщин со стойкой дизурией в общем анализе мочи и посеве мочи отсутствуют патологические изменения. Пациентки проходят множество неэффективных курсов общего и местного лечения, нередко у них предполагают наличие интерстициального цистита и даже психические заболевания. Однако известно, что при обследовании пациенток со стойкой дизурией, интерстициальный цистит обнаруживается лишь у 3,6 % пациенток.
По данным разных авторов при цистоскопии у 63,6-100% пациенток со стойкой дизурией, хронической тазовой болью обнаруживается лейкоплакия с расположением в шейке мочевого пузыря и мочепузырном треугольнике [10]. В то же время лейкоплакия до настоящего времени является наиболее неизученным заболеванием слизистой оболочки мочевого пузыря. В свете современных исследований лейкоплакия представляет собой патологический процесс, который характеризуется нарушением основных функций многослойного плоского эпителия: отсутствием гликогенообразования и возникновением ороговения – которые в норме отсутствуют [12].
Лейкоплакией принято называть белесоватые пятна на видимых слизистых оболочках (полости рта, мочевых органов, шейки матки и др). При морфологическом исследовании участков лейкоплакии обнаруживается метаплазия переходного эпителия в многослойный плоский, иногда с ороговением. С момента первого описания лейкоплакии мочевого пузыря были предложены разнообразные теории ее возникновения. Среди причин называли дефекты эмбрионального развития, инфекции (туберкулез, сифилис), гиповитаминоз витамина А, но в настоящее время эти теории опровергнуты. Долгое время была принята теория возникновения лейкоплакии мочевого пузыря вследствии воспаления, в пользу которой высказывался П.А. Герцен (1910). Однако в работах зарубежных морфологов показано, что метаплазия эпителия сопровождается отеком подлежащей ткани и вазодилятацией, но не выраженным воспалением. По аналогии с лейкоплакией других локализаций, лейкоплакию мочевого пузыря многие авторы рассматривали как предраковое состояние. Между тем не имеется ни одного достоверного случая перехода плоскоклеточной метаплазии уротелия в рак.
Бесспорна роль урогенитальных инфекций (Ch. trachomatis, U. urealiticum, N.gonorrhoeae, M. genitalium, T.vaginalis, H. simplex I, II) в этиологии уретритов, циститов у женщин [3, 9, 10]. Однако под воздействием возбудителей урогенитальных инфекций, в отличие от неспецифических патогенов (E. coli и др.), происходит не обычное воспалительное повреждение тканей мочевого тракта. В ответ на урогенитальные инфекции в уротелии обнаруживаются различные формы дистрофического повреждения с исходом в плоскоклеточную метаплазию чаще без ороговения. В зоне плоскоклеточной метаплазии (лейкоплакии) наблюдается разрушение муцинового слоя, разобщение и десквамация клеток поверхностного слоя. Показано, что у пациенток со стойкой дизурией и ургентностью с или без бактериурии при цистоскопии с биопсией выявлялась плоскоклеточная метаплазия с разной выраженностью подслизистого фиброза. Интересно, что при выраженной степени морфологических изменений, бактерии отсутствовали [13, 14, 15].
Инфекция является причинным фактором повреждения уротелия и формированием метаплазии, в то время как дальнейшая альтерация происходит вне зависимости от инфекции, приводя к стойкой дизурии. У пациенток с лейкоплакией имеется повышенная проницаемость эпителия, невозможна адаптивная перестройка уротелия при физиологическом наполнении мочевого пузыря, что приводит к диффузии компонентов мочи в интерстиций и развитию учащенного, болезненного мочеиспускания, болей над лоном, в уретре и т.д [16]. Длительно протекающие инфекции, особенно на фоне заболеваний, передающихся половым путем (Chlamidia trachomatis, Ureaplasma urealiticum, N.gonorrhoeae, Mycoplasma hominis, T. vaginalis, Herpes simplex I,II) приводят к выраженным морфологическим изменениям уротелия, так называемым поствоспалительным изменениям уротелия.Наиболее часто развивается лейкоплакия мочевого пузыря, реже формируются псевдополипы.
На кафедре урологии и хирургической андрологии РМАПО был разработан алгоритм обследования и лечения пациенток со стойкой дизурией, вызванной лейкоплакией мочевого пузыря.
В план обследования пациенток со стойкой дизурией должны входить:
1. Тщательно собранный анамнез:
Особенности течения рецидивирующих инфекций мочевых путей, протекающих после перенесенных или на фоне инфекций, передающихся половым путем:
a) длительность заболевания более 2 лет;
b) наличие поллакиурии вне периода обострения до 11-14 раз в сутки;
c) постоянные выраженные боли над лоном, в области уретры, влагалища, которые приводили к сексуальной и социальной дезадаптации;
d) неэффективность традиционной антибактериальной терапии.
2. Общий анализ мочи.
3. Посев мочи на флору и чувствительность к антибиотикам
4. Осмотр в «зеркалах» для исключения анатомических изменений, с проведением пробы O’Donnel.
5. Осмотр гинекологом.
6. Обследование на наличие инфекций, передающихся половым путем (ИППП), 2 методами из 2 локусов (цервикальный канал и уретра).
7. Ультразвуковое исследование органов мочевой и половой системы,
8. Цистоскопия с биопсией и морфологическим исследованием биоптата.
Аномалии расположения наружного отверстия уретры. Часто у пациенток с указанной патологией манифестация мочевой инфекции происходит в детском возрасте: развиваются вагиниты, рецидивирующие хронические уретриты, циститы. После начала половой жизни после полового акта отмечается значительное усиление симптомов . При влагалищном осмотре определяется вагинализация уретры, уретро-гименальные спайки, положительным оказывается тест O’Donnel. Ретроградное инфицирование нижних мочевых путей приводит к формированию и поддержанию хронического воспалительного процесса в уретре, мочевом пузыре и стойкой дизурии [6].
При обнаружении изменений в общем анализе мочи и росте флоры в посеве мочи следует назначить курс антибактериальной терапии с учетом данных антибиотикограммы. При наличии ИППП препаратами выбора являются макролиды(джозамицин, азитромицин, мидекамицин), тетрациклины (доксициклин), фторхинолоны (моксифлоксацин, левофлоксацин, офлоксацин). При выявлении генитального герпеса проводится противовирусная терапия (ацикловиром, валацикловиром, фамцикловиром) [4, 7, 8].
После лечения или в случае отсутствия патологических изменений в анализах у всех пациенток с длительностью заболевания более двух лет обязательно проводят уретроцистоскопию с биопсией мочевого пузыря. Это необходимо для уточнения локализации поражения мочевого пузыря и определения степени диспластических процессов в зоне шейки мочевого пузыря и мочепузырного треугольника,исключения заболеваний мочевого пузыря и уретры, протекающих со сходной клинической симптоматикой (опухоли, туберкулеза, эндометриоза и т.д). Лейкоплакия при рецидивирущих инфекциях в основном локализуется в задней уретре, шейке мочевого пузыря и мочепузырном треугольнике, иногда в зоне шейки мочевого пузыря обнаруживаются псевдополипы (рис. 2).
Несмотря на то, что эндоскопическая картина лейкоплакии мочевого пузыря весьма характерна, необходимо гистологическое подтверждение диагноза. Дифференциальный диагноз следует проводить с плоскоклеточной папилломой и, в редких случаях, с раком мочевого пузыря.
После морфологического подтверждения диагноза возможно проведение лечения.
Лечение лейкоплакии мочевого пузыря должно быть комплексным. Наиболее эффективным лечением лейкоплакии является курс внутрипузырной терапии. Однако до ее начала обязательно проводится лечение неспецифической и специфической инфекции мочевых путей.
[1]. Наиболее эффективным лечением лейкоплакии является курс внутрипузырной терапии
Выбор антибактериального препарата при рецидивирующих инфекциях должен производиться на основе данных микробиологического исследования. Антибактериальная терапия должна быть длительной (до 7-10 дней). Выбор препарата производят с учётом выделенного возбудителя и антибиотикограммы. Необходимо назначение антибиотиков с бактерицидным действием. Препаратами первой линии терапии неосложненных инфекций нижних мочевых путей, в случае исключения наличия ИППП, являются такие препараты как фосфомицин-трометамол, фторхинолоны (норфлоксацин), нитрофурантоин.При обнаружении ИППП препаратами выбора являются макролиды (джозамицин, азитромицин, мидекамицин), тетрациклины (доксициклин), фторхинолоны (моксифлоксацин, левофлоксацин, офлоксацин). При выявлении генитального герпеса проводится противовирусная терапия (ацикловиром, валацикловиром, фамцикловиром). После окончания курса терапии необходимо проведение культурального контроля.
Альтернативным подходом в лечении инфекций мочевых путей является стимуляция собственных иммунных механизмов пациента, направленных против патогенной флоры, с помощью орального назначения иммунотерапевтических препаратов. Одним из таких препаратов является уро-ваксом − лиофилизированный белковый экстракт, полученный путем фракционирования щелочного гидролизата наиболее распространенных уропатогенных штаммов E. coli. Препарат применяется по 1 капсуле в сутки натощак в течение 3 месяцев, затем по 1 капсуле в сутки натощак в течение 10 дней каждого месяца в течение 3 месяцев. Мы рекомендуем прием препарата после проведения специфической терапии.
Заслуживает внимания применение бактериофагов в лечении хронических рецидивирующих ИМП, что особенно актуально для пациентов с поливалентной аллергией к антибактериальным препаратам или наличием полирезистентных возбудителей. Несмотря на отсутствие плацебо-контролируемых исследований применения бактериофагов, клиническая эффективность указанных препаратов не вызывает сомнений. Перед назначением лечения обязателен посев мочи с определением чувствительности возбудителя к бактериофагам. В стандартной схеме бактериофаги применяются по 20 мл х 3 раза в день за 40 минут до еды в течение 2 недель.
[2]. Перед назначением лечения обязателен посев мочи с определением чувствительности возбудителя к бактериофагам
[3]. После проведения курса противовоспалительной терапии необходимо местное лечение лейкоплакии мочевого пузыря, направленной на восстановлении муцинового слоя
После проведения курса противовоспалительной терапии необходимо местное лечение лейкоплакии мочевого пузыря, направленной на восстановлении муцинового слоя.Наиболее целесообразны инстилляции природных или синтетических аналогов гликозаминогликанов в мочевой пузырь (гепарина, гиалуроновой кислоты, хондроитина сульфата, пентозанполисульфата и др.). Под воздействием инстилляций аналогов ГАГ происходит восстановление муцинового слоя, регрессия плоскоклеточной метаплазии. Используется схема терапии, подобная лечению интерстициального цистита, при котором также обнаруживают дефекты муцинового слоя [18]. Наиболее доступным и эффективным препаратом для лечения лейкоплакии мочевого пузыря является гепарин, который вводят внутрипузырно в виде раствора: гепарин – 25 тысяч единиц – 5 мл, 2 % раствор лидокаина – 2 мл, 0,9 % раствор натрия хлорида – 13 мл; инстилляции проводят 2-3 раза в неделю в течение 3 месяцев. Для профилактики обострений инфекции инстилляции целесообразно проводить на фоне приема уроантисептиков, препаратом выбора может являться растительный препарат канефрон, назначаемый на весь курс инстилляций по 2 драже 3 раза в день или по 50 капель 3 раза в день. После окончания лечения проводится контрольная уретроцистоскопия.
[4]. Наиболее доступным и эффективным препаратом для лечения лейкоплакии мочевого пузыря является гепарин, который вводят внутрипузырно в виде раствора. Инстилляции проводят 2-3 раза в неделю в течение 3 месяцев
При наличии псевдополипоза шейки мочевого пузыря или неэффективности консервативной терапии лейкоплакии показано хирургическое лечение в объеме трансуретральной электровапоризации или электрорезекции пседополипов, лейкоплакии [7,15].
Пациенткам, у которых стойкая дизурия развилась и поддерживается на фоне «вагинализации» наружного отверстия уретры, показана операция транспозиция уретры, рассечение уретро-гименальных спаек после проведения лечения лейкоплакии мочевого пузыря.
На рис. 4 представлены обобщенные данные о патогенезе и лечении лейкоплакии мочевого пузыря у женщин.
В основе успешного лечения расстройств мочеиспускания лежит проведение тщательной дифференциальной диагностики заболеваний, которые приводят к дизурии. Лечение расстройств мочеиспукания в большинстве случаев должно быть комплексным, воздействующим на различные звенья патогенеза болезни.
Литература
1. Лоран О.Б., Зайцев А.В., Годунов Б.Н., Каприн А.Д., Давидьянц А.А. //Урол. и нефрол. – 1997. – №6. – С.7-14.
2. Загребина О.С.Этиологическое значение Ureaplasma urealiticum в развитии воспалительных процессов половых и мочевых органов у женщин: Дисс. … канд. мед. наук – М., 2001. – С. 8-20, 130-136.
3. Parsons C. Lowell. //Contemp.urol. – 2003. – Feb. – P.22-31.
4. Перепанова Т.С, Кудрявцев Ю.В., Хазан П.Л // Consilium Medicum Прил.Урология. – 2002. – С.5-9.
5. Астапов А.И. Трансуретральная электровапоризация в комплексном лечении женщин страдающих хроническим циститом: Дисс. … канд. мед. наук – М., 2003
6. Гвоздев М.Ю. Транспозиция дистального отедла уретры в оперативном лечении и сексуальной реабилитации женщин, страдающих хроническим циститом: Дисс. … канд. мед. наук – М., 2000. – С.18.
7. Страчунский Л.С., Рафальский В.В., Сехин С.В., Абрарова Э.Р //Урология. – 2002. – №2. – С.8-14.
8. Яковлев С.В. //Consilium medicum. – 2001. – Т.3. – №7. – С.300-306.
9. Косова И.В. Роль урогенитальных инфекций в этиологии циститов и необструкутивных пиелонефритов у женщин: Дисс. … канд. мед. наук – М., 2005.
10. Burkhard FC, Blick N, Studer UE “Urinary urgency, and chronic urethral and/or pelvic pain in females. Can doxycycline help?” //J Urology, 2004
11. Patelli E, Mantovani F, Catanzaro M, Pisani E “Urgency-frequency syndrome in women: interstitial cystitis and cor syndromes” //Arch Ital Urol Androl. – 1999; Dec; 71(5): 317-20.
12. Смирнов Д.С. «Особенности диагностики и лечения больных с лейкоплакией мочевого пузыря» Авт. дисс. – СПб, 2007.
13. Okamura K, Ito K, Suzuki Y, Shimoji T «Histological study of cases of bladder cancer and chronic cystitis with difficulty in cystoscopic diagnosis» Hinyokika Kiyo. – 1984; Apr; 30(4): 459-65.
14. Vitoratos N, Gregoriou O, Papadias C, Liapis A, Zourlas PA. «Sexually transmitted diseases in women with urethral syndrome» //Int J Gynaecol Obstet. – 1988; Oct; 27(2): 177-80.
15. Murakami S, Igarashi T, Takahara M, Yamanishi T, Shimazaki J, Shigematsu H. «Squamous plasia of the trigone in women with recurrent cystitis syndrome» //Hinyokika Kiyo. – 1985; Feb; 31(2): 301-7.
16. Sideri M, De Virgiliis G, Rainoldi R, Ferrari A, Remotti G. Junctional pattern in the squamous plasia of the female trigone. A freeze-fracture study. //J Urol. 1983 Feb;129(2):280-3.
17. Зайцев А.В. Диагностика и лечение интерстициального цистита у женщин: Дисс.док.мед.наук. – М.,1999.
Рисунки смотрите в приложении
Источник
