Иммуногистохимия при раке мочевого пузыря
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Цмокалюк Е.Н. 1 Маслякова Г.Н. 1
1 ГБОУ ВПО Саратовский ГМУ им.В.И.Разумовского Минздравсоцразвития РФ
Проведен анализ результатов иммуногистохимического исследования 13 моноклональных антител в биопсийном материале фрагментов ткани опухоли, полученного у пациентов, страдающих различными формами рака мочевого пузыря. Было обследовано 106 пациентов с новообразованиями мочевого пузыря, проходивших лечение в НИИ «Фундаментальной и клинической уронефрологии» Саратовского ГМУ. С помощью обзорных методов окрашивания диагноз уротелиального рака был поставлен 94 пациентам. Иммуногистохимические реакции проводили, используя стрептавидин-биотиновый метод. После обработки полученных данных все используемые антитела были разбиты на три основные группы по диагностической значимости: маркеры, информативные для ранней и дифференциальной диагностики поверхностных форм рака – маркеры Кi67, р53, p63; для определения глубины инвазии – маркеры р53, EGFR; для прогноза заболевания – маркер Кi67.
маркеры прогноза
моноклональные антитела
рак мочевого пузыря
Давыдов М.И. Злокачественные образования в России и странах СНГ в 2001 г. / М.И. Давыдов, Е.М. Аксель. – М.,2003.
Лопаткин Н.А. Руководство по урологии. – М.: Медицина, 1998. – Т.З. – 670 с.
Магер О.В., Казанцева Н.В. Прогностическое значение биологических маркеров у больных поверхностным и инвазивным раком мочевого пузыря // Онкоурология. – 2006. – №4. – С. 30-34.
Матвеев Б.П. Клиническая онкоурология.- Москва, 2003. – С.195-244.
Петров, С.В. Руководство по иммуногистохимической диагностике опухолей человека / С.В. Петров, Н.Т. Райхлин. – Казань, 2004. – 456 с.
Франк Г.А., Завалишина Л.Э., Андреева Ю.Ю. Иммуногистохимическая характеристика и степень дифференцировки рака мочевого пузыря // Архив патологии. -2002. – Т.64, № 6. – С.16-18.
Высокий интерес к совершенствованию ранней диагностики онкоурологических заболеваний обусловлен их широким распространением, высокой смертностью и снижением качества жизни больных, нередко сопровождающегося развитием инвалидности [4]. Рак мочевого пузыря является самым частым новообразованием мочевыводящих путей.
Ежегодно в мире раком мочевого пузыря заболевают 335,8 тыс. человек, с развитием летального исхода у 132 тыс. человек, то есть каждый третий умирает от данного заболевания. В России регистрируется ежегодно примерно 12700 новых случаев рака мочевого пузыря. Его доля в структуре онкологической заболеваемости среди мужского населения составляет 4,5 %, среди женского населения – 1,1 % [1].
В Российской Федерации выявление больных с поверхностной формой рака (I стадия) составляет всего лишь 20-30 % наблюдений, в противоположность зарубежным данным, в соответствии с которыми I стадия рака мочевого пузыря диагностируется в 80 % случаев [2]. В нашей стране в 11,6-15,6 % наблюдений выявляется IV стадия рака мочевого пузыря.
Следует указать и тот факт, что при адекватной диагностике и своевременном лечении жизнь умерших от рака мочевого пузыря можно было бы продлить в среднем на 14 лет. Именно поэтому, своевременная диагностика опухолей мочевого пузыря остается одной из важнейших задач современной онкоморфологии.
В современной литературе имеется большой объем опубликованных работ по применению диагностических иммуногистохимических маркеров при раке мочевого пузыря [3,5,6]. Однако, в клинических рекомендациях, выпущенных по инициативе Российского общества онкоурологов с разрешения Европейской ассоциации по урологии, в 2009 году сведения по применению конкретных иммуногистохимических маркеров для диагностики рака мочевого пузыря отсутствуют. Нет их и в стандартах диагностики и лечения рака мочевого пузыря, как в России, так и в Европе. Все вышесказанное позволило нам сформулировать цель нашего исследования.
Разработать панель иммуногистохимических маркеров ранней диагностики, стадирования и прогноза рака мочевого пузыря.
Материалы и методы исследования
Материалом для исследования послужили операционный и биопсийный материал 106 пациентов с новообразованиями мочевого пузыря, проходивших лечение в НИИ «Фундаментальной и клинической уронефрологии» ГБОУ ВПО Саратовский ГМУ им. В.И.Разумовского Минздравсоцразвития России. С помощью обзорных методов окрашивания диагноз уротелиального рака был поставлен 94 пациентам. Остальные 12 пациентов составили группу сравнения. Операционный и биопсийный материалы были зафиксированы в 10 %-м растворе нейтрального формалина и залиты в парафин. Срезы толщиной 5-7 мкм, окрашенные гематоксилин-эозином, были подвергнуты обзорному морфологическому анализу, при котором стадию рака определяли в соответствии с классификацией TNM, а степень дифференцировки опухолевых клеток оценивали в соответствии с рекомендациями ВОЗ, 2004. Микроскопическое изучение препаратов было проведено с применением бинокулярного микроскопа «Micros MC100» при 400-кратном увеличении.
Иммуногистохимические реакции проводили на серийных парафиновых срезах (5мкм), используя стрептавидин-биотиновый метод. В качестве детекционной системы применяли систему LSAB2 System, HRP (K0675), Dako, в качестве хромогена – диаминобензидин (Dako).
Иммуногистохимическое исследование 13 маркеров было проведено на биопсийном и операционном материале 66 пациентов. Все используемые моноклональные антитела были разделены на группы по функциональной значимости:
- маркеры пролиферативной активности – Ki67, PCNA, p63;
- супрессор опухолевого роста – р53;
- маркер апоптоза – Bcl2;
- рецептор эпидермального фактора роста – EGFR;
- цитокератиновый профиль – СК7, СК8, СК10/13, СК17, СК18, СК19.
Интенсивность реакций с антигенами, локализованными в цитоплазме (цитокератины 7,8,13,17,18,19) и на мембранах клеток (EGFR), оценивали полуколичественным способом по балльной шкале от 0 до 3, учитывая выраженность реакции и ее локализацию: 0 – отсутствие реакции, 1 – слабая реакция, 2 – умеренная реакция, 3 – сильная реакция.
Результаты реакций с антигенами, имеющими ядерную локализацию (PCNA, Ki67, p53, p63, bcl-2), оценивали по системе подсчета histochemical score. Система подсчета включает в себя интенсивность иммуногистохимической окраски по 3-балльной шкале и долю (%) окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное окрашивание.
Формула подсчета следующая: histochemical score = ∑ P (i) х I,
где i – интенсивность окрашивания, выраженная в баллах от 0 до 3.
P (i) – процент клеток, окрашенных с разной интенсивностью. Максимальное значение гистосчета должно соответствовать 300.
Статистический анализ проводили с использованием пакета программ статистической обработки результатов SSPS 13.0 for Windows.
Результаты исследования
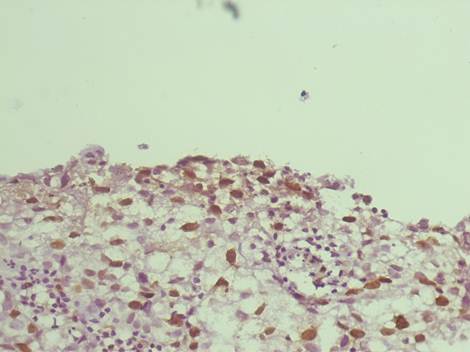
При анализе показателей экспрессии иммуногистохимических маркеров, имеющих ядерное окрашивание, необходимо выделить маркер пролиферации Ki67, который четко показал отрицательную экспрессию в группе сравнения и имел корреляционную зависимость высокой степени значимости между стадией рака мочевого пузыря, процентом экспрессирующих клеток и интенсивностью иммуногистохимической реакции. То есть, с увеличением глубины инвазии опухоли возрастал процент экспрессирующих клеток и степень их экспрессии. Учитывая это, мы считаем, что данный маркер может использоваться в качестве критерия на ранних этапах диагностики рака мочевого пузыря.

Рис. 1. Инвазивный уротелиальный рак. Умеренная и высокая экспрессия Кi-67 в ядрах уротелия
Равнозначные показатели получили при анализе экспрессии моноклонального антитела р53, являющегося белком-регулятором клеточного цикла и апоптоза. Отмечалось отсутствие окрашивания препаратов в группе сравнения, а интенсивность экспрессии и процент клеток с выраженной окраской имели четкую тенденцию к увеличению с возрастанием глубины инвазии опухоли. Раковые клетки с интенсивной иммуногистохимической реакцией маркера р53 появляются только в тех случаях, когда уротелиальная карцинома начинает прорастать в мышечный слой. Данные показатели позволяют использовать р53 как критерий прогноза заболевания, так и для определения глубины инвазии.
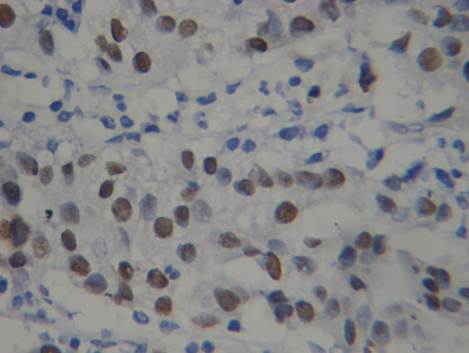
Рис. 2. Умеренная и выраженная экспрессия маркера Р53 в клетках инвазивной уротелиальной карциномы
Белок р63 также не дает экспрессии в группе сравнения. Однако достоверных различий частоты и интенсивности иммуногистохимической реакции в группах больных с различной стадией заболевания не выявлено.
При иммуногистохимической реакции на антигены, локализованные в цитоплазме, было установлено, что их экспрессия во всех исследованных группах больных является положительной. Достоверно значимых различий между группами больных по показателям иммуногистохимических реакций с цитокератинами (СК7, СК8, СК10/13, СК17, СК18, СК19) не установлено.
При исследовании полученных результатов иммуногистохимической реакции рецептора эпидермального фактора роста (EGFR) установлено, что его экспрессия отсутствует в группе сравнения и в группе больных с неинвазивными раками мочевого пузыря и нарастает с увеличением глубины инвазии. Таким образом, данное антитело не дает возможности на ранних этапах развития дифференцировать между собой доброкачественные процессы и злокачественные опухоли, поэтому данный маркер целесообразно использовать только для определения глубины инвазии опухоли.
Маркеры PCNA, Bcl2 не показали достоверной разницы в экспрессии ни в одной из изучаемых групп.
Выводы
Таким образом, проведенные исследования 13 моноклональных иммуногистохимических антител позволили разработать три основных направления в использовании данных маркеров:
- Для ранней и дифференциальной диагностики – определение маркеров Кi-67, р53, p63.
- Для глубины инвазии (стадирующая) – определение онкомаркера р53, рецептора эпидермального фактора роста (EGFR).
- Для прогноза заболевания – определение маркера пролиферативной активности Кi67.
Рецензенты:
- Федорина Т.А., д.м.н., профессор, зав. кафедрой общей и клинической патологии: патологической анатомии, патологической физиологии ГБОУ ВПО «СамГМУ» Минздравсоцразвития РФ. г. Самара.
- Бугоркова С.А., д.м.н., зав. лабораторией патоморфологии, ФКУЗ Российский научно-исследовательский противочумный институт «Микроб» Роспотребнадзора, г. Саратов.
Библиографическая ссылка
Цмокалюк Е.Н., Маслякова Г.Н. ИММУНОГИСТОХИМИЧЕСКИЕ МАРКЕРЫ В ДИАГНОСТИКЕ, СТАДИРОВАНИИ И ПРОГНОЗЕ РАЗЛИЧНЫХ ФОРМ УРОТЕЛИАЛЬНОЙ КАРЦИНОМЫ // Современные проблемы науки и образования. – 2011. – № 6.;
URL: https://science-education.ru/ru/article/view?id=4962 (дата обращения: 20.05.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Иммуногистохимия является дополнительным методом исследования, применяемым в патологической анатомии при диагностике доброкачественных и злокачественных новообразований, когда постановка диагноза по гистологическим препаратам не представляется возможной или требуется уточнение клинически важных молекулярных параметров опухоли.
Данная методика основана на выявлении в анализируемом образце ткани белков, специфичных для того или иного вида клеток, что позволяет отличать один вид опухоли от другого, а также выявлять маркеры, отвечающие за лекарственную чувствительность опухолевой ткани.
Зачем нужна иммуногистохимия, если уже сделано гистологическое исследование?
В ряде случаев проведения обычного гистологического исследования биопсии бывает недостаточно, что объясняется следующими причинами:
- опухоль имеет крайне неспецифичное микроскопическое строение, которое не позволяет поставить окончательный диагноз.
Например, диагноз практически всех лимфом и лейкозов (более 70 видов!) ставится после ИГХ исследования, а в части случаев дополнительно требуется молекулярно-генетическое исследование; в свою очередь, за гистологическим диагнозом «мелкокруглоклеточная опухоль» может скрываться до 13 различных злокачественных опухолей, каждая из которых имеет свой прогноз и требует индивидуального плана химиолучевого лечения – единственным методом, способным помочь врачу в дифференцировании этой группы опухолей, является ИГХ исследование.
Сроки выполнения ИГХ исследования
В соответствии с п.24 Приказа №179н от 24.03.2016 г. Минздрава России, срок выполнения ИГХ исследования:
- с использованием до 5 маркеров включительно – не более 7 рабочих дней,
- с использованием более 5 маркеров – не более 15 рабочих дней.
Возможности ИГХ исследования
1. Диагностика:
- окончательное (реже промежуточное) установление диагноза опухолевого процесса (различные варианты рака, саркомы мягких тканей, меланома, типирование лимфом и лейкозов),
- уточнение степени злокачественности опухоли (напр., нейроэндокринной опухоли), что будет определять прогноз заболевания,
- дифференциальная диагностика опухолей и неопухолевых процессов,
- определение органной принадлежности метастаза с неизвестной первичной локализацией (применимо не для всех опухолей!),
- дифференцирование множественных опухолевых процессов (наличие у пациента 2 и более разных опухолей).
2. Лекарственная чувствительность:
- рецепторы стероидных гормонов (рецепторы эстрогенов, рецепторы прогестерона, рецепторы андрогенов) – рак молочной железы, рак тела матки (эндометрия), другие опухоли;
- белок Her2/neu – рак молочной железы, рак желудка, рак мочевого пузыря;
- рецепторы соматостатина 2А и 5 типов – нейроэндокринные опухоли (карциноиды);
- PD-L1 – немелкоклеточный рак легкого, беспигментная меланома, другие опухоли;
- ALK – немелкоклеточный рак легкого;
- ROS1 – немелкоклеточный рак легкого;
- микросателлитная нестабильность (MSI) – рак толстой кишки, другие опухоли;
- индекс пролиферативной активности (Ki-67) – различные виды злокачественных опухолей.
Стоимость
Пациенты, не находящиеся на госпитализации в стационарах НМИЦ онкологии, могут узнать о стоимости ИГХ исследования в регистратуре патологоанатомического отделения (4 этаж, каб. №12).
Если у меня есть полис ОМС, должен ли я платить за иммуногистохимическое исследование?
Для всех пациентов, находящихся на госпитализации в стационарах НМИЦ онкологии и получающих медицинскую помощью по ОМС или ВМП (высокотехнологичная медицинская помощью), ИГХ исследование выполняется бесплатно. Необходимым условием выполнения бесплатного исследования является нахождение пациента на госпитализации в стационаре на момент оформления ИГХ.
Во всех остальных случаях ИГХ исследование выполняется за счет личных средств пациента.
За более подробной информацией рекомендуем обращаться в вашу страховую компанию.
Источник
Введение. Рак мочевого пузыря является самым частым новообразованием мочевыводящих путей. Ежегодно в мире раком мочевого пузыря заболевают 335,8 тыс. человек и 132,4 тыс. человек, то есть каждый третий умирает от этого заболевания. В 2011 году в Российской Федерации диагностировано 13784 случая РМП, при этом прирост этого заболевания за последние 10 лет составил 15,26%. Летальность от РМП на первом году с момента установления диагноза составляет 19,5% [1].
Сегодня в России под динамическим наблюдением находятся около 60 тысяч больных раком мочевого пузыря и только у 33,6% болезнь диагностируется на Т1 стадии заболевания [2]. Известно, что именно стадия рака мочевого пузыря определяет вид, характер лечения и прогноз заболевания для пациента. Вместе с тем частота ошибок, при определении стадии рака мочевого пузыря достигает 73% [3].
В настоящее время определение общепринятых критериев стадии рака мочевого пузыря: глубина инвазии опухоли, степень дифференцировки клеток, поражение регионарных лимфатических узлов и т.д., не всегда приводят к положительному результату лечения. Это подтверждают и данные анализа отдаленных результатов лечения больных с одной и той же диагностированной стадией раком мочевого пузыря. У одних пациентов после органосохраняющей операции наблюдается благоприятный исход, у других – быстро развивается рецидив и прогрессия опухоли. Это можно объяснить не изученным биологическим потенциалом рака мочевого пузыря [4]
Хорошо известно, что по клиническому течению выделяют поверхностный (Tis, Ta, T1), инвазивный (T2 -T4) и метастатический рак мочевого пузыря.
В Российской Федерации выявление больных с поверхностной формой рака (I стадия) составляет лишь 33,6%, в противоположность зарубежным данным, в соответствии с которыми I стадия рака мочевого пузыря диагностируется в 80% наблюдений. В нашей стране в 11,6-15,6% наблюдений выявляется IV стадия рака мочевого пузыря [5]
Эти цифры не внушают оптимизма и отражают неудовлетворительную диагностику поверхностного рака мочевого пузыря, позднюю обращаемость пациентов и неточное определение стадии заболевания и как следствие – неадекватность проводимого лечения – органоуносящие операции со снижением качества жизни больных и более высокая смертность.
Анализ результатов лечения больных раком мочевого пузыря показал, что назрела необходимость поиска новых дополнительных маркеров ранней диагностики, установления стадии и определении прогноза заболевания.
В клинических рекомендациях, выпущенных по инициативе Российского общества онкоурологов с разрешения Европейской ассоциации по урологии, в 2011 году сведения по применению конкретных молекулярных маркеров для диагностики рака мочевого пузыря отсутствуют. Нет их и в стандартах диагностики и лечения рака мочевого пузыря как в России, так и в Европе. Все вышесказанное позволило нам сформулировать цель нашего исследования.
Цель исследования: разработать панели молекулярно-биологических и иммуногистохимических маркеров для ранней диагностики, стадирования и прогрессирования рака мочевого пузыря.
Материал и методы. Исследование проводилось в несколько этапов. На первом этапе делали акцент на поиск маркеров для ранней диагностики РМП и в рамках федеральной целевой программы по борьбе с социально-значимыми исследованиями в 2008 году было начато исследование.
Проведено обследование 488 больного, находившихся на лечении в НИИ фундаментальной и клинической уронефрологии Саратовского государственного медицинского университета им. В.И.Разумовского с диагнозом рак мочевого пузыря: 443 человека – основная группа, группа контроля – 25 практически здоровых лиц, группа сравнения – 20 пациентов с циститом и мочекаменной болезнью.
Возраст пациентов с раком мочевого пузыря колебался от 44 до 79 лет (средний возраст – 63 года). В числе обследованных пациентов – 60 женщин и 383 мужчин. Из 443 пациентов с раком мочевого пузыря в группу с поверхностным раком (Та-1N0M0) – включены 217(48,9%) человек, мышечноинвазивным раком без метастазов(T2-4N0M0) – 188(42,4%) человек и с метастатическим раком было- 38(8,6%) больных.
При гистологическом исследовании у всех 443 больных диагностирован переходноклеточный рак. По степени дифференцировки опухоли больные были распределены следующим образом: 223(50%) больных с высокодифференцированной опухолью (G1), 174(39%) больных с умереннодифференцированной опухолью (G2), 60(11%) больных с низкодифференцированной опухолью (G3).
Исследование содержания онкомаркеров, цитокинов, факторов ангиогенеза проводили методом твердофазного иммуноферментного анализа. Определение онкомаркеров-фрагментов цитокератинов проводили в сыворотке крови и моче.
Содержание факторов роста эндотелия сосудов, трансформирующего фактора роста, фактора роста фибробластов определяли в сыворотке крови, маркеры апоптоза, интерлейкина-12, фактора некроза опухоли исследовали во взвеси мононуклеаров в плазме.
Иммуногистохимические реакции проводили на серийных парафиновых срезах, используя стрептавидин-биотиновый метод. Для иммуногистохимического исследования были использованы 13 коммерческих моноклональных антител, разделенные на группы по функциональной значимости: маркеры пролиферативной активности; супрессор опухолевого роста; маркеры апоптоза; рецептор эпидермального фактора роста; цитокератиновый профиль.
Интенсивность реакций, локализованных в цитоплазме, оценивали полуколичественным способом по 3-х балльной шкале.
Результаты реакций с антигенами, имеющими ядерную локализацию, оценивали в процентах, подсчитывая количество окрашенных ядер на 100 ядер в 3 полях зрения.
Статистический анализ проводили с использованием стандартного пакета программ статистической обработки результатов. Общая диагностическая эффективность количественных тестов определена с помощью ROC-анализа.
Результаты. Проведенные исследования на 13 иммуногистохимических и 11 молекулярно-генетических маркерах позволили выбрать наиболее информативные маркеры ранней диагностики рака мочевого: определение онкомаркера рака мочевого пузыря (UBC) в моче; фрагмента цитокератина ТРS в сыворотке крови и маркеров пролиферативной активности Кi67, Р63 и антигена пролиферирующего клеточного ядра в тканях опухоли методом иммуногистохимии.
Были установлены значения в разных группах: у практически здоровых лиц, с заболеваниями мочевого пузыря неопухолевой природы и РМП (табл. 1).
По нашим данным повышение маркера UBC в моче больше чем 50,1 мкг/л – это повод для детального обследования пациента. Резкое увеличение данного маркера в крови определяется при начале инвазии опухоли в мышечный слой.
При прорастании опухоли в сосуды, фрагменты этих же цитокератинов (ТРА и ТРS) появляются в кровотоке. Нарастание содержания этих маркеров в сыворотке крови коррелирует со степенью инвазии опухоли.
Из всех изучаемых маркеров роста наиболее значимым в диагностике рака мочевого пузыря оказался фактор роста эндотелия сосудов. Его резкое увеличение является неблагоприятным фактором прогноза рака. Изменение уровня факторов апоптоза (Fas и Fas-лиганда) можно использовать только в качестве прогностического фактора, так как их увеличение обусловлено процессом активного распада лимфоцитов, что неизбежно приведет к иммуносупресии и прогрессу опухолевого роста.
При анализе показателей экспрессии иммуногистохимических маркеров, имеющих ядерную локализацию, в различных группах больных с раком мочевого пузыря были получены следующие результаты:
Наиболее информативными были маркеры пролиферации (Ki67) и белки – регуляторы клеточного цикла (Р53 и Р63) , которые не дают экспрессии в группе сравнения. Кроме того, при применении маркеров Ki67и Р53 отмечена высокая степень корреляционной зависимости между стадией рака мочевого пузыря, процентом экспрессирующих клеток и интенсивностью иммуногистохимической реакции.
При иммуногистохимическом исследовании на антигены, локализованные в цитоплазме, было установлено, что их экспрессия во всех исследованных группах больных является положительной. Достоверно значимых различий между группами больных по показателям иммуногистохимических реакций с цитокератинами не выявлено.
И только цитокератин 18 продемонстрировал трехкратное увеличение количества экспрессирующих клеток уротелия между группой сравнения и группой больных с неинвазивным раком.
Таким образом, первый этап проведенных исследований на 13 иммуногистохимических и 11 молекулярно-биологических маркерах позволил установить следующие маркеры ранней диагностики: (UBC) в моче; фрагмента цитокератинов ТРS и TPA в сыворотке крови и маркеров пролиферативной активности Кi67, Р63 и антигена пролиферирующего клеточного ядра в тканях опухоли методом иммуногистохимии.
На втором этапе проведенных исследований была установлена связь изменений уровней цитокератинов TPA, TPS и UBC с признаками инвазии и стадией заболевания у больных РМП с различным уровнем инвазии опухоли (табл. 2).
Как видно из представленной таблица у больных с мышечно-инвазивным раком мочевого пузыря (Т2-Т4) характерны значения онкомаркера UBС выше чем 64,1 мкг/мл, ТРS >106,93 Ед/л и TPA> 1,89нг/мл. У больных с раком мочевого пузыря без мышечной инвазии показатели этих онкомаркеров – нижеуказанных величин.
При определении чувствительности и специфичности каждого маркера мы получили достаточно высокие показатели между этими показателями (табл.3).
Проведенный РОС – анализ показал статистически значимые различия между стадиями РМП по всем трем маркерам (табл. 4, рис. 1).
Далее нами был проведен сравнительный анализ ошибок в маркерной диагностике глубины инвазии опухоли на дооперационном этапе и в послеоперационном периоде с морфологическим исследованием (табл.5).
Было установлено, что при раке мочевого пузыря без мышечной инвазии наиболее целесообразно использовать уринальный онкомаркер UBC, так как у него высокая чувствительность (88%) в верификации и стадировании (82%) переходноклеточной карциномы и самая маленькая ошибка (16%). Не высокая чувствительность и точность в установлении стадии Та-Т1 с помощью TPA и TPS вполне объяснима, так как появление их в сыворотке крови происходит при прорастании опухоли в стенку сосуда, что происходит при инвазивном росте.
При мышечно-инвазивном РМП сохраняется высокая чувствительность UBC, а точность в определении стадии снижается, что может объясняться большим размерами опухоли и ее экзофитным ростом. В тоже время исследование сыворотки крови на TPA и TPS показывает значительное увеличение в точности стадирования и снижении величины ошибки.
Следует отметить, что для уточнения стадии РМП наиболее целесообразно применение одновременно всех трех онкомаркеров, так как это увеличивает чувствительность и специфичность применяемого метода, что подтверждается данными проведенного RОC-анализа.
Применение всех трех маркеров позволяет провести дифференциальную диагностику доброкачественного и злокачественного процессов, поверхностного и мышечно-инвазивного РМП, а также уменьшить количество диагностических ошибок в определении стадии, которая по данным некоторых авторов составляет 68-72% [6]. В клинике урологии и НИИ фундаментальной и клинической уронефрологии СГМУ до применения маркерной диагностики общая ошибка в определении стадии заболевания составляла 44, 25%, к 2012году она уменьшилась до 15,2%. В 2012 году на «Способ диагностики стадии инвазии рака мочевого пузыря» с применением данных маркеров был получен патент на изобретение.(№2454181 от 27.06.2012)
При иммуногистохимическом исследовании 12 онкомаркеров было установлено, что для диагностики стадии рака мочевого пузыря и прогноза заболевания рационально использовать только 4 маркера: Ki-67, p63, р53 и EGFR (табл.6).
Как видно из представленной таблицы, данные маркеры не дают положительной экспрессии в группе сравнения, что может использоваться при дифференциальной диагностике РМП и других неоплазий. Кроме этого процент экспрессирующих клеток указанных маркеров позволяет судить о степени инвазии РМП, что является важным моментом для определения стадии заболевания, а, следовательно, и прогноза.
При анализе показателей экспрессии маркеров в каждую из стадий РМП, представленной было установлено, что маркер Ki-67 показал 100% экспрессию у пациентов со стадией РМП Т3 и Т4, в то время как в стадию Т2 его экспрессия составила только 56,5%, что является достоверным различием (табл. 7).
Исследования показали: Ki-67 можно весьма перспективно использовать для дифференциальной диагностики между Т2 и Т3-Т4, что является очень важным, так как выход опухоли за пределы органа свидетельствует о неблагоприятном прогнозе и именно поэтому этот маркер может быть использован как прогностический, способный повлиять на выбор тактики лечения у больных МИРМП.
С целью определения прогностической значимости были изучены отдаленные результаты лечения 27 больных РМП, чью судьбу удалось проследить на протяжении 5 лет. У всех пациентов при иммуногистохимическом исследовании ткани опухоли Ki-67 дал положительную экспрессию.
Из 27 больных РМП 11 пациентам было выполнено органосохраняющее комплексное лечение, включающее в себя трансуретральную электрорезекцию стенки мочевого пузыря вместе с опухолью и системную полихимиотерапию по схеме M-VAC (метотрексат, винбластин, доксорубицин, цисплатин). У 13 больных произведена цистэктомия, а шесть пациентов признаны иноперабельными, им осуществлялась только симптоматическая терапия (табл.8).
Из представленной таблицы видно, что из 27 больных РМП – 16 (59,2%) умерло. Из них 10 (62,5%) – в первый год. Из 10 умерших в первый год 9 (90%) пациентов имели экспрессию Ki-67 ≥ 30%. У всех 9 больных стадия заболевания была Тзb-T4N0-1M0-1.
В то же время из 11 больных РМП, которые прожили более 5 лет, в 73% случаев экспрессия Ki-67 составила < 30%. Стадия заболевания у выживших больных была: Т1N0M0 – 4; Т2N0M0 – 6; Т3N0M0 – 1.
При мышечно-инвазивном РМП Т2N0M0-Т3-4N0-1M0-1 (22 больных) в первые 24 месяца умерли 14 (62%). Экспрессия Ki-67 у этих больных колебалась от 30 до 80%.
При органосохраняющем лечении больных в стадии Т1-Т2 (11 пациентов) в первые два года умерло 5 (45,4%) больных, у которых экспрессия Ki-67 составляла ≥ 30%. После цистэктомии (n=13) умерло 8 (61,5%), у 7 (87,5%) из них Ki-67 был > 30%. Из 11 пациентов, проживших 5 лет и более, только в двух случаях Ki-67 было > 30% (34% и 44%), у остальных 9 (82%) – Ki-67 был менее 30%.
Проведенная сравнительная оценка эффективности различных иммуногистохимических маркеров в определении стадии и прогнозе мышечно-инвазивного РМП показала, что наиболее эффективным маркером является маркер пролиферативной активности – Ki-67. Установлено, что при экспрессии Ki-67 > 30%, независимо от способа лечения, в 81,2% возможен рецидив заболевания и летальный исход в течение 24 месяцев. В то же время при значениях Ki-67 < 30% пятилетняя выживаемость составляет 70%.
Таким образом, научно-исследовательская работа, проводимая и НИИ фундаментальной и клинической уронефрологии более 6 лет, и являющаяся отражением интеграции клинической урологии, лабораторной диагностики и морфологии позволила вывить наиболее значимые маркеры в ранней диагностике, определении стадии и прогноза рака мочевого пузыря.
Выводы
- Для раннего выявления рака мочевого пузыря, а также проведения дифференциальной диагностики между доброкачественным и злокачественным процессом, целесообразно определение онкомаркера рака мочевого пузыря (UBC) в моче; фрагментов цитокератинов ТРS,ТРА в сыворотке крови и маркеров пролиферативной активности Кi67, Р63 и антигена пролиферирующего клеточного ядра в тканях опухоли методом иммуногистохимии. Применение данных маркеров в НИИ фундаментальной и клинической уронефрологии СГМУ позволило повысить выявление рака мочевого пузыря на 1стадии с 18,1% в 2006 г. до 48,9% в 2011 г. и увеличить число органосохраняющих операций за этот же период времени с 57% до 82%
- Включение онкомаркеров UBC, TPA и TPS в комплексную диагностику и стадирование рака мочевого пузыря позволяет провести дифференциальную диагностику доброкачественного и злокачественного процессов, поверхностного и мышечно-инвазивного РМП и снизить частоту диагностических ошибок с 44,2% до 15,2%.
- Маркер пролиферативной активности Ki-67 может быть использован в качестве вспомогательного маркера при выборе объема оперативного лечения (органосохраняющая операция или цистэктомия). Кроме того независимо от способа лечения в 81,2% случаев Ki-67 может предсказать неблагоприятный исход заболевания в течение 24 месяцев.
- Применение молекулярно-биологических и иммуногисто-химических маркеров в диагностике рака мочевого пузыря позволило за последние пять лет увеличить объем радикальных операций с 78% до 92,1% и уменьшить летальность у данной категории больных в первые 2 года после проведенного лечения с 32% до 15,9%
Источник
