Гиперактивность мочевого пузыря у детей причины и лечение
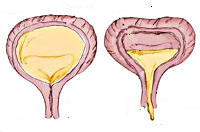
Нейрогенный мочевой пузырь у детей – функциональные расстройства наполнения и опорожнения мочевого пузыря, связанные с нарушением механизмов нервной регуляции. Нейрогенный мочевой пузырь у детей может проявляться неконтролируемыми, учащенными или редкими мочеиспусканиями, ургентными позывами, недержанием или задержкой мочи, инфекциями мочевых путей. Диагноз нейрогенного мочевого пузыря у детей ставится по данным лабораторных, ультразвуковых, рентгенологических, эндоскопических, радиоизотопных и уродинамических исследований. Нейрогенный мочевой пузырь у детей требует комплексного лечения, включающего медикаментозную терапию, физиопроцедуры, ЛФК, хирургическую коррекцию.
Общие сведения
Нейрогенный мочевой пузырь у детей – резервуарная и эвакуаторная дисфункция мочевого пузыря, обусловленная нарушением нервной регуляции мочеиспускания на центральном или периферическом уровне. Актуальность проблемы нейрогенного мочевого пузыря в педиатрии и детской урологии обусловлена высокой распространенностью заболевания в детском возрасте (около 10%) и риском развития вторичных изменений мочевыводящих органов.
Зрелый, полностью контролируемый днем и ночью, режим мочеиспускания формируется у ребенка к 3-4 годам, прогрессируя от безусловного спинального рефлекса до сложного произвольно-рефлекторного акта. В его регуляции принимают участие кортикальные и субкортикальные центры головного мозга, центры спинальной иннервации пояснично-крестцового отдела спинного мозга, периферические нервные сплетения. Нарушение иннервации при нейрогенном мочевом пузыре у детей сопровождается расстройствами его резервуарно-эвакуаторной функции и может стать причиной развития пузырно-мочеточникового рефлюкса, мегауретера, гидронефроза, цистита, пиелонефрита, хронической почечной недостаточности. Нейрогенный мочевой пузырь значительно снижает качество жизни, формирует физический и психологический дискомфорт и социальную дезадаптацию ребенка.

Нейрогенный мочевой пузырь у детей
Причины нейрогенного мочевого пузыря у детей
В основе нейрогенного мочевого пузыря у детей лежат неврологические нарушения разного уровня, приводящие к недостаточной координации активности детрузора и/или наружного сфинктера мочевого пузыря при накоплении и выделении мочи.
Нейрогенный мочевой пузырь у детей может развиваться при органическом поражении ЦНС вследствие врожденных пороков (миелодисплазии), травм, опухолевых и воспалительно-дегенеративных заболеваний позвоночника, головного и спинного мозга (родовой травме, ДЦП, спинномозговой грыже, агенезии и дисгенезии крестца и копчика и др.), приводящих к частичному или полному разобщению супраспинальных и спинальных нервных центров с мочевым пузырем.
Нейрогенный мочевой пузырь у детей может быть обусловлен неустойчивостью и функциональной слабостью сформировавшегося рефлекса управляемого мочеиспускания, а также нарушением его нейрогуморальной регуляции, связанным с гипоталамо-гипофизарной недостаточностью, задержкой созревания микционных центров, дисфункцией вегетативной нервной системы, изменением чувствительности рецепторов и растяжимости мышечной стенки мочевого пузыря. Основное значение имеет характер, уровень и степень поражения нервной системы.
Нейрогенный мочевой пузырь чаще встречается у девочек, что связано с более высокой эстрогенной насыщенностью, повышающей чувствительность рецепторов детрузора.
Классификация нейрогенного мочевого пузыря у детей
По изменению пузырного рефлекса различают гиперрефлекторный мочевой пузырь (спастическое состояние детрузора в фазу накопления), норморефлекторный и гипорефлекторный (гипотония детрузора в фазу выделения). В случае гипорефлексии детрузора рефлекс на мочеиспускание возникает при функциональном объеме мочевого пузыря, значительно превышающем возрастную норму, в случае гиперрефлексии – задолго до накопления нормального возрастного объема мочи. Наиболее тяжелой является арефлекторная форма нейрогенного мочевого пузыря у детей с невозможностью самостоятельного сокращения полного и переполненного мочевого пузыря и непроизвольным мочеиспусканием.
По приспособленности детрузора к нарастающему объему мочи нейрогенный мочевой пузырь у детей может быть адаптированный и неадаптированный (незаторможенный).
Нейрогенная дисфункция мочевого пузыря у детей может протекать в легких формах (синдром дневного частого мочеиспускания, энурез, стрессовое недержание мочи); среднетяжелых (синдром ленивого мочевого пузыря и нестабильного мочевого пузыря); тяжелых (синдром Хинмана – детрузорно-сфинктерная диссенергия, синдром Очоа – урофациальный синдром).
Симптомы нейрогенного мочевого пузыря у детей
Нейрогенный мочевой пузырь у детей характеризуется различными расстройствами акта мочеиспускания, тяжесть и частота проявлений которого определяется уровнем поражения нервной системы.
При нейрогенной гиперактивности мочевого пузыря, преобладающей у детей раннего возраста, отмечаются учащенные (> 8 раз/сутки) мочеиспускания малыми порциями, ургентные (императивные) позывы, недержание мочи, энурез.
Постуральный нейрогенный мочевой пузырь у детей проявляется только при переходе тела из горизонтального положения в вертикальное и характеризуется дневной поллакиурией, ненарушенным ночным накоплением мочи с нормальным объемом ее утренней порции.
Стрессовое недержание мочи у девочек пубертатного возраста может возникать при физической нагрузке в виде упускания небольших порций мочи. Для детрузорно-сфинктерной диссинергии характерны полная задержка мочеиспускания, микции при натуживании, неполное опорожнение мочевого пузыря.
Нейрогенная гипотония мочевого пузыря у детей проявляется отсутствующими или редкими (до 3-х раз) мочеиспусканиями при полном и переполненном (до 1500 мл) мочевом пузыре, вялым мочеиспусканием с напряжением брюшной стенки, ощущением неполного опорожнения из-за большого объема (до 400 мл) остаточной мочи. Возможна парадоксальная ишурия с неконтролируемым выделением мочи вследствие зияния наружного сфинктера, растянутого под давлением переполненного мочевого пузыря. При ленивом мочевом пузыре редкие мочеиспускания сочетаются с недержанием мочи, запорами, инфекциями мочевыводящих путей (ИМП).
Нейрогенная гипотония мочевого пузыря у детей предрасполагает к развитию хронического воспаления мочевых путей, нарушению почечного кровотока, рубцеванию почечной паренхимы и формированию вторичного сморщивания почки, нефросклероза и ХПН.
Диагностика нейрогенного мочевого пузыря у детей
При наличии расстройств мочеиспускания у ребенка необходимо проведение комплексного обследования с участием педиатра, детского уролога, детского нефролога, детского невролога и детского психолога.
Диагностика нейрогенного мочевого пузыря у детей включает сбор анамнеза (семейная отягощенность, травмы, патология нервной системы и др.), оценку результатов лабораторных и инструментальных методов исследования мочевой и нервной системы.
Для выявления ИМП и функциональных нарушений со стороны почек при нейрогенном мочевом пузыре у детей выполняют общий и биохимический анализ мочи и крови, пробу Зимницкого, Нечипоренко, бактериологическое исследование мочи.
Урологическое обследование при нейрогенном мочевом пузыре включают УЗИ почек и мочевого пузыря ребенку (с определением остаточной мочи); рентгенологическое исследование (микционную цистографию, обзорную и экскреторную урографию); КТ и МРТ почек; эндоскопию (уретроскопию, цистоскопию), радиоизотопное сканирование почек (сцинтиграфию).
Для оценки состояния мочевого пузыря у ребенка отслеживают суточный ритм (количество, время) и объем спонтанных мочеиспусканий при нормальном питьевом и температурном режиме. Высокую диагностическую значимость при нейрогенном мочевом пузыре у детей имеют уродинамическое исследование функционального состояния нижних мочевых путей: урофлоуметрия, измерение внутрипузырного давления при естественном заполнении мочевого пузыря, ретроградная цистометрия, профилометрия уретры и электромиография.
При подозрении на патологию ЦНС показано проведение ЭЭГ и Эхо-ЭГ, рентгенографии черепа и позвоночника, МРТ головного мозга ребенку.
Лечение нейрогенного мочевого пузыря у детей
В зависимости от типа, тяжести нарушений и сопутствующих заболеваний при нейрогенном мочевом пузыре у детей используют дифференцированную лечебную тактику, включающую немедикаментозную и медикаментозную терапию, хирургическое вмешательство. Показано соблюдение охранительного режима (дополнительный сон, прогулки на свежем воздухе, исключение психотравмирующих ситуаций), прохождение курсов ЛФК, физиотерапии (лекарственного электрофореза, магнитотерапии, электростимуляции мочевого пузыря, ультразвука) и психотерапии.
При гипертонусе детрузора назначают М-холиноблокаторы (атропин, детям старше 5 лет – оксибутинин), трициклические антидепрессанты (имипрамин), антагонисты Ca+ (теродилин, нифедипин), фитопрепараты (валерианы, пустырника), ноотропы (гопантеновая кислота, пикамилон). Для лечения нейрогенного мочевого пузыря с ночным энурезом у детей старше 5 лет применяют аналог антидиуретического гормона нейрогипофиза – десмопрессин.
При гипотонии мочевого пузыря рекомендованы принудительные мочеиспускания по графику (каждые 2-3 часа), периодические катетеризации, прием холиномиметиков (ацеклидин), антихолинэстеразных средств ( дистигмин), адаптогенов (элеутерококк, лимонник), глицина, лечебные ванны с морской солью.
В целях профилактики ИМП у детей с нейрогенной гипотонией мочевого пузыря назначают уросептики в малых дозах: нитрофураны (фуразидин), оксихинолоны (нитроксолин), фторхинолоны (налидиксовая кислота), иммунокорригирующую терапию (левамизол), фитосборы.
При нейрогенном мочевом пузыре у детей выполняют внутридетрузорные и внутриуретральные инъекции ботулотоксина, эндоскопические хирургические вмешательства (трансуретральную резекцию шейки мочевого пузыря, имплантацию коллагена в устье мочеточника, операции на нервных ганглиях, ответственных за мочеиспускание), проводят увеличение объема мочевого пузыря с помощью кишечной цистопластики.
Прогноз и профилактика нейрогенного мочевого пузыря у детей
При правильной лечебной и поведенческой тактике прогноз нейрогенного мочевого пузыря у детей наиболее благоприятен в случае гиперактивности детрузора. Наличие остаточной мочи при нейрогенном мочевом пузыре у детей увеличивает риск развития ИМП и функциональных нарушений почек, вплоть до ХПН.
Для профилактики осложнений важно раннее выявление и своевременное лечение нейрогенной дисфункции мочевого пузыря у детей. Детям с нейрогенным мочевым пузырем необходимо диспансерное наблюдение и периодическое исследование уродинамики.
Источник
Среди всех нарушений мочеиспускания у детей значительное место занимает гиперактивный мочевой пузырь (ГАМП). Термин «гиперактивный мочевой пузырь», введенный Международным обществом по проблеме недержания мочи (International Continence Society, ICS), в детской урологии применяется с 2004 г. [1, 2]. Согласно ICS, руководству Европейской ассоциации урологов (European Association of Urology, EAU), руководству Немецкого общества детской и подростковой психиатрии, психотерапии и психосоматики (Deutsche Gesellschaft für Kinder und Jugendpsychiatrie, Psychosomatik und Psychotherapie, DGKJP), основными клиническими признаками ГАМП являются поллакиурия, императивные позывы к мочеиспусканию, императивное недержание мочи различной степени выраженности и энурез. Гиперактивный мочевой пузырь у детей характеризуется большим полиморфизмом клинических симптомов и их выраженности в силу возрастных особенностей темпов созревания симпатического и парасимпатического отделов вегетативной нервной системы (ВНС), нестабильности метаболизма головного мозга, а также присущей детскому организму склонности к развитию генерализованных реакций в ответ на локальное раздражение [3].
Формирование ГАМП обусловлено патологией гипоталамо-гипофизарной системы, сопровождающейся задержкой созревания нервно-гуморальной регуляции акта мочеиспускания, ишемией детрузора и нарушением биоэнергетики [4]. ВНС принадлежит важное, если не решающее, значение в поддержании гомеостаза, т. е. постоянства внутренней среды организма [5]. При нарушении регулирующего влияния ВНС развиваются не только расстройства мочеиспускания, но и сочетанные нарушения висцеральных органов [6]. Тем не менее, существует проблема всеобщей недооценки роли вегетативной дезадаптации в формировании здоровья детей. Сегодня для практикующего врача любые отклонения со стороны ВНС, как правило, расцениваются как патологические с неизменным диагнозом «синдром вегетативной дистонии (вегетососудистая дистония, СВД)», назначением медикаментозной терапии, освобождением от физических нагрузок и направлением к врачам-специалистам по принадлежности – кардиологу, невропатологу, гастроэнтерологу, нефрологу, урологу. В то же время те или иные признаки вегетативной нестабильности имеют довольно широкий диапазон интерпретации, обусловленный облигатностью факторов-стрессоров, толерантностью к ним компенсаторно-приспособительного аппарата, наследуемым типом реагирования, тренирующим свойством условий жизни. И если в настоящее время осознается роль средовых факторов, то закономерности и динамика трансформации приспособительно-компенсаторных реакций в ответ на их воздействие остаются за пределами внимания врача [7]. Несмотря на то, что как таковой нозологической единицы СВД не существует, на отдельных территориях России объем диагноза «синдром вегетативной дистонии» составляет 20-30% от всего объема зарегистрированных данных о заболеваемости, при этом он кодируется врачами и статистиками амбулаторно-поликлинических учреждений как соматический диагноз [8].
Давно известным является влияние психических процессов на функции мочевыводящей системы. При воздействии нервного напряжения, помимо прочего, изменяется тонус сосудов, вследствие чего ухудшается кровоснабжение почек, мочевого пузыря, что обусловливает изменение состава крови и мочи, оказывая воздействие на весь организм. Повышение тонуса означает также повышенную возбудимость сенсоров в стенке мочевого пузыря и вместе с этим сниженный порог возбуждения [9, 10]. Неоценима роль микросоциального окружения ребенка в формировании его здоровья. Доказано, что если число событий, приводящих к серьезным изменениям в жизни индивида, возрастает более чем в два раза по сравнению со средним числом, то вероятность заболевания составит 80%. У ребенка настолько тесная связь с родителями, что практически все важные изменения в их жизни ставят ребенка на грань риска возникновения заболевания. Состояние ребенка может оказаться показателем отношений его родителей, болезненные проявления у ребенка могут быть единственным выражением семейной дезорганизации (M. Basquen, 1983). Все изменения семейных взаимоотношений, препятствующие развитию индивидуальности ребенка, не позволяющие ему открыто проявлять свои эмоции, делают его ранимым в отношении эмоциональных стрессов (H. Jaklewicz, 1988). В то же время наличие прочной социальной поддержки благоприятно сказывается на сопротивляемости к заболеваниям. Нарушенные внутрисемейные контакты в раннем возрасте, особенно между матерью и ребенком, в дальнейшем увеличивают риск развития психосоматических заболеваний (G. Ammon, 1978).
В этой мультифакторной модели синдрома гиперактивного мочевого пузыря психологические факторы могут выступать как провоцирующие и определяющие тактику терапевтических мероприятий.
Клинический случай
Первый визит 15.12.2015 г.
Больной К., 14 лет, обратился с жалобами на учащенные мочеиспускания малыми порциями, императивные позывы. Длительность заболевания до момента обращения за медицинской помощью – около трех месяцев. Из сопутствующих жалоб выявлены головные боли, утомляемость, раздражительность, нарушения сна. До посещения уролога к другим специалистам не обращался, не лечился.
Anamnesis morbi: первые симптомы расстройства мочеиспускания появились в конце сентября 2015 г., после начала обучения в новой школе. Ни мама, ни ребенок не связывали начало заболевания с каким-либо фактором. После наводящих вопросов подросток расплакался и рассказал о том, что в школе «его все достали», что имеется конфликт со сверстниками в виде несоответствия поведения подростка требованиям одноклассников и педагогов. Поллакиурия и императивные позывы отмечались только в дневное время, как правило, в школе. Обследован по месту жительства – общий анализ мочи, проба Нечипоренко – без патологии. УЗИ почек и мочевого пузыря до и после микции – эхографически структурных изменений не выявлено, уродинамика не нарушена, остаточной мочи нет. Анализ амбулаторной карты патологии анализов мочи на протяжении жизни не выявил.
Anamnesis vitae: от 2-й беременности (первая – выкидыш), протекавшей на фоне угрозы прерывания, фетоплацентарной недостаточности (ФПН), хронической внутриутробной гипоксии плода (ХВГП). Роды первые, путем кесарева сечения, вес 2950 г, 50 см, оценка по Апгар 7-8 баллов. Грудное вскармливание до трех месяцев, в последующем – искусственное. Первые три года жизни ребенка травм, операций не было, но зарегистрированы госпитализации в стационар по поводу обструктивного синдрома.
Семейный анамнез: семья полная, ребенок в семье единственный. Отец часто в длительных командировках, эмоциональной близости с ребенком не имеет. Мама робкая, во время приема постоянно извиняется, на лице и шее яркая пятнистая гиперемия. Первые 6 лет жизни ребенка в семье были ссоры, скандалы.
Перенесенные заболевания: перинатальная энцефалопатия, частые ацетонемические состояния, обструктивный бронхит.
Наследственность: по заболеванию почек не отягощена. У отца – язвенная болезнь желудка, у мамы нестабильное артериальное давление.
Объективный осмотр: обращает на себя внимание поза ребенка – скрещенные руки и ноги, опущенная голова, скованность, а также гипергидроз кистей рук, нарушение осанки. По органам мочеполовой сферы патологии не выявлено. Область спины, крестца и копчика визуально не изменены. Бульбокавернозный рефлекс сохранен. Стул со склонностью к запорам.
Комплексное обследование включало в себя общие для матери и ребенка методы: оценку жалоб, структурированный сбор анамнеза, выявление симптомов вегетативной дисфункции с применением вопросника А. М. Вейна (1998), клиническую оценку состояния нижних мочевых путей (дневник спонтанных мочеиспусканий, оценка синдрома императивного мочеиспускания с помощью квалиметрических таблиц Е. Л. Вишневского, 2001). Ребенку проведено уродинамическое исследование – урофлоуметрия (UROCAP, Канада) и кардиоинтервалография (КИГ). Дополнительно у матери использовалась Международная шкала для выявления симптомов нижних мочевых путей (IPSS), включающая оценку качества жизни в связи с симптомами дисфункции нижних мочевых путей (QOL).
Результаты обследования: по результатам вопросника А. М. Вейна у ребенка и матери выявлены вегетативные расстройства выраженной степени (35 и 56 баллов соответственно, при норме до 15 баллов), исходный вегетативный статус обоих характеризовался симпатикотонией. Кардиоинтервалография и клиноортостатическая проба (КОП) ребенка показали тяжелый вариант дезадаптации вегетативной регуляции (исходный вегетативный тонус (ВТ) – симпатикотония, вегетативная реактивность (ВР) – гиперсимпатикотония, КОП – сниженная реакция на ортостаз). По клинической оценке мочеиспускания – мочеиспускание ребенка 6-8-15 раз в сутки, свободное, безболезненное, напряженной струей, с чувством полного опорожнения мочевого пузыря. Среднеэффективный объем мочевого пузыря 100 мл, максимальный 350 мл (утром). Императивные позывы каждый день, 2-3 раза в день, периодически – ложные позывы к мочеиспусканию. Днем и ночью мочу удерживает. Расстройства мочеиспускания провоцируются и усугубляются психоэмоциональным напряжением. Тестирование с помощью таблицы показало, что у ребенка имеет место синдром императивного мочеиспускания, обусловленный гиперрефлекторной дисфункцией мочевого пузыря. Суммарный балл расстройств мочеиспускания – 13 (средняя степень). Урофлоуметрия – стремительное мочеиспускание.
Результат оценки нижних мочевых путей матери: расстройства мочеиспускания в виде симптомов нижних мочевых путей средней степени тяжести. Индекс качества жизни (QOL) мать оценивала как «в общем, неудовлетворительно». У матери зарегистрированы на протяжении жизни признаки цистита.
Несмотря на то, что результаты обследования свидетельствовали о явном соматизированном проявлении психовегетативного синдрома, ребенку установлен диагноз «гиперактивный мочевой пузырь с рубрикой МКБ-10 N31.1 – Рефлекторный мочевой пузырь, не классифицированный в других рубриках», так как в силу своей специальности мы не можем использовать классификационные коды психопатологии.
С учетом полученных результатов исследований, дисфункционального характера семейных взаимоотношений, идентичности вегетативного реагирования дезадаптивного характера и расстройств мочеиспускания матери и ребенка был назначен комплекс лечебных мероприятий в паре «Мать и дитя». Общими были рекомендации: режим труда и отдыха, регулярная общеразвивающая физическая нагрузка, лечебная физкультура, фитнес (маме), индивидуальная и семейная психотерапия, направленная на выработку совладающего поведения и повышение стрессоустойчивости. Ребенку рекомендовано 10 процедур транскраниальной магнитотерапии бегущим магнитным полем (аппарат «Амус-01-Интрамаг» и приставка к нему «Оголовье»). Транскраниальная магнитотерапия бегущим магнитным полем обладает ноотропным, мнемоторным, вазовегетативным, адаптогенным, а также седативным и антидепрессивным действием [11].
Матери и ребенку назначили медикаментозную терапию: препарат Тенотен детский по 1 таблетке 3 раза в день ребенку, маме – Тенотен по 1 таблетке 2 раза в день (до 4 приемов в сутки при необходимости), курсом 3 месяца. Препарат Тенотен относится к фармакологической группе анксиолитиков, ноотропов. Препарат создан на основе релиз-активных антител к мозгоспецифическому белку S-100. Тенотен и Тенотен детский оказывают успокаивающее, противотревожное (анксиолитическое) действие, не вызывая нежелательного гипногенного и миорелаксантного эффекта. Улучшает переносимость психоэмоциональных нагрузок. Ингибирует процессы перекисного окисления липидов.
С лечебно-профилактической целью для предупреждения вторичных осложнений ГАМП в виде инфекции мочевых путей рекомендован растительный препарат Канефрон Н – по 2 недели в месяц на протяжении трех месяцев. Дозировка для ребенка – по 25 капель 3 раза в день, маме – по 50 капель или 2 таблетки 3 раза в день. Фармакологические свойства составляющих Канефрона Н (золототысячник, любисток, розмарин) обеспечивают его многогранное и разнонаправленное действие (диуретическое, противовоспалительное, спазмолитическое, антимикробное, вазодилаторное, нефропротекторное). Препарат может применяться как в качестве монотерапии при неосложненных инфекциях нижних мочевых путей, так и в составе комплексной длительной противорецидивной терапии пиелонефрита, пузырно-мочеточникового рефлюкса, обменных нефропатий и нейрогенных дисфункций мочевого пузыря.
Следующий визит был запланирован через 3 месяца, по необходимости – раньше.
Второй визит 21.03.2016 г.
Мама подростка отметила улучшение в виде уменьшения конфликтных ситуаций в семье и школе, значительное урежение и снижение выраженности расстройств мочеиспускания в виде поллакиурии, императивных позывов. Исследование вегетативной нервной системы матери и ребенка показало значительное снижение выраженности симпатикотонии, повышение показателей адаптивных характеристик. По данным клинической оценки мочеиспускания и урофлоуметрии ребенка отмечено улучшение адаптации детрузора мочевого пузыря в 2 раза. Тем не менее, значимые для ребенка стрессовые ситуации провоцировали ургентность мочеиспускания. Анализы мочи матери и ребенка в динамике без патологии. Физикальное обследование пациента патологии мочеполовой сферы не выявило. Оценка нижних мочевых путей матери показала расстройства мочеиспускания в виде симптомов нижних мочевых путей легкой степени тяжести. Индекс качества жизни (QOL) мать оценивала уже как «удовлетворительно». У матери за истекшее время явлений цистита не зарегистрировано.
С учетом сохраняющейся клиники расстройств мочеиспусканий и наличия резидуального фона ребенка терапия была продолжена препаратом Пантогам и биологически-активной добавкой Элькар. Пантогам и Элькар эффективно применяются в лечении детей с гиперактивным мочевым пузырем [11-13]. Пантогам – естественный метаболит гамма-аминомасляной кислоты (ГАМК) в нервной ткани. Его фармакологические эффекты обусловлены прямым влиянием на ГАМК-рецепторно-канальный комплекс, оказывающий также активирующее влияние на образование ацетилхолина. Сочетание мягкого психостимулирующего и умеренного седативного эффекта улучшает интегративные функции у детей, снижает волнение и тревожность, нормализует сон, способствует полноценному отдыху. У детей с нарушениями мочеиспускания положительный эффект обусловлен вегетотропной активностью препарата, его транквилизирующим действием, способностью повышать контроль подкорковых областей, стимулировать корковую деятельность и формировать условно-рефлекторные связи. Пантогам также действует непосредственно на функцию сфинктера, влияя на ГАМК-рецепторы, расположенные в том числе и в мочевом пузыре. Пантогам был рекомендован ребенку в дозировке 0,5 × 3 раза в день, курсом 2 мес.
Элькар (L-карнитин) – природная субстанция, производимая организмом, имеющая смешанную структуру деривата аминокислоты, родственная витаминам группы В. Карнитин прямо или косвенно участвует в метаболизме жирных кислот, глюкозы, кетоновых тел и аминокислот, способствуя процессу энергообразования. Средство в виде 30% раствора было рекомендовано в дозировке 30 мг/кг/сут в 2 приема за 30 минут до еды, продолжительностью 2 месяца. Повторный осмотр назначен через 3 месяца, при необходимости – раньше.
Третий визит 21.06.2016 г.
Мама сообщила об отсутствии расстройств мочеиспускания у себя и ребенка даже после окончания лечения. Значительно улучшились отношения со сверстниками и гармонизировались семейные взаимоотношения за счет обучения методам конструктивного разрешения конфликтов и способам совладающего поведения матери и ребенка. Проведенный комплекс обследования не выявил отклонений в функции мочевого пузыря и состоянии вегетативной нервной системы.
Обсуждение
Доминирующей тенденцией в обычной терапии гиперактивного мочевого пузыря служит пероральное применение М-холинолитиков (Дриптан). У некоторых пациентов такая терапия может быть эффективной, однако при ее прерывании заболевание рецидивирует, к тому же известно о множестве побочных эффектов такого лечения. В педиатрической практике нередко недооценивается роль психологических стрессовых факторов и симптомов вегетативной дисфункции в развитии соматического заболевания, что влечет за собой необоснованные инструментальные исследования и неадекватную медикаментозную терапию. При наличии стресс-индуцированного соматизированного расстройства мочеиспускания инструментальные исследования (уродинамические, рентгенологические) могут усугубить адаптационно-регуляторный дисбаланс и клинические проявления расстройств мочеиспускания. У больных с синдромом ГАМП на фоне вегетативной дезадаптации, истощения приспособительно-компенсаторных реакций в условиях социально-средовой агрессии (в случаях, аналогичных описанному) обсуждаемую терапию целесообразно проводить в паре «Мать и дитя». Обычно это дает отличный результат, позволяя довольно быстро и стойко купировать симптомы заболевания, стимулировать реакцию саногенеза и избежать применения М-холинолитиков.
Литература
- Морозов С. Л., Гусева Н. Б., Длин В. В. Перспектива энерготропной терапии нейрогенной дисфункции мочевого пузыря // Российский вестник перинатологии и педиатрии. 2013. Т. 58. № 5. С. 35-38.
- Raes A., Hoebeke P., Segaert I. et al. Retrospective analysis of efficacy and tolerability of tolterodine in children with overactive bladder // Eur. Urol. 2004. Vol. 45. № 2. P. 240-244.
- Белобородова Н. В., Попов Д. А., Вострикова Т. Ю., Павлов А. Ю., Ромих В. В., Москалева Н. Г. Дисфункции мочевых путей у детей: некоторые вопросы диагностики и пути эффективной терапии // Педиатрия. 2007. Т. 86. № 5. С. 51-54.
- Джавад-Заде М. Д., Державин В. М., Вишневский Е. Л. Нейрогенные дисфункции мочевого пузыря / Под ред. М. Д. Джавад-Заде, В. М. Державина; АМН СССР. М.: Медицина, 1989. 382 с.
- Вейн А. М. Вегетативные расстройства. М., 2000. 749 с.
- Морозов В. И. Сочетанные дисфункции висцеральных органов у детей с нейрогенной дисфункцией мочевого пузыря // Педиатрия. 2007. Т. 86. № 6. С. 35-40.
- Кушнир С. М., Антонова Л. К. Вегетативная дисфункция и вегетативная дистония. Тверь, 2007. 215 с.
- Акарачкова Е. С. К вопросу диагностики и лечения психовегетативных расстройств в общесоматической практике // Лечащий Врач. 2010. № 10.
- Исаев Д. Н. Психосоматические расстройства у детей. Руководство для врачей. Спб: Питер, 2000. 507 с.
- Пезешкиан Н. Психосоматика и позитивная психотерапия. М.: Медицина, 1996. С. 33-439.
- Отпущенникова Т. В., Казанская И. В. Современные методы лечения энуреза у детей // Лечащий Врач. 2009. № 9. С. 47-51.
- Длин В. В., Морозов С. Л., Гусева Н. Б., Шабельникова Е. И. Патогенетическое обоснование применения ноотропных препаратов у детей с гиперактивным мочевым пузырем // Эффективная фармакотерапия. 2014. № 2. С. 6-10.
- Длин В. В., Гусева Н. Б., Морозов С. Л. Гиперактивный мочевой пузырь. Перспективы энерготропной терапии // Эффективная фармакотерапия. 2013. № 42. С. 32-37.
Т. В. Отпущенникова, кандидат медицинских наук
ФГБОУ ВО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
Контактная информация: tkatina1@yandex.ru
Источник
