Гетеротопический мочевой пузырь это

Опухоль мочевого пузыря – новообразование, которое возникает в полости или на стенке органа. Болезнь может протекать как с яркими симптомами, так и без особых признаков, что часто приводит к поздней диагностике. По основной классификации опухоли бывают доброкачественными и злокачественными. Именно тип образования, его размеры и место определяют схему лечения опухоли мочевого пузыря и прогноз выздоровления.
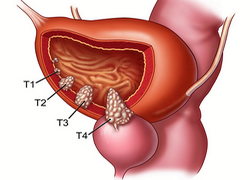
Причины появления опухоли
Механизм развития опухолей заключается в активном делении клеток. Такие процессы могут быть запущены разными факторами, которые провоцируют мутацию генетического клеточного материала. В случае с мочевым пузырем особенно опасны курение, неблагоприятная экология и работа, связанная с химическими веществами. Эти факторы могут вызывать разные виды опухолей мочевого пузыря:
- Доброкачественные: полипы, папилломы, миомы, гемангиомы, фибромы.
- Злокачественные: солидный, переходноклеточный, папиллярный и плоскоклеточный рак, аденокарцинома, а также поверхностный (неинвазивный) и инвазивный рак.
Доброкачественные опухоли часто диагностируются у рабочих, занятых в лакокрасочной, бумажной, химической и резиновой промышленности. Провоцировать заболевание может застой мочи. Чем выше ее концентрация и чем дольше она задерживается в пузыре, тем более сильным оказывается опухолегенное действие веществ в ее составе. У мужчин причинами опухолей выступают заболевания мочеполового тракта:
- аденома простаты;
- простатит;
- камни в органах мочевыделительной системы;
- стриктуры и дивертикулы мочеиспускательного канала.
Ввиду особенностей анатомического строения мужчины больше подвержены риску возникновения новообразований. Злокачественные опухоли мочевого пузыря могут развиваться по тем же причинам:
- из-за работы на вредном производстве;
- паразитарных инфекций;
- длительной задержки мочи;
- инфекций и воспаления урогенитального тракта.
Симптомы опухолевых заболеваний
Рассматривая симптомы опухоли мочевого пузыря, стоит отметить, что на раннем этапе она никак себя не проявляет. Признаки возникают, когда новообразование достигает таких размеров, при которых оно может раздражать стенки органа. В такой ситуации у человека могут быть следующие жалобы:
- изменение цвета мочи;
- спазмы и боль внизу живота;
- ощущение не полностью опорожненного мочевого пузыря;
- выделение мочи небольшими порциями;
- частые позывы к мочеиспусканию;
- нарушение менструального цикла и выделения из половых путей (у женщин);
- отечность в ногах, области промежности;
- нарушения работы органов пищеварения.
Методы диагностики опухоли мочевого пузыря
Поскольку опухоль может носить доброкачественный или злокачественный характер, особое значение приобретает дифференциальная диагностика. Она направлена на то, чтобы определить тип новообразования, поскольку от этого зависит схема лечения. Исходя из этого, в инструментальную и лабораторную диагностику опухоли мочевого пузыря включают:
- Ультразвуковое исследование (УЗИ) органов малого таза.
- Магнитно-резонансную или компьютерную томографию (МРТ или КТ) малого таза.
- Цистоскопию с биопсией новообразования для определения его типа.
- Экскреторную урографию и цистографию.
- Цитологическое тестирование мочи.
Опухоль мочевого пузыря – это новообразование, возникающее на слизистой оболочке органа и распространяется вглубь, в мышечный слой. Инвазивный рак мочевого пузыря может распространяться в лимфатические узлы и другие органы малого таза или всего тела. Может быть как доброкачественного, так и злокачественного характера.
К факторам риска способствующим развитию рака мочевого пузыря относят:
- Возраст (наибольшая частота 40-60 лет)
- Профессиональный контакт с анилиновыми красителями и ароматическими аминами
- Курение (повышает риск развития заболевания в 4 раза)
- Злоупотребление фенацетином
- Лечение циклофосфамидом
Как выявить опухоль мочевого пузыря?
Для диагностики необходимо проведение УЗИ, МРТ или КТ малого таза, цистоскопии с биопсией образования.
Какие существуют методы лечения рака мочевого пузыря? Где лучше лечить рак мочевого пузыря?
Лечение больных раком мочевого пузыря должно осуществляться в специализированном уроонкологическом стационаре.
Лечение рака мочевого пузыря у мужчин и женщин
Как удаляют опухоль мочевого пузыря? Поверхностные новообразования удаляют с помощью трансуретральной резекции стенки мочевого пузыря или единым блоком с помощью лазера. При высокой степени дифференцировки (I и II степени) и стадией Та достаточно выполнения контрольных цистоскопических исследований с повторной биопсией зоны резекции. У больных с множественными и частыми рецидивами, а также при III степени или стадии Т1, установленных во время первичной диагностики, обычно проводят внутрипузырную иммунотерапию или химиотерапию.
Трансуретральная резекция поверхностно расположенного новообразования петлей
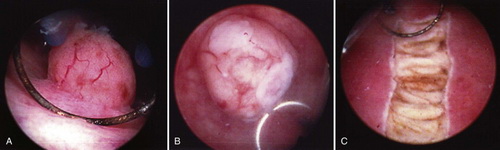
Рис. Трансуретральная резекция поверхностно расположенного новообразования петлей.
Опыт показывает, что в процессе лечения рака мочевого пузыря необходимо выполнять контрольные цистоскопические исследования каждые 3 мес в течение первых 2 лет, затем каждые 6 мес в течение 1-2 лет, затем один раз в год. В этих случаях на помощь приходит так называемая фотодинамическая диагностика (ФДД). В мочевой пузырь вводится специальный препарат, который избирательно накапливается в ткани опухоли. Затем производится осмотр мочевого пузыря изнутри (цистоскопия) в которой в качестве источника света используется особая лампа. Свет такой лампы заставляет накапливающие препарат участки опухоли отличаться по цвету от здоровых участков стенки мочевого пузыря.
Фотодинамическая диагностика может использоваться и в ходе первичного удаления опухоли мочевого пузыря для выявления дополнительных, невидимых в обычном свете, опухолевых очагов.
Препараты для внутрипузырных инъекций
Иммунотерапия бациллами Кальметта-Герена (БЦЖ) является наиболее эффективным методом лечения неинвазивного рака мочевого пузыря у мужчин и женщин. Митомицин С – это самый активный химиотерапевтический препарат.
При лечении инвазивного рака мочевого пузыря применяется агрессивная и радикальная операция – удаление мочевого пузыря (цистэктомия). Возможно проведение как открытым, так и лапароскопическим доступом. Для лечения пациентов с метастазами применяется комбинированная химиотерапия.
После удаления мочевого пузыря необходимо создать новые пути отведения мочи из организма. Этого можно добиться с помощью трех основных способов. Все методики включают использование сегментов кишечника, которые сохраняют свое кровоснабжение, однако отсекаются от остальных отделов желудочно-кишечного тракта.
- Чаще всего при отведении мочи используется илеальный кондуит (сегмент подвздошной кишки). Это самый простой и быстрый способ создания новых путей оттока мочи, который дает минимальное количество ранних и поздних осложнений. Операция включает использование сегмента кишечника (чаще всего, подвздошной кишки), один конец которого соединяется с мочеточниками, отводящими мочу от почек. Другой конец сегмента выводится на переднюю брюшную стенку и закрывается специальным уростомным мешком. Моча непрерывно отводится от почек в уростомный мешок через мочеточники и илеальный кондуит. Мешок необходимо менять через определенные промежутки времени или опорожнять при его заполнении через специальный клапан, расположенный в нижних отделах изделия. При отведении мочи используется илеальный кондуит (сегмент подвздошной кишки)
- Операция по созданию ортотопического мочевого пузыря подразумевает формирование артифициального (искусственного) резервуара, имитирующего мочевой пузырь. При этом используется сегмент кишечника, который соединяется с мочевыводящими путями таким образом, что мочеиспускания происходят естественно. Основное преимущество данной процедуры: отсутствие необходимости ношения уростомного мешка и более естественный ход мочеиспусканий.
- Постоянный удерживающий резервуар – это вид искусственного мочевого пузыря, который не соединяется с мочеиспускательным каналом, а имеет отверстие (или уростому) на передней брюшной стенке. Время от времени для выведения мочи наружу пациенту необходимо вставлять через отверстие катетер. Резервуар снабжен клапанным механизмом, что предотвращает утечку мочи через выходное отверстие. Благодаря этому пациенту не нужно носить уростомный мешок.
Радикальная цистэктомия (открытым доступом, лапароскопическая или роботизированная) в сочетании с одним из трех методов отведения мочи – это золотой стандарт лечения инвазивных форм рака мочевого пузыря, а также некоторых поверхностных опухолей высокой степени злокачественности.
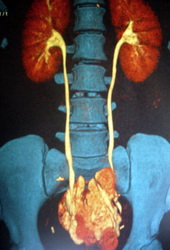
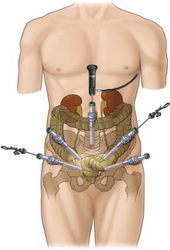
Рис. Лапароскопическая цистэктомия по Штудеру
.
Операция также носит название ортотопической пластики мочевого пузыря сегментом подвздошной кишки. Слово ортотопический значит, что искусственный мочевой пузырь будет располагаться там же, где ранее был настоящий орган. Сегодня отведение мочи по Штудеру выполняется в 55-60% случаев радикального удаления мочевого пузыря. Вновь сформированный резервуар подшивается к мочеточникам и мочеиспускательному каналу. Это позволяет пациенту сохранить удержания мочи и избавиться от необходимости ношения мочеприемника.
В нашей клинике проводится эффективное лечение и удаление раковой опухоли мочевого пузыря у мужчин и женщин. Чтобы получить консультацию, надо записаться на прием к урологу.

Акопян Гагик Нерсесович – профессор, доктор медицинских наук, онколог, уролог в Москве
Прием ведет врач высшей категории, уролог, онколог, доктор медицинских наук, профессор. Автор более 100 научных работ.
Онкоурологический стаж – более 15 лет. Помогает мужчинам и женщинам решать урологические и онкоурологические проблемы.
Проводит диагностику, лечение и сложные операции при таких диагнозах, как:
- опухоли почек и верхних мочевых путей;
- рак предстательной железы и мочевого пузыря;
- мочекаменная болезнь;
- аденома простаты;
- гидронефроз, стриктура мочеточника и др.
На консультации уролог подробно ответит на все интересующие вас вопросы
Если не дают покоя затрудненное или учащенное мочеиспускание, боль в поясничной области, кровь в моче, а также другие симптомы (о том, что еще должно вас насторожить, читайте тут), обратитесь за помощью к врачу урологу.
Прием включает:
- знакомство врача с историей болезни пациента;
- осмотр;
- постановку предварительного диагноза, назначение анализов и необходимых процедур.
* Если вы планируете обследоваться сразу после встречи с врачом, отправляйтесь в клинику с наполненным мочевым пузырем.
Не оттягивайте посещение клиники – приходите на консультацию уролога в Государственный центр урологии в Москве – клинику урологии имени Р. М. Фронштейна Первого Московского Государственного Медицинского Университета имени И.М. Сеченова. Доверьте свое здоровье грамотному специалисту!
Чтобы встреча с врачом прошла максимально эффективно, подготовьтесь к первичной консультации
- Возьмите с собой больничные выписки; результаты всех обследований, которые Вы проходили в последние 2-3 года (включая рентгены и томографии); заключения специалистов.
- Из обязательных документов нужно принести паспорт, полис.
Записаться на прием к урологу в Москве можно несколькими способами:
- звоните по тел. +7 (499) 409-12-45 или +7 (926) 242-12-12 в любой день недели с 8:00 до 20:00;
- или заполните форму на сайте.
Запись на прием
Записаться
В будний день мы сможем назначить вам консультацию уже через несколько часов после обращения.
Все заболевания…
Источник
Радикальная цистэктомия – основной метод борьбы с мышечно-инвазивным (проникшим в глубокие мышечные ткани) раком мочевого пузыря. На ранних стадиях заболевания (I-II) еще возможно сделать резекцию, то есть удалить только часть органа. Однако больные часто обращаются за помощью к врачу слишком поздно, когда для сохранения жизни и здоровья требуется вырезать пораженный пузырь полностью. Нередко удаление мочевого пузыря сопровождается иссечением близлежащих тканей и органов, которые могут быть поражены онкологическим процессом:
нижний отдел обоих мочеточников;
локальные лимфатические узлы;
часть половых органов.
Иногда существует необходимость одновременного удаления простаты и мочевого пузыря, а также резекции регионарных лимфатических узлов, семенных пузырьков, проксимального отдела мочеиспускательного канала, исходя из локализации опухоли и специфики метода дальнейшего отведении мочи. Вследствие этого возможны снижение или полная потеря половой функции. Удаление мочевого пузыря у женщин подразумевает вырезание регионарных лимфоузлов, передней стенки влагалища, матки или ее части, придатков, мочеиспускательного канала. Как следствие, пациентка больше не может иметь детей.

Показания и противопоказания
Врачи заинтересованы в максимальном сохранении органа, но чем более запущенная форма рака мочевого пузыря обнаруживается, тем меньше возможностей предлагает медицина. Показаниями к проведению операции являются:
мышечно-инвазивная опухоль;
рецидивирующая опухоль, лечение которой с помощью ТУР не приводит к длительной ремиссии;
быстрорастущая опухоль размером более 4 см;
множественные раковые очаги в мочевом пузыре;
сморщенный мочевой пузырь;
сильные кровотечения и боли;
ІІІ-ІV степень рака мочевого пузыря.
Противопоказания к проведению операции по удалению мочевого пузыря:
общее тяжелое состояние пациента;
нарушения свертываемости крови;
пожилой возраст больного;
наличие воспалительных заболеваний, в том числе мочеполовой системы.
Подготовка к цистэктомии
Прежде всего, пациент проходит тщательное обследование: аппаратные исследования (цистоскопия, УЗИ, МРТ или урография), лабораторные анализы (общий и биохимический анализ крови, анализ мочи, коагулограмма, глюкозный тест). На основании всех тестов врачи определяют индивидуальный план и тактику проведения операции, а также метод отведения мочи.
Особенности лапароскопического метода
Кроме традиционной операции, проводят также иссечение больного органа через несколько небольших разрезов при помощи высокотехнологичных хирургических миниатюрных инструментов, оснащенных камерой. Лапароскопическая цистэктомия – это прогрессивная технология, которая имеет неоспоримые преимущества перед открытой операцией:
малая инвазивность и снижение травматичности вмешательства;
меньшая кровопотеря;
быстрый реабилитационный период;
снижается необходимость приема анальгетиков после операции;
снижается риск инфицирования и развития перитонита;
минимизируется вероятность формирования грыжи;
сокращается срок восстановления функционирования кишечника.
Выведение мочи у людей, перенесших цистэктомию
Различают две стратегии решения этой проблемы: недержание и удержание мочи. В первом случае жидкость непрерывно выводится из организма, во втором – удерживается внутри с помощью искусственного резервуара. Существует несколько вариантов:
уретерокутанеостомия – выведение мочеточников с помощью стомы на животе;
уретероректонеостомия – мочеточники соединяются с прямой кишкой;
создание мочевого пузыря из небольшого отрезка тонкой кишки, который соединяется с уретрой;
формирование пузыря из тонкой или толстой кишки с катеризацией.

После операции
В реабилитационный период больному противопоказано купаться в водоемах, принимать ванны и бывать в бане или сауне, поднимать тяжести. Обязательно нужно обеспечивать качественную гигиену мочеприемника и стомы. Через 3-4 недели необходимо посетить своего хирурга, который оценит, как идет выздоровление.
Жизнь после удаления мочевого пузыря станет иной, но к этим сложностям можно приспособиться. Данная операция является крайней мерой и зачастую единственной возможностью сохранить жизнь больному.
Государственный центр урологии, опираясь на многолетний практический опыт, успешно внедряет в свою работу инновационные методы диагностики и лечения всех видов заболеваний мочеполовой системы, в том числе хирургии при онкологиях.
12 августа 2020
Акопян Гагик Нерсесович – врач уролог, онколог, д.м.н., врач высшей категории, профессор кафедры урологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова
Клиника урологии имени Р. М. Фронштейна Первого МГМУ имени И.М. Сеченова приглашает на прием к опытным врачам урологам. Чтобы попасть на прием к квалифицированному специалисту, достаточно заполнить короткую онлайн-заявку. Обязательно заполните все поля, включая краткое описание симптомов (графа «Сведения»), уточните – вторичный или первичный прием вас интересует.
Обратите внимание на кнопку «Прикрепить файл» – она позволяет сразу же оправить врачу медицинские документы в электронном виде. Это могут быть снимки, анализы и другая информация, которая будет важна для определения диагноза.
Остались вопросы? Позвоните нам по телефону +7 (926) 242-12-12 или +7 (499) 409-12-45! В будний день прийти на консультацию к врачу возможно уже через несколько часов после заполнения онлайн-заявки. Не откладывайте посещение специалиста, если вас беспокоит здоровье мочеполовой сферы!
Запись на прием
Записаться
Все основные направления…
Источник
Перепечай В. А.2 , Коган М.И.1 , Васильев О.Н.1
1 Кафедра урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
2 Клиническая больница №1, ФГУ «Южный окружной медицинский центр ФМБА России», г.Ростов-на-Дону Адрес: 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29, тел. (863)2014448 Эл.почта: perepechay_va@mail.ru, dept_kogan@mail.ru, vasilyev_on@mail.ru
Введение
Радикальная цистэктомия (РЦЭ) является стандартным методом лечения инвазивного и немышечноинвазивного рака мочевого пузыря высокого риска рецидива и прогрессии. РЦЭ в настоящее время не рассматривается как инвалидизирующая операция, сопряженная с высоким риском летальности, тяжелыми послеоперационными осложнениями и последующим неблагоприятным прогнозом в отношении продолжительности жизни больных. Этого удалось достигнуть благодаря усовершенствованию техники РЦЭ и разработке новых, более надежных методов послеоперационного отведения мочи. К настоящему времени разработаны разнообразные виды деривации мочи после РЦЭ, однако ортотопическая неоцистопластика лучше всего моделирует врожденный мочевой пузырь, обеспечивая адекватную емкость созданного резервуара, функцию его опорожнения и лучшее качество жизни пациентов. Ортотопическое замещение мочевого пузыря является стандартной формой после РЦЭ при отсутствии противопоказаний. Многочисленные исследования показывают безопасность и отдаленную надежность данного вида деривации мочи, а также преимущества перед инконтинентными методиками. Создание ортотопического резервуара с достаточной емкостью, низким внутрипросветным давлением и адекватной защитой верхних мочевых путей позволяет достичь максимальной медицинской и социальной реабилитации больных, подвергнутых РЦЭ. Основным условием полноценной социальной и психологической реабилитации пациентов сегодня следует считать восстановление самостоятельного мочеиспускания. Учитывая данный факт, при возможности выполнения ортотопического замещения мочевого пузыря, его следует предпочесть другим способам деривации мочи. Для ортотопической реконструкции мочевого пузыря используются сегменты подвздошной кишки, восходящей, поперечной, нисходящей, сигмовидной толстых кишок, сочетание этих сегментов, реже – стенка желудка, кожно-мышечные лоскуты. В середине 90-х годов ортотопическое замещение мочевого пузыря в большинстве медицинских центров мира стало стандартным методом реконструкции, а у 90% больных используется с этой целью ортотопический мочевой пузырь из подвздошной кишки (Moutie J.F. 1997 г., Studer R.E. et al. 1998 г., Hautmann R.E. et al 1999, 2001 гг.).
Описывается несколько методик ортотопической кишечной цистопластики в различных модификациях, однако широко применяемыми являются методики Camey II, Hemi Kock, Hautmann и Studer. Данные методики имеют минимальные различия по функциональным результатам, при наличии как преимуществ, так и своих недостатков (таблица 1). По континентности и адекватности опорожнения имеет место закономерная дневная и ночная вариабельность. Удержание мочи улучшается на протяжении 3 лет после ортотопической деривации мочи, результатом чего является дневное удержание у 90% пациентов, ночное – у 70-85 % соответственно [8].
Таблица 1. Результаты различных методик ортотопической энтероцистопластики
| Camey I [1] | Camey I [2,3] | Hautmann И1 | Hemi-Kock [4, 5, 6, 7] | Studer [41 | |
|---|---|---|---|---|---|
| Дневное удержание | 20-80% | 96% | 83,70% | 85-87% | 92% |
| Ночное удержание | 0-80% | 78% | 66% | 75-94% | 80% |
| Рефлюкс в верхние мочевые пути | 15% | 15% | 3,30% | 17% | – |
| Максимальное давление в резервуаре | 43 см Н20 | 32 cm Н20 | 30 см Н20 | <40 см Н20 | 20-30 см Н20 |
| Ранние п/операционные осложнения | – | 12% | 15% | 17,80% | 11% |
| Поздние п/операционные осложнения | – | 24% | 23% | 15,70% | 18% |
| Средняя емкость неоциста | – | – | 433 мл | 709 мл | 450-500 мл |
В настоящее время необходимо выбирать метод деривации мочи с наименьшим количеством ранних и отдаленных осложнений и обеспечением наилучшего качества жизни больного после операции [9]. Большинство исследований за последние десять лет показывает на предпочтение при выборе метода ортотопической илеоцистопластики – операции по Studer. Однако результаты этой и других методик тонкокишечной ортотопической реконструкции значительно хуже при интраоперационно выявленной короткой брыжейке тонкой кишки, которая обусловливает натяжение тканей по линии уретрорезервуароанастомоза, что препятствует безопасному выполнению ортотопической операции и вынуждает хирурга прибегать к альтернативным вариантам кишечной деривации мочи. Таким образом, к одному из недостатков тонкой кишки относят ограниченные возможности применительно к ортотопической цистопластике из-за того, что у ряда пациентов оказываются короткими сосуды брыжейки для беспрепятственного низведения сегмента подвздошной кишки в малый таз и наложения анастомоза между кишечным мочевым пузырем и уретрой без натяжения [10]. В связи с этим известно, что одним из характерных осложнений среди прочих является несостоятельность резервуароуретрального анастомоза при всех известных и наиболее применяемых методиках ортотопической илеоцистопластики. Даже минимальное натяжение в зоне анастомоза между кишечным резервуаром и уретрой остается серьезной проблемой и является основной причиной несостоятельности анастомоза с формированием мочевых затеков, перитонита, сепсиса, кишечной непроходимости, мочевых свищей с необходимостью повторных операций.
Это заставляет хирурга в случае имеющегося натяжения в анастомозе менять интраоперационно план реконструкции, отказываться от ортотопической операции, прибегать к другим, более сложным ее вариантам (гетеротопической, кондуитной, отведению в непрерывный кишечник и др.), которые с позиции качества жизни оказываются заведомо хуже в сравнении с ортотопической деривацией, либо выполнять дополнительные резекции кишечника и т.п. Это неоправданно затягивает время операции, увеличивает ее стоимость и объем хирургической травмы, число послеоперационных койко-дней, риск осложнений и летальности.
Хирургами предпринимаются всевозможные способы ликвидации натяжения тканей в зоне уретро-резервуароанастомоза, либо, если это не удается, ортотопическая цистопластика не выполняется, что значительно ухудшает непосредственные и отдаленные результаты, а также значимо снижает качество жизни больных. В связи с этим становится очевидной необходимость создания простого, не требующего дополнительных затрат, не увеличивающего времени операции и объема хирургической травмы метода, позволяющего безопасно выполнить ортотопическую тонкокишечную реконструкцию мочевого пузыря в условиях недостаточной длины брыжейки тонкой кишки.
Материалы и методы
Анализированы результаты лечения 326 пациентов, подвергнутых радикальной цистэктомии при раке мочевого пузыря в период с 1995 по 2012 гг. Среди всех видов реконструктивной субституции мочевого пузыря чаще выполняли ортотопическую интестиноцистопластику в различных вариантах – 152 (41,3%) пациентов. При наличии противопоказаний к ортотопической реконструкции (в том числе при выявлении короткой тонколибо толстокишечной брыжейки, препятствующей ортотопической цистопластике) у 38 (10,3%) пациентов выполнили гетеротопическую континентную пластику, а у 27 (7,3%) и 53 (14,4%) – внутреннюю деривацию мочи в кишечник и наружную неконтинентную деривацию в различных вариантах соответственно. Ортотопическая интестиноцистопластика по Studer выполнена 69 (18,7%) больным, из них короткая брыжейка тонкой кишки была у 48 (69,6%). Данные пациенты были ретроспективно разделены на две группы для проведения сравнительного анализа. Критерием групповой дифференциации явилась интраоперационная оценка допустимости натяжения тканей в формируемом уретрорезервуароанастомозе, которую проводили в соответствии с общепринятыми рекомендациями: при помощи пинцета и незначительной тракции, заранее определенную зависимую точку резервуара (место предполагаемого наложение анастомоза со стороны резервуара) низводили к культе уретры. В некоторых случаях дополнительно мобилизовали выделенный сегмент кишки путе м рассечения серозы над сосудистыми аркадами брыжейки [11]. В случае адекватного сопоставления краев культи уретры и стенки резервуара выполняли их анастомозирование (I группа, 15 (31,3%) пациентов). При невозможности сопоставления краев культи уретры и стенки резервуара без значимого натяжения, применяли модификацию методики Studer – оригинальную инвертирующую ортотопическую илеоцистопластику (II группа, 33 (68,7%) пациентов).
Предложенный метод операции [12], примененный нами во II группе, направлен на предотвращение натяжения тканей в зоне резервуаро-уретрального анастомоза путем продольного, а не поперечного сшивания резервуара и его инвертирующего позиционирования в малом тазу для максимального приближения стенки резервуара к культе уретры и выполнения уретро-резервуарного анастомоза без натяжения.
Технические отличия сводятся к тому, что резецируется не 60-65 см подвздошной кишки, а 55 см. А проксимальный тубулярный конец сохраняется на протяжении 15 см, а не 20 см. Далее детубуляризированную часть кишечного трансплантата складывают симметрично U-образно (вершина U направлена каудально, длина колен – 20 см), прилежащие края сшивают однорядным обвивным непрерывным швом через все слои со стороны слизистой (Полисорб 3/0). Таким образом, формируют заднюю стенку резервуара. Затем резервуар складывают не в поперечном, как при операции Studer, а в продольном направлении (рис. 1) путем совмещения противоположных длинных сторон.
Рис. 1. Формирование задней стенки U-образного резервуара
При этом образуется трубчатый резервуар U-образной формы, который ушивают наглухо однорядным обвивным непрерывным серозно-мышечноподслизистым швом со стороны серозной оболочки кишки (рис. 2). Продольное сшивание U-образного резервуара обеспечивает более близкое прилежание нижней точки резервуара к культе уретры (на 3-4 см) в сравнении с поперечным складыванием при методике Studer.
Рис. 2. Ушивание передней стенки U-образного резервуара
Однако в большинстве случаев при короткой брыжейке это не обеспечивает отсутствия натяжения в анастомозе с уретрой. Для еще большего низведения нижней стенки резервуара в малый таз выполняют инвертирующее позиционирование сформированного резервуара в малом тазу. Для этого осуществляют «выворачивание» сформированного U-образного резервуара между листками брыжейки кверху, начиная от вершины «U» (рис. 3).
Рис. 3. Инвертирование сформированного U-образного резервуара от его вершины
После завершения полного выворачивающего позиционирования (рис. 4) и ротации резервуара вместе с приводящим тубуляризированным сегментом (рис. 5), задняя стенка резервуара, свободная от брыжейки, оказывается расположенной кпереди и еще более свободно низводится в малый таз, сокращая расстояние до культи уретры еще на 3-4 см. При этом не происходит перегиба брыжейки, она свободно ротируется под резервуаром. А сам резервуар не оказывается «перетянутым» сосудами брыжейки в сагиттальной плоскости, как при поперечном его складывании. Этот момент является весьма важным для последующего адекватного и беспрепятственного расправления резервуара в малом тазу (увеличения его емкости) в послеоперационном периоде.
Рис. 4. Выворачивание U-образного резервуара между листками брыжейки резецированного кишечного сегмента
Рис. 5. Свободная ротация брыжейки под резервуаром без ее перегиба
Далее в самой нижней точке резервуара, прилежащей к уретре, формируют отверстие, пропускающее кончик указательного пальца, производят анастомоз с уретрой узловыми швами через все слои, Полисорб 2/0, на 2, 4, 6, 8, 10 и 12 ч условного циферблата. По уретре в полость неоциста устанавливают катетер Foley Ch№ 20-22. Стентированные мочеточники проводят забрюшинно, и через разрез париетальной брюшины вводят в брюшную полость на уровне верхнего края приводящего тубуляризированного сегмента. По методике Wallace (анастомоз Y-типа) мочеточники анастомозируют с открытым концом кишки приводящего сегмента резервуара. До полного ушивания анастомоза мочеточниковые стенты выводят по уретре наружу. К катетеру Foley у меатуса фиксируют мочеточниковые стенты. Катетер Foley фиксируется к уздечке penis (либо к большой половой губе). После этого окончательно ушивают мочеточниковорезервуарный анастомоз. Дополнительный цистостомический дренаж не устанавливают. Резервуар ушивают наглухо и дренируют исключительно трансуретрально, что максимально сокращает сроки восстановления самостоятельного мочеиспускания.
Результаты
В I группе у 10 пациентов (66,6%) в раннем послеоперационном периоде развилась несостоятельность анастомоза между резервуаром и уретрой. Это потребовало реанастомозирования уретры и резервуара у 3 больных, а у 7 пациентов пролонгированного удержания уретрального катетера (от 3 до 8 недель), тогда как во II группе подобного осложнения не отмечено. Средняя емкость неоциста после удаления уретрального катетера на 14 сутки в I и II группах – 190 и 110 мл, через 3 мес. – 200 и 350 мл, через 12 мес. – 420 и 490 мл. Максимальное давление в резервуаре к 6 мес. в I группе не превышает 45 см. вод. ст. (в среднем 35 см. вод. ст.) и 40 см. вод. ст. (в среднем 30 см. вод. ст.) во II группе соответственно. Дневное удержание мочи к 6 мес. в I и II группах – 86,0 и 94,7%, ночное удержание при одной принудительной ночной микции – 70,0 и 79,0%.
Заключение
Модификация ортотопической илеоцистопластики путем инвертации резервуара целесообразна к применению у пациентов при создании ортотопического тонкокишечного мочевого резервуара и короткой брыжейке тонкой кишки. Инвертация резервуара позволяет минимизировать осложнения после цистэктомии и улучшить функциональные показатели резервуара. Предложенный способ прост, надежен и позволяет добиться максимального качества жизни больных после радикальной цистэктомии. Описанный принцип инверсии применим и при других вариантах ортотопической кишечной цистопластики, когда необходимо уменьшить натяжение в кишечно-уретральном анастомозе.
Литература
1. Roehrborn, C.G. al characteristics of the Camey ileal bladder / C.G. Roehrborn, C.M. Teigland, A.I. Sagalowsky // J. Urol. – 1987. – V.138(4). – P.739-742.
2. Camey, M. Complications of the Camey procedure / M. Camey, H. Botto, E. Richard // Urol. Clin. North. Am. – 1988. – V.15(2). – P.249-255.
3. Orthotopic bladder replacement using ileum: techniques and results / J. Ramon, P. Leandri, G. Rosol, H.Botto // Reconstructive Urology. – Oxford: Blackwell Scientific Publications, 1993. – P.445-457.
4. Коган, М.И. Современная диагностика и хирургия рака мочевого пузыря. / М.И. Коган, В.А. Перепечай. – Ростов н/Д, 2002. – 242 с.
5. Steven, K. The orthotopic Kock ileal neobladder: al results, urodynamic features, complications and survival in 166 men / K. Steven, A.L. Poulsen // J. Urol. -2000. – V.164(2). – P.288-295.
6. The Kock ileal neobladder: upd experience in 295 male patients / D.A. Elmajian, J.P. Stein, D. Esrig et al. // J. Urol. – 1996. – V.156(3). – P.920-925.
7. The urethral Kock pouch: long-term al and oncological results in men / A.A. Shaaban, A. Mosbah, M.S. ElBahnasawy et al. // BJU Int. – 2003. – V.92(4). – P.429-435.
8. Wright, E.J. Urinary diversion. Scientific Foundations and Clinical Practice / Eds K.J. Kreder, A.R. Stone / 2nd Ed. London and New York, 2005. – P.135-141.
9. Hautmann, R.E. Urinary diversion: ileal conduit to neobladder / R.E. Hautmann // J. Urol. 2003. – V.169(3). – P.834-842.
10. Zinman, L.N. Bladder Reconstruction and Continent Urinary Diversion / Eds L.R. King, A.R. Stone, G.D. Webster / 2nd Ed. St. Louis, 1991. – P.6887.
11. Морозов, А.В. Ортотопический «энтеро-неоцистис» низкого давления / A.В. Морозов, К.А. Павленко // М: ИД Медпрактика-М, 2006. – С. 66-67.
12. Перепечай, В.А. Инверсия ортотопического кишечного мочевого резервуара для предотвращения натяжения в уретрорезервуароанастомозе / В.А. Перепечай // Клиническая практика. – 2011. – №1 – С.18-26.
Статья опубликована в журнале “Вестник урологии”. Номер №3/2013 стр. 3-12
Источник
