Генетика рака мочевого пузыря
Рак мочевого пузыря (РМП) одна из актуальных проблем в онкоурологии. По данным ВОЗ, около 3% всех злокачественных заболеваний составляет рак мочевого пузыря. В 19982008 гг. заболеваемость раком мочевого пузыря на 100 000 населения в РФ возросла с 7,90 до 9,16 (+ 15,9%). В структуре онкологической заболеваемости в 2008 г. доля злокачественных новообразований мочевого пузыря составила 4,5% [1,2]. У мужчин опухоли мочевого пузыря отмечают значительно чаще, чем у женщин (4:1). Большую часть опухолей мочевого пузыря у мужчин объясняют более частым контактом с канцерогенными веществами и более длительной задержкой мочи в пузыре.
Общепризнано, что РМП онкологическое заболевание с широким разнообразием факторов риска. Известно, что пусковым механизмом развития большинства онкологических заболеваний является индивидуальная генетическая предрасположенность, провоцируемая разнообразными внешнесредовыми факторами, прежде всего химической природы. По данным литературы к факторам риска РМП относятся канцерогены табачного дыма [3, 4, 5], полиароматические углеводороды (ПАУ) [6], некоторые лекарственные препараты и другие, объединенные общим названием ксенобиотики [7, 8]. Необходимым условием проявления действия ксенобиотиков является повышенная чувствительность организма, которая формируется при наличии определенного генетического фона. Канцерогены, попадая в организм, подвергаются биотрансформации под воздействием ферментов, активность которых контролируется генами системы детоксикации ксенобиотиков. При неблагоприятных комбинациях генотипов возрастает риск развития рака мочевого пузыря. В этой связи представляется важным изучение особенностей генетических систем, участвующих в детоксикации ксенобиотиков у больных раком мочевого пузыря. Биотрансформация ксенобиотиков состоит из 2 фаз. В 1 фазе, контролируемой ферментами цитохромов P450 и др., происходит активация ксенобиотиков с образованием активных промежуточных метаболитов, которые под воздействием ферментов 2 фазы (глутатионS-трансферазы и др.) преобразуются в водорастворимые нетоксичные компоненты и выводятся из организма [7, 8, 9].
Еще одним фактором риска развития рака мочевого пузыря является ионизирующее излучение. Сообщалось о дву, четырехкратном увеличении риска развития вторичных злокачественных опухолей мочевого пузыря после применения дистанционной лучевой терапии при гинекологических злокачественных опухолях [10]. У пациентов, получавших лечение по поводу рака предстательной железы, заболеваемость раком мочевого пузыря была статистически значимо ниже у больных после радикальной простатэктомии, чем у подвергнутых дистанционной лучевой терапии [11].
Однако не все случаи взаимодействия организма с химическими и физическими (ионизирующее облучение) канцерогенами запускают канцерогенез. Существуют многочисленные механизмы репарации поврежденной ДНК. Идентифицировано более 100 генов, регулирующих процессы репарации. Одним из наиболее изучаемых генов системы репарации ДНК является ген XRCC1. Но ассоциации полиморфных вариантов этого гена с развитием РМП еще не достаточно широко изучены. Белок, кодированный геном XRCC1, является важным компонентом эксцизионной репарации оснований, исправляя поврежденные основания и одноцепочечные разрывы, вызванные ионизирующей радиацией и алкилирующими агентами. Наиболее часто встречающимся полиморфным вариантом является Arg280His [12, 13, 14]. Также Arg280His аллель связан с постоянным повреждением ДНК, появлением мутаций, остановкой клеточного цикла, вызванной ионизирующей радиацией [12]. Эти исследования предполагают, что индивиды с аллелью Arg280His обладают меньшей способностью к репарации повреждений ДНК [13]. Функциональная значимость полиморфного варианта Arg280His не установлена, однако известно, что аллель 280His расположен в регионе пролиферирующего антигенсвязывающего ядерного фактора, ассоциированного с чувствительностью к блеомицину [15].
Цель работы: исследование ассоциации полиморфных вариантов генов цитохрома Р450 (CYP1А1), глутатион-8-трансфераз (GSTM1, GSTP1) и гена репарации ДНК (XRCC1) с риском развития рака мочевого пузыря.
МАТЕРИАЛЫ И МЕТОДЫ
Основную группу составили 146 пациентов с гистологически верифицированным диагнозом рак мочевого пузыря, находившихся на стационарном лечении в Республиканском онкологическом диспансере и Республиканской клинической больнице г. Уфы (РБ) за период с 2005 по 2009 гг. Средний возраст больных составил 61,23 ± 11,22 лет.
В группу сравнения вошел 241 пациент без выявленных онкологических заболеваний. Средний возраст: 59,38 ± 10,38 лет.
ДНК выделяли из лимфоцитов периферической венозной крови методом фенольно-хлороформной экстракции. Анализ полиморфных локусов генов CYP^1 (Ile462Val), GSTP1 (Ile105Val) и XRCC1 (Arg280His) проводили методом полимеразной цепной реакции (ПЦР) с последующей рестрикцией амплифицированных фрагментов, соответствующими эндонуклеазами: HindII, BsoMAI («Сибэнзим», Россия). Делеционный полиморфизм гена GSTM1 (del) исследовали в стандартных условиях по ранее описанной методике [11]. Результаты амплификации и рестрикции оценивали при помощи вертикального электрофореза в 7% полиакриламидном геле при напряжении 200-300В (10 В/см). В качестве буфера использовали трис-боратный буфер (ТВЕ). По окончании электрофореза гель окрашивали раствором бромистого этидия (0,1мкг/мл) в течение 10 минут и визуализировали в проходящем ультрафиолетовом свете.
Математическую обработку результатов исследования проводили на IBM-Pentium IV с использованием статистических программ BIOSTAT (Primer of Biostatistics, 4th Edition, S.A.Glantz, McGraw-Hill), а также в программах Statistica, Microsoft Excel и Microsoft Access.
Достоверность различий в распределении частот аллелей и генотипов между группами и ассоциацию с клиническим течением заболевания выявляли, сравнивая выборки с использованием критерия %2 с поправкой Иэйтса с помощью программы BIOSTAT. Статистически значимыми считали различия при p <0.05. Относительный риск заболевания по конкретному признаку вычисляли как соотношение шансов, доверительный интервал для относительного риска рассчитывали по стандартным формулам, расчеты проводили в программе Statistica v. 6.0 [16].
Силу ассоциации генетических маркеров с риском развития РМП оценивали по значениям показателя отношения шансов (odds ratio, OR). OR > 1,5 рассматривали как положительную ассоциацию заболевания с генотипом или аллелем (фактор риска), OR < 0,5 как отрицательную ассоциацию (фактор устойчивости).
РЕЗУЛЬТАТЫ
Данные по распределению частот генотипов и аллелей полиморфизмов генов детоксикации ксенобиотиков (CYP1А1, GSTM1 и GSTP1) и гена репарации ДНК (XRCC1) в группах больных РМП и здоровых представлены в таблице
Сравнительный анализ распределения генотипов и аллелей полиморфного варианта Ile462Val гена CYP1A1 общей выборки больных РМП и контрольной группы выявил статистически значимые результаты (X2 = 71,37; р = 0,0001 и X2 = 74,8; р = 0,0005 соответственно). У больных РМП по сравнению с контрольной группой обнаружено статистически значимое повышение гетерозигот Ile/Val (35% и 6% соответственно, х2 = 53,4, р = 0,0005) и гомозигот по мутантному гену Val/Val (7% и 1% соответственно, %2 = 9,4, р = 0,003). Одновременно, генотип Ile/Ile достоверно чаще встречался в группе здоровых индивидов 93%, тогда как в группе больных его частота оказалась меньше и составила 59% (х2 = 69,0, р = 0,0005). Частота S аллеля *Val полиморфного локуса Ile462Val гена CYP1А1 у больных РМП оказалась повышенной почти в 8,4 раза (OR = 8,4, 95% CI 4.7715.07).
Таблица 1. Распределение частот генотипов и аллелей полиморфных локусов генов цитохрома P450, глутатион^-трансфераз и репарации ДНК у больных РМП и в контрольной группе
| Генотипы и аллели | РМП | Контроль | х | р | OR (95% CI) | ||
| Абс. | Частота | Абс. | Частота | ||||
| Полиморфный локус Ile462Val гена CYP1A1 | |||||||
| Ile/Ile | 82 | 0,59 | 225 | 0,93 | 69,0 | 0,0005 | 0,1 (0,05-0,19) |
| Ile/Val | 50 | 0,35 | 14 | 0,06 | 53,4 | 0,0005 | 8,8 (4,46-17,62) |
| Val/Val | 10 | 0,07 | 2 | 0,01 | 9,4 | 0,003 | 9,1 (1,83-60,65) |
| N = 142 | N = 241 | ||||||
| Val | 70 | 0,25 | 18 | 0,03 | 74,8 | 0,0005 | 8.4 (4,77-15,07) |
| Ile | 214 | 0,75 | 464 | 0,96 | |||
| Делеционный полиморфизм гена GSTM1 | |||||||
| Норма (GSTM1*N) | 93 | 0,64 | 140 | 0,59 | 0,9 | 0,36 | 1,4 (0,80-1,96) |
| Делеция (GSTM1*0) | 52 | 0,36 | 98 | 0,41 | |||
| N = 145 | N = 238 | ||||||
| Полиморфный локус Ile105Val гена GSTP1 | |||||||
| Ile/Ile | 80 | 0,55 | 150 | 0,63 | 2,5 | 0,12 | 0,7 (0,45-1,09) |
| Ile/Val | 54 | 0,37 | 81 | 0,34 | 0,2 | 0,67 | 1,1 (0,72-1,77) |
| Val/Val | 12 | 0,08 | 7 | 0,03 | 4,3 | 0,04 | 3,0 (1,05-8,53) |
| N=146 | N=238 | ||||||
| Val | 78 | 0,26 | 90 | 0.19 | 6,5 | 0,01 | 1,6 (1,11-2,28) |
| Ile | 214 | 0,75 | 392 | 0,84 | |||
| Полиморфный локус Arq280His гена XRCC1 | |||||||
| Arq/Arq | 53 | 0,51 | 80 | 0,68 | 5,84 | 0,02 | 0,5 (0,28-0,88) |
| Arq/His | 29 | 0,28 | 30 | 0,29 | 0,07 | 0,79 | 1,13 (0,60-2,15) |
| His/His | 22 | 0,21 | 8 | 0,08 | 8,58 | 0,004 | 3,7 (1,47-9,54) |
| N=104 | N=118 | ||||||
| *His | 73 | 0,35 | 46 | 0,19 | 12,94 | 0,001 | 2,2 (1,42-3,51) |
| *Arq | 135 | 0,65 | 190 | 0,81 | |||
| Примечание: жирным шрифтом выделены значения, демонстрирующие достоверные различия между группами. | |||||||
Проведенный анализ частоты делеции гена GSTM1 достоверных различий между группами не выявил (х = 0,85; p = 0,36).
Сравнительный анализ распределения частот генотипов и аллелей маркера Ile105Val гена GSTP1 выявил статистически достоверные различия между группой больных РМП и здоровыми индивидами (х2 = 6,34, р = 0,042 и х2 = 6,5, р = 0,01 соответственно). Частота генотипа Val/ Val у больных РМП увеличена до 8,0%, в то время как у здоровых индивидов данный генотип встречался с частотой 3,0% (%2 = 4,3, р = 0,04). С другой стороны, генотип Ile/Ile встречается чаще в группе здоровых индивидов (63,0%) по сравнению с больными РМП (55,0%), однако данный результат не достиг статистической значимости (х2 = 2,45; р = 0,12). Показано, что аллель Val повышает риск развития РМП в 1,6 раза (OR = 1,6, 95%CI 1.19-1.99).
Анализ распределения частот генотипов и аллелей полиморфного локуса Arg280His гена XRCC1 выявил статистически значимые различия между группами больных РМП и здоровых индивидов (Х2 = 11,19, р = 0,004 и х2 = 12,94, р = 0,001 соответственно). Выявлено, что частота встречаемости генотипа His/His у больных РМП выше (21%), чем в контрольной группе (8%) (х2 = 8,58, р = 0,004). Одновременно было показано, что в группе здоровых частота генотипа Arg/Arg увеличена до 68% по сравнению с группой больных РМП (51%) (х2 = 5,84, р = 0,02).
Вместе с тем, частота аллеля *His увеличена почти в 2,2 раза у больных РМП по сравнению со здоровыми индивидами (OR = 2,23 95% CI 1.42-3.51).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящее время многими учеными мира ведутся исследования по выяснению роли генетической предрасположенности факторов среды в формировании мультифакториальных заболеваний, к которым можно отнести и РМП. Известно, что большинство чужеродных веществ (ксенобиотиков), попадая в организм человека, не оказывает прямого биологического эффекта, а вначале подвергается различным превращениям биотрансформации. Основные фазы обезвреживания ксенобиотиков функционируют как единый четко скоординированный комплекс, и любые отклонения в его работе сопровождаются нарушением процессов обезвреживания с непредсказуемыми, зачастую вредными последствиями для организма.
Доказано, что у человека существует генетический контроль метаболизма, поэтому в зависимости от особенностей генома различные индивидуумы могут либо сохранять устойчивость или, наоборот, обнаруживать повышенную чувствительность к повреждающим агентам. Предполагается, что индивидуальная предрасположенность к онкологическим заболеваниям также обусловлена различиями в детоксикации ксенобиотиков.
Реактивные метаболиты проканцерогенов, образовавшиеся в процессе метаболизма, способны прочно связываться с участками молекулы ДНК, образуя так называемые аддукты, нарушающие ее нормальную структуру и функции. Количество аддуктов в той или иной ткани и длительность их существования могут служить одним из показателей индивидуальной чувствительности к канцерогенам. У курящих женщин уровень аддуктов более высокий, чем у мужчин, и это соответствует предварительным эпидемиологическим наблюдениям о большей чувствительности женщин к канцерогенному действию табачного дыма. Индивидуальные различия здесь таковы, что разница в уровне аддуктов бенз(а)пирена с ДНК в стенке мочевого пузыря 70 раз, в пищеводе 100 раз [17].
Активность систем распознавания аддуктов, их удаления и восстановления первичной структуры ДНК значительно варьируют. Крайние формы известны в качестве наследственных заболеваний. Наследственные заболевания, предрасполагающие к канцерогенезу, касаются не только систем репарации ДНК, но и определенные гены нормальных клеток обладают особой чувствительностью к действию химических канцерогенов. Это так называемые онкогены. По-видимому, их функция состоит в регуляции клеточного роста и дифференциации клеток. Химические мутации именно этих генов активно трансформируют клетку в сторону неопластических процессов. В клетках существуют гены, ответственные за синтез белков, и так называемые гены-супрессоры клеточного роста. Если ген-супрессор мутировал, то в клетке не синтезируются белки, тормозящие ее размножение, создаются условия для канцерогенеза. Механизмы репарации генома замещают поврежденный участок молекулы ДНК с восстановлением ее нормальных функций, поэтому далеко не любое взаимодействие нуклеиновой кислоты и ксенобиотика завершается канцерогенезом.
Полученные нами результаты позволяют считать генотипы Ile/ Val (OR= 8,8, 95% CI 4,46-17,62), Val/ Val (OR = 9,1, 95% CI 1,83-60,65) и аллель Val (OR = 8,4, 95% CI 4,7715,07) полиморфного варианта Ile462Val гена CYP1А1; генотип Val/ Val (OR = 3,0; 95% CI 1,058,53) и аллель Val (OR = 2,2, 95% CI 1,422,28) полиморфного локуса Ile105Val гена GSTP1; а также генотип His/His (OR = 3,7, 95% CI 1,47-9,54) и аллель His (OR = 1,6, 95% CI 1,42-3,51) полиморфного локуса Arg280His гена XRCC1 генетическими маркерами повышенного риска развития РМП.
Генотипы Ile/Ile (OR = 0,1, 95% CI 0,05-0,19) и аллель Ile (OR = 0,1, 95% CI 0,07-0,2) полиморфного локуса Ile462Val гена CYP1A1; генотип Arg/Arg (OR = 0,5, 95% CI 0,280,88) и аллель *Arg (OR = 0,45, 95% CI 0,29-0,70) полиморфного локуса Arg280His гена XRCC1 являются факторами устойчивости к развитию злокачественных новообразований мочевого пузыря.
ЗАКЛЮЧЕНИЕ
Приведенные данные свидетельствует о важной роли ферментов детоксикации ксенобиотиков и репарации ДНК в развитии РМП. Учитывая то, что повышенный риск развития РМП связан с наличием определенных аллельных вариантов генов ферментов прооксидантов и антиоксидантов, можно предположить, что цитохромы P450 и глутатионзависимые ферменты, а также гены репарации ДНК могут быть важной составной частью генетической структуры подверженности развития РМП.
Ключевые слова: Рак мочевого пузыря, генетические маркеры, полиморфизм. Keywords: Bladder cancer, genetic markers, polymorphism.
ЛИТЕРАТУРА
P.1496-1501.
- Chrouser K., Leibovich B. et al. Bladder cancer risk following primary and adjuvant external beam radiation for prostate cancer // J Urol. 2006. Vol. 174, № 1. P. 107-110.
- Boorjian S., Cowan J.E., Konety B.R., DuChane J., Tewari A., Carroll P.R., Kane C.J. Cancer of the Prostate Strategic Urologic Research Endeavor Investigators. Bladder cancer incidence and risk factors in men with prostate cancer: results from Cancer of the Prostate Strategic Urologic Research Endeavor // J Urol. 2007. Vol.177, № 3. P. 883-887.
- Moullan N., Cox D. G., Angele S., Romestaing P., Gerard J.-P., Hall J. Polymorphisms in the DNA repair gene XRCC1, breast cancer risk and response to radiotherapy // Cancer epidemiology, biomarkers & prevention. 2003. Vol. 12. P. 1168.
- Park J. Y., Lee S. Y., Jeon H.-S., Bae N. C., Chae S. C. Polymorphism of the DNA repair gene XRCC1 and risk of primary lung cancer // Cancer epidemiology, biomarkers & prevention. 2002. Vol. 11. P. 23-27.
- Shen M., Hung R.J., Brennan P. Polymorphisms of the DNA repair genes XRCC1, XRCC3, XPD interaction with environmental exposures and bladder cancer risk in a case-control study in Northern Italy // Cancer epidemiology, biomarkers & prevention. 2003. Vol. 12. P. 1234-1240.
- Duell E.J., Wiencke J.K., Cheng T.J., Varkonyi A., Zuo Z.F., Ashok T.D., Mark E.J., Wain J.C., Christiani D.C., Kelsey K.T. Polymorphisms in the DNA repair genes XRCC1 and ERCC2 and biomarkers of DNA damage in human blood mononuclear cells // Carcinogenesis. 2000. Vol. 21, № 5. P. 965-71.
- www.statistica.com StatSoft Inc.-USA.Statistica v.6.0
- Белицкий Г.А. Прогноз канцерогенности фармакологических средств и воспомогательных веществ в краткосрочных тестах // Ведомости фармкомитета. 1999. № 1. С. 18-31.
Источник
Злокачественная опухоль или рак мочевого пузыря — это опасное, а зачастую и смертельное новообразование, изначально исходящее из слизистой мочевого пузыря, способное поразить как располагающиеся рядом с мочевым пузырем органы (предстательную железу, мочеиспускательный канал, матку, прямую кишку), так и отдаленные (легкие, печень, кости, головной мозг).
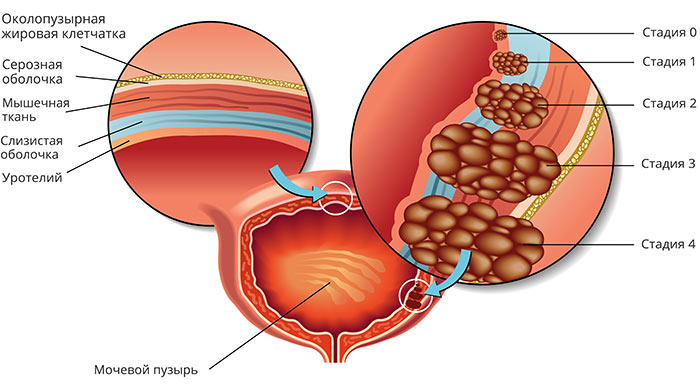
Злокачественные опухоли мочевого пузыря, классификация, стадии
В зависимости от вида клеток, из которых происходит опухоль, выделяют разные типы рака мочевого пузыря. Наиболее распространена уротелиальная, или переходно-клеточная, карцинома. Она встречается в 90–95% случаев. Гораздо реже опухоль представляет собой аденокарциному, плоскоклеточный рак, мелкоклеточную карциному, саркому (злокачественную опухоль из соединительной ткани).
Стадии рака мочевого пузыря:

- I — опухоль находится в пределах уротелия (слизистой оболочки) и не прорастает глубже.
- II -опухоль проросла глубже в стенку мочевого пузыря, но все еще не прорастает за его пределы.
- III — опухоль проросла за пределы мочевого пузыря и распространилась на окружающие ткани.
- IV — рак мочевого пузыря с метастазами.
Причины рака мочевого пузыря, факторы риска
Известно, что существуют факторы, которые повышают риск онкологии мочевого пузыря. На некоторые из них можно повлиять, на другие (такие как наследственность и возраст) нельзя:
- Самый значимый фактор риска — курение. У курильщиков заболевание возникает в три раза чаще, чем у некурящих людей. Считается, что примерно половина случаев рака мочевого пузыря у мужчин и женщин связана с курением. Табачный дым содержит токсичные вещества, которые попадают в кровь и выделяются вместе с мочой. Они задерживаются в мочевом пузыре и вызывают злокачественное перерождение клеток слизистой оболочки.
- Некоторые профессии предполагают контакт с вредными веществами, которые повышают вероятность возникновения злокачественных опухолей мочевого пузыря. В группе повышенного риска работники предприятий, которые занимаются производством красителей (воздействие бензидина и бета-нафтиламина), резиновой, кожевенной, текстильной, лакокрасочной продукции, художники, машинисты, парикмахеры (воздействие веществ, которые входят в состав красок для волос), водители грузовиков (воздействие продуктов сгорания дизельного топлива).
- Было замечено, что раком мочевого пузыря реже страдают люди, которые пьют много жидкости. Вероятно, причина в том, что мочевой пузырь у них регулярно очищается.
- Чаще всего заболевание диагностируют в старшем возрасте. Более 90% пациентов с раком мочевого пузыря — люди старше 55 лет.
- У мужчин риски выше, чем у женщин.
Как избежать рака мочевого пузыря? На что обратить внимание?
- Извечный совет всех врачей — не курите. Не курите вообще.
- Частный совет онкоуролога: убедитесь, что вы не используете бензидиновых красителей в творчестве.
- Не задерживайте мочу, лучше посетить туалет каждые 2-3 часа, чем мочиться раз в день.
- И если вдруг в моче показалась кровь, даже капелька, то срочно, в этот же день — к урологу.
Особенно опасно появление крови в моче без боли, жжения и учащения мочеиспускания. Чаще всего это означает, что кровотечение происходит из опухоли мочевого пузыря. Также важным является ежегодная диспансеризация у уролога: УЗИ почек и мочевого пузыря, особенно для тех, у кого родственники болели раком мочевого пузыря.
Что делать, если у близкого человека выявили опухоль мочевого пузыря?
На приём к онкоурологу. Максимально возможно – быстро. Онкоуролог выполнит ряд диагностических процедур и предложит тот или иной вариант лечения. Важно понимать, что способы лечения рака мочевого пузыря разных стадий имеют кардинальные отличия. И чем раньше опухоль выявлена, тем больше шансов, что лечение будет радикальным. Не относитесь равнодушно к появлению даже слабого красного окрашивания в моче, это может иметь самые печальные последствия.
Симптомы злокачественных опухолей мочевого пузыря
Чаще всего признаки злокачественных опухолей мочевого пузыря неспецифичны, в большинстве случаев они бывают вызваны другими заболеваниями. Установить точный диагноз можно только после обследования.

Обычно первый признак рака мочевого пузыря — примеси крови в моче. Они могут окрашивать мочу в оранжевый, розовый, темно-красный цвет. Кровь может появиться один раз, а потом моча несколько недель или месяцев снова выглядит нормально.
Другие возможные симптомы:
- Частые мочеиспускания.
- Боли, рези во время мочеиспусканий.
- Затруднение во время мочеиспускания, слабая струя мочи.
При запущенном злокачественном образовании мочевого пузыря возникают такие симптомы, как боли в пояснице, невозможность помочиться, постоянная слабость и усталость, снижение аппетита и потеря веса, боли в костях, отеки на ногах.
Многие из симптомов, перечисленных выше, возникают при аденоме простаты у мужчин, мочекаменной болезни, отеке слизистой оболочки мочевого пузыря при цистите и других заболеваниях.
Особенности и симптомы рака мочевого пузыря у женщин
Несмотря на различия в строении женской и мужской мочеполовой системы, признаки рака мочевого пузыря у женщин и мужчин не различаются. Есть только один небольшой нюанс: женщины чаще игнорируют кровь в моче, особенно если она появилась незадолго до месячных или во время них. Из-за этого они позже обращаются к врачу.
Некоторые факты:
- Женщины страдают злокачественными опухолями мочевого пузыря реже, чем мужчины.
- Шансы среднестатистической представительницы прекрасного пола заболеть этим онкозаболеванием — 1:88.
- У женщин заболевание обычно диагностируют в более позднем возрасте, чем у мужчин.
- Обычно у женщин обнаруживают менее агрессивные и менее инвазивные опухоли.
- Но если обнаружен запущенный инвазивный рак, шансы выжить у женщины ниже, чем у мужчины.
Особенности рака мочевого пузыря у мужчин
- Мужской пол — фактор риска рака мочевого пузыря. У мужчин заболевание встречается чаще, чем у женщин.
- Шансы мужчины заболеть данной онкопатологией в течение жизни — 1:26.
- У мужчин рак мочевого пузыря обычно диагностируют в более раннем возрасте, чем у женщин, опухоль обычно оказывается более агрессивной и инвазивной.
- У мужчин опухоль может имитировать симптомы аденомы простаты.
Что важно в диагностике рака мочевого пузыря?
Методы диагностики:
- ТУР-биопсия,
- цистоскопия.
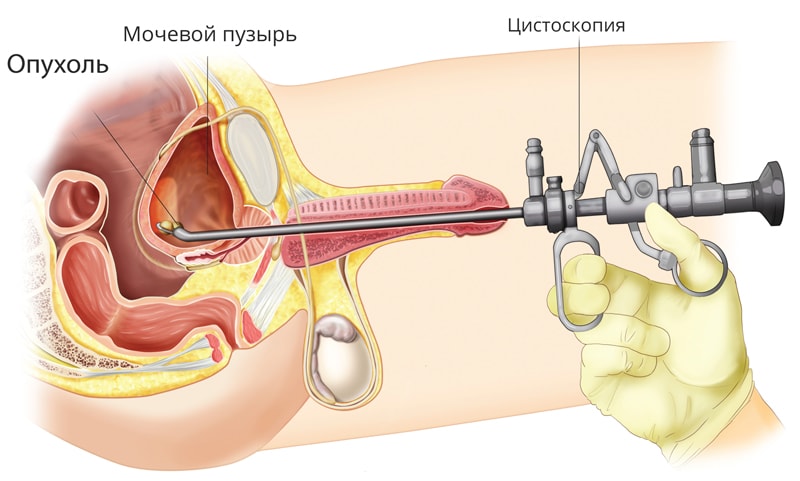
Первое и совершенно необходимое исследование — это цистоскопия. Многие знают про гастроскопию — процедуру осмотра желудка. Практически так же можно определить и цистоскопию — осмотр внутренней поверхности мочевого пузыря.
В Европейской онкологической клинике используются современные цистоскопы Karl Storz и Olympus, процедура выполняется с обезболиванием.
Еще один важный способ диагностики рака мочевого пузыря — ТУР-биопсия. Через мочеиспускательный канал без внешних разрезов вводится специальный инструмент — резектоскоп. Опухоль удаляется в пределах здоровых тканей и отправляется на гистологическое исследование и цитологию мочевого пузыря. И здесь применение фотодинамической диагностики позволяет расширить возможности стадирования: ведь ТУР – это не только диагностика, но в ряде случаев и способ лечения опухоли мочевого пузыря. В синем цвете хирургу видны самые мелкие участки слизистой, пораженных опухолью, для возможности их полного удаления.
Безусловно, важны такие исследования, как компьютерная томография, рентгенография грудной клетки, УЗИ органов брюшной полости. КТ позволяет оценить наличие и размер метастазов, находить пораженные лимфатические узлы, понять, успела ли опухоль выйти за пределы мочевого пузыря и поразить прямую кишку, матку, предстательную железу. Рентгенография грудной клетки делает возможным исключение метастазов в легкие, а УЗИ – в печень.
Методы лечения рака мочевого пузыря
Способ лечения зависит от стадии рака мочевого пузыря. На первых стадиях возможно сохранение мочевого пузыря, хирургическим способом удаляется только сама опухоль. Как было сказано выше, для этого используется ТУР – трансуретральная резекция – операция без каких-либо разрезов, через мочеиспускательный канал. Резко уменьшает количество рецидивов использование фотодинамической диагностики во время ТУР, ведь врач легко видит все пораженные участки мочевого пузыря. После удаления опухоли мочевого пузыря используется внутрипузырная химиотерапия или иммунотерапия: в мочевой пузырь курсами вливается либо химиопрепарат, активный против опухоли, либо вакцина БЦЖ. Введение противотуберкулезной вакцины БЦЖ при раке мочевого пузыря используется в медицине давно и увеличивает безрецидивную выживаемость больных.
Особым случаем является наличие опухоли мочевого пузыря, которая «сидит» прямо на устье мочеточника. Такая опухоль может блокировать отток мочи из почки. Для восстановления функции почки выполняется пункционная нефростомия – установка специальной трубочки в почку для восстановления оттока мочи.
К сожалению, удаление опухоли устья мочеточника сопряжено с обязательным повреждением этого органа. В Европейской онкологической клинике мы предлагаем удаление подобной опухоли при помощи трансуретральной резекции с сохранением мочеточника. Для этого мы пересаживаем мочеточник в верхнюю часть мочевого пузыря лапароскопическим способом, что позволяет избавить пациента от нефростомы.
Если же мы видим, что опухолей много, что имеются метастазы в местные лимфатические узлы, что опухоль слишком глубоко поражает стенку мочевого пузыря, то здесь необходимо решать вопрос об удалении мочевого пузыря и проведении облучения либо системной химиотерапии.
Необходимо понимать, что удаление мочевого пузыря – цистэктомия – это одна из наиболее сложных операций в урологии. Для обеспечения безопасности пациентов, кому показана цистэктомия, в Европейской онкологической клинике создан хирургический блок, отвечающий стандартам безопасности Израиля. Это мощная анестезиологическая и реанимационная служба, операционный зал, оснащенный самым современным оборудованием, позволяющим минимизировать кровопотерю. В блоке интенсивной терапии происходит круглосуточное врачебное наблюдение послеоперационных больных, постоянно мониторируются функции жизненно важных органов.
Как жить без мочевого пузыря, если онкоуролог рекомендует его удаление?
Самый неприятный вариант – удалили мочевой пузырь, а мочеточники вывели на кожу. У пациента нет резервуара для накопления мочи, она выходит в пластиковые мочеприемники, прикрепленные к телу. Качество жизни этих людей оставляет желать лучшего: это постоянный запах мочи, затруднения в гигиенических процедурах, резко повышенный риск инфекции почек, часто – невозможность просто выйти на улицу. Между тем, существует несколько способов создания нового мочевого пузыря, так называемая неоцистопластика. Изолируется участок кишечника, туда пересаживаются мочеточники, создается анастомоз (соединение) с мочеиспускательным каналом. Это позволяет пациенту мочиться как обычно.

Важно знать и понимать, что в лечении рака мочевого пузыря важна не только операция. Комплексный подход, совместные усилия хирурга-онкоуролога, химиотерапевта, радиолога зачастую помогают не только спасти жизнь пациенту, но и сохранить качество его жизни. В Европейской онкологической клинике по поводу каждого пациента с раком мочевого пузыря обязательно проводится консилиум этих специалистов, что позволяет достигнуть хороших результатов. В сложных неоднозначных случаях мы стараемся получить «второе мнение» наших коллег из ведущих университетских клиник Австрии, Германии и Израиля.
Почему при обнаружении маленькой опухоли врач-онкоуролог рекомендует выполнение расширенного обследования костей, печени, легких?
В онкологии нет понятия «маленькая опухоль». Есть понятие «стадия». В довольно большом количестве случаев первичная опухоль не превышает полсантиметра, однако она уже успела «забросать метастазами» отдаленные органы. Если просто удалить опухоль, даже удалить радикально, вместе с мочевым пузырем, то человека убьет метастаз, который вовремя не был выявлен.
Иммунотерапия при раке мочевого пузыря
Иммунотерапия — современное, активно развивающееся направление в лечении онкологических заболеваний, на которое многие врачи и ученые возлагают большие надежды. Применяется она и при злокачественных опухолях мочевого пузыря.
Внутрипузырное введение вакцины БЦЖ практикуется уже более 30 лет. В мочевой пузырь, зачастую после трансуретральной резекции опухоли на ранней стадии, вводят ослабленные туберкулезные палочки. Они не могут вызвать туберкулез, но активируют клетки иммунной системы, которые начинают «замечать» и атаковать опухоль.
Более современное направление в иммунотерапии злокачественных опухолей мочевого пузыря — применение ингибиторов контрольных точек. Контрольные точки — это молекулы, которые использует иммунная система, чтобы не допустить атаки на здоровые ткани. Эти молекулы иногда используют опухолевые клетки, чтобы подавить иммунный ответ. Ингибиторы контрольных точек помогают снять этот блок:
- Блокаторы PD-L1: атезолизумаб (Тецентрик), авелумаб (Бавенсио), дурвалумаб (Имфинзи).
- Блокаторы PD-1: ниволумаб (Опдиво), пембролизумаб (Кейтруда).
Цены в Европейской онкологической клинике на лечение рака мочевого пузыря
- Консультация онколога — 5100 руб.
- Консультация химиотерапевта — 6900 руб.
- Проведение внутрибрюшной химиотерапии (инфузия, без стоимости лекарственных препаратов) — 19100 руб.
- Резекция мочевого пузыря — 61000 руб.
- Резекция мочевого пузыря с резекцией мочеточника — 93800 руб.
- Трансуретральная резекция (ТУР) мочевого пузыря — 120000 руб.
- Расширяющая кишечная пластика мочевого пузыря — 85300 руб.
- Проведение химиотерапии (инфузия, без стоимости лекарственных препаратов) — 15000 руб.
- Проведение иммунотерапии (без стоимости лекарственных препаратов) — 15000 руб.
- Анти PD-1 терапия — 334000 руб.
Источник
