Диагноз экстрофия мочевого пузыря

Экстрофия мочевого пузыря – это порок развития мочеполовой системы, при котором формирование мочевого пузыря и передней брюшной стенки в его проекции остается незавершенным. С рождения наблюдается открытая и вывернутая наружу слизистая оболочка задней стенки мочевого пузыря, а также постоянное отделение и стекание мочи из открывающихся в нижней части органа протоков мочеточников. Экстрофия мочевого пузыря часто сочетается с пороками наружных и внутренних половых органов, мочеточников и почек. Диагностируется по характерным внешним признакам, дополнительно проводится рентгенологическое и УЗИ-обследование. Лечение оперативное, выполняются реконструктивно-пластические и заместительные операции.
Общие сведения
Экстрофия мочевого пузыря – одна из наиболее часто встречаемых аномалий развития мочеполовой системы. Частота в популяции – 1 случай на 30-50 тысяч новорожденных, примерно 1/5 часть пациентов имеет сочетанные пороки развития. В большей степени страдают мальчики, по данным разных авторов распространенность патологии среди них в 2-6 раз выше, чем среди девочек.
Специалисты в сфере педиатрии и хирургии сталкиваются с большими трудностями в лечении экстрофии мочевого пузыря, хотя первые операции для коррекции этой аномалии были предложены еще в 1960-х годах. Реконструкция и пластика не приводят к излечению. Сохраняющееся недержание мочи значительно ухудшает качество жизни ребенка, а частые восходящие инфекции становятся причиной хронической почечной недостаточности, представляющей серьезную опасность для жизни.
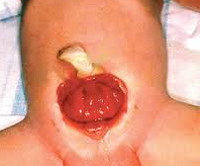
Экстрофия мочевого пузыря
Причины
Конкретной причины данной аномалии развития не выявлено, патология считается мультифакториальной. Доказана генетическая предрасположенность к некоторым сочетанным порокам органов брюшной полости, в числе которых присутствует и экстрофия мочевого пузыря. Кроме того, повышает риск развития аномалии воздействие различных токсических и инфекционных агентов во время беременности, в частности, курение, внутриутробные инфекции, некоторые медикаменты и т. д. Травмы плода также могут способствовать нарушению правильного эмбриогенеза с развитием пороков.
Патогенез
Основной патогенетический момент экстрофии мочевого пузыря – задержка обратного развития клоакальной перегородки, которая препятствует внедрению мезодермального листка между наружным и внутренним эмбриональными слоями. Это приводит к тому, что процесс формирования стенок мочевого пузыря оказывается незавершенным, и орган остается открытым и вывернутым наружу. Описанные процессы в норме протекают на 4-6 неделе эмбрионального развития, поэтому воздействие тератогенных факторов наиболее опасно в самом начале беременности. Впрочем, это касается не только экстрофии мочевого пузыря, но и большинства пороков развития.
Симптомы
Проявления порока визуально заметны сразу после рождения. Неонатолог при осмотре новорожденного обращает внимание на ярко-красную слизистую оболочку мочевого пузыря, которая замещает отсутствующую часть передней брюшной стенки. Слизистая, как правило, имеет обычную морфологию, но возможно и псевдопапилломатозное изменение. В нижней части заметны отверстия мочеточников, из которых постоянно выделяется моча.
С течением времени основной проблемой при экстрофии мочевого пузыря становится раздражение окружающих тканей мочевыми солями, постоянная мацерация вокруг открытого участка и в области бедер. Инфицирование слизистой оболочки мочевого пузыря является причиной восходящей инфекции мочеточников и почек.
Экстрофия мочевого пузыря часто сочетается с аномалиями верхних мочевыводящих путей. Кроме того, экстрофии всегда сопутствует расхождение лобкового симфиза. Вследствие анатомических различий у мальчиков и девочек наблюдаются разные изменения в соседних органах. У мальчиков встречается расщепление пещеристых тел или их редукция, у девочек – расщепление клитора, аномалии развития влагалища.
Диагностика
В последние годы активно развиваются методы антенатальной диагностики данного порока. Экстрофия мочевого пузыря может быть заметна уже на втором УЗИ-скрининге, однако такое случается не всегда. Часто аномалия развития обнаруживается только после рождения. Поскольку симптоматика специфична, диагноз не вызывает сомнений.
Обязательно проведение рентгенографии брюшной полости для выявления сочетанных пороков, в первую очередь, в мочевыделительной системе, но также в кишечнике и спинном мозге (наиболее характерные сочетания с экстрофией мочевого пузыря). С этой же целью проводится УЗИ. Рекомендована экскреторная урография, которая позволяет убедиться в целостности и правильном развитии мочеточников и почек.
Лечение экстрофии мочевого пузыря
Лечение оперативное. Тип операции зависит от степени экстрофии мочевого пузыря, а именно – от размеров вывернутой части органа и, соответственно, отсутствующего сегмента передней брюшной стенки, а также от сопутствующих пороков развития. Если размер дефекта не превышает 4 см, проводится реконструктивно-пластическое вмешательство, цель которого – закрытие дефекта с помощью близлежащих тканей и восстановление целостности мочевого пузыря. Этого достаточно, поскольку гистологически орган развит правильно, несмотря на патологию в анатомии.
В случае больших размеров дефекта создается искусственный мочевой пузырь, который может выполнять функцию резервуара и опорожняться по желанию. Также часто мочеточники выводятся в сигмовидную кишку (уретеросигмостомия) – это обязательная мера в случае их расщепления.
Большую проблему для детских хирургов представляет расхождение костей таза при экстрофии мочевого пузыря. Накопленный врачебный опыт говорит о высокой частоте неудовлетворительных результатов операций, что связано с большим количеством сочетанных пороков и значительным дефектом передней брюшной стенки.
Прогноз и профилактика
Прогноз для выздоровления сомнительный. Неоперированные пациенты редко доживают до 10 лет. Что касается успеха оперативного лечения, то 20-80% проведенных вмешательств приводят лишь к незначительному улучшению. Нарушения уродинамики продолжают прогрессировать, сохраняется недержание. Риск развития восходящей инфекции остается высоким.
Профилактика экстрофии мочевого пузыря возможна в антенатальном периоде, еще лучше – на этапе планирования беременности, чтобы максимально исключить воздействие тератогенных факторов, особенно на этапе закладки основных органов и систем, то есть в первые 4-8 недель внутриутробного развития.
Источник

УЗИ сканер WS80
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Введение
Экстрофия мочевого пузыря (ЭМП) – редкий тяжелый врожденный порок развития нижних мочевых путей, характеризующийся отсутствием передней брюшной стенки и передней стенки мочевого пузыря, а также расхождением лонного сочленения (диастаз). Через дефект передней брюшной стенки пролабирует слизистая оболочка. В нижней части обнаженной слизистой оболочки расположены устья мочеточников, из которых постоянно выделяется моча. Пуповина впадает низко в верхний край дефекта передней брюшной стенки.
Экстрофийные пороки нижних мочевых путей делят на классическую экстрофию мочевого пузыря и экстрофию клоаки. У мальчиков экстрофия мочевого пузыря сочетается с расщеплением мочеиспускательного канала (эписпадия). Экстрофия мочевого пузыря у девочек сопровождается расщеплением клитора, расщеплением или отсутствием мочеиспускательного канала, а также спайками больших и малых половых губ [1, 2].
В литературе экстрофия мочевого пузыря чаще всего описывается в комплексе с эписпадией, хотя имеются сообщения об изолированном поражении стенки мочевого пузыря, когда его шейка и мочеиспускательный канал сформированы. Такая патология называется неполной экстрофией, или переднепузырным свищом. При неполной экстрофии патология половых органов отсутствует [3, 4]. Наиболее тяжелой и редкой формой порока является экстрофия клоаки, при которой расщепление распространяется не только на урогенитальную область, но и на терминальный отдел кишечника [5, 6].
Впервые экстрофию мочевого пузыря, как врожденный порок развития, описал Schenk von Grafenberg в 1597 г. В 1780 г. Chaussier впервые использовал термин “экстрофия”. Упоминания об экстрофии мочевого пузыря обнаружены на ассирийских табличках, сделанных 2000 лет до н. э. [7]. Частота экстрофии мочевого пузыря составляет 0,25-0,5 на 10 тыс. новорожденных. Соотношение классической экстрофии мочевого пузыря у мальчиков и девочек 3:1 [1, 8]. При экстрофии мочевого пузыря встречаются сопутствующие врожденные аномалии – паховые грыжи (у 56 % мальчиков, у 15 % девочек), крипторхизм (20 %), колоректальные аномалии (1,8 %) и др. [1, 2]. Экстрофия мочевого пузыря может входить в состав комплекса OEIS (omphalocele, extrophy, imperforate anus, spinal defects), OMIM 258040.
Пренатальная диагностика экстрофии мочевого пузыря возможна уже при первом скрининговом обследовании в 11-14 нед беременности, когда в норме полость мочевого пузыря начинает наполняться мочой. Визуализация мочевого пузыря обязательно входит в стандартные протоколы исследования пренатального скрининга.
Эмбриопатогенез
Экстрофия мочевого пузыря формируется на 4-5-й неделе эмбриогенеза, когда на 28-32-й день происходит каудальная миграция мембраны клоаки. В то же время формируется передняя брюшная стенка, однако если мезенхима не переходит из одного клеточного слоя нижней брюшной стенки в другой, то это приводит к нестабильности клоакальной мембраны. Преждевременный разрыв мембраны клоаки приводит к комплексу “подпупочных” аномалий. Разрыв клоакальной мембраны после полного разделения “урогенитальной” части от пищеварительного тракта приводит к формированию классической экстрофии мочевого пузыря.
Если повреждение мембраны происходит до того, как спускается уроректальная перегородка, тогда это приводит к вывороту нижнего уретрального тракта и части пищеварительного тракта с формированием клоакальной экстрофии. Генетические факторы, связанные с экстрофией мочевого пузыря, на сегодняшний день не выявлены, однако существует гипотеза, что потеря экспрессии р63 из-за полиморфизмов очередности у промотера является фактором риска развития экстрофии мочевого пузыря [1, 9].
Ниже представлен случай диагностики экстрофии мочевого пузыря в III триместре беременности.
Материал и методы
Пациентка С.,18 лет, настоящая беременность первая, от первого брака, супруги соматически здоровы, профессиональных вредностей не имеют, наследственность не отягощена. На учете в женской консультации пациентка состояла с 9 нед беременности. Беременность протекала без осложнений. При скрининговом УЗ-исследовании в I и II триместрах по месту жительства ВПР и УЗ-маркеров хромосомных перестроек у плода не обнаружено.
При УЗ-обследовании в 34 нед беременности в женской консультации по месту жительства было обнаружено образование средней эхогенности размером 28x23x25 мм в области нижних отделов передней брюшной стенки. Женщина была направлена в медикогенетическое отделение МОНИИАГ с диагнозом: “ВПР плода, экстрофия мочевого пузыря?”.
УЗ-исследование проводилось на сканере WS80A (компании Samsung Medison) с использованием объемного датчика CV1-8A.
Результаты
При УЗ-исследовании обнаружен один живой плод женского пола в головном предлежании. Гестационный срок составил 34,4 нед. Фетометрические показатели плода соответствовали данному сроку. Патологических изменений плаценты и околоплодных вод не выявлено. При исследовании мочевой пузырь в типичном месте не визуализировался.
В нижних отделах передней брюшной стенки в надлобковой области визуализировалось эхогенное образование размером 30x28x25 мм (рис. 1, 2). Определялось низкое впадение пуповины. Почки плода визуализировались в типичном месте, без структурных изменений. Патологических изменений других органов не было выявлено.

Рис. 1. Эхогенное образование в нижнем отделе передней брюшной стенки (экстрофированный мочевой пузырь).

Рис. 2. Экстрофия мочевого пузыря в сочетании с отсутствием видимой патологии наружных половых органов (режим трехмерной реконструкции).
Поставлен диагноз: “Беременность 34,4 нед. ВПР плода – экстрофия мочевого пузыря”.
Обсуждение
Пренатальными УЗ-признаками экстрофии мочевого пузыря являются: отсутствие визуализации мочевого пузыря при нормальном количестве околоплодных вод, структурно неизмененные почки, визуализация эхогенного образования в надлобковой области, аномалии строения половых органов. Использование ЦДК является дополнительным инструментом для диагностики экстрофии мочевого пузыря. В норме пупочные артерии проходят вдоль стенки мочевого пузыря при поперечном сканировании нижней части живота. Для экстрофии мочевого пузыря характерно низкое впадение пуповины, при котором артерии охватывают образование в надлобковой области. При отсутствии визуализации мочевого пузыря в типичном месте необходимо провести повторное сканирование через 30-40 мин для адекватной оценки его расположения и степени наполнения.
Изолированная экстрофия мочевого пузыря, как правило, не сочетается с хромосомными перестройками у плода и не требует пренатального кариотипирования.
В данном клиническом наблюдении экстрофия мочевого пузыря была диагностирована у плода женского пола, что встречается значительно реже, чем у плодов мужского пола. Кроме того, отсутствие выраженной деформации наружных половых органов позволяет предположить неполную форму экстрофии. Оценка анатомии мочевого пузыря включена в протокол обязательного скринингового обследования во всех триместрах беременности. Отсутствие визуализации мочевого пузыря в типичном месте должно насторожить врачей УЗ-диагностики. Однако часто экстрофия мочевого пузыря диагностируют лишь в III триместре беременности.
После рождения детям с экстрофией мочевого пузыря требуется многоэтапная сложная хирургическая коррекция. Процент неудовлетворительных отдаленных результатов, к сожалению, остается на сегодняшний день очень высоким, как правило, вследствие присоединения таких осложнений, как нарушение функции тазовых органов: недержание мочи, рубцовая деформация половых органов, половая дисфункция, выраженная деформация передней брюшной стенки, уретерогидронефроз III-IV степени, непрерывно рецидивирующий пиелонефрит со снижением функции почек, хроническая почечная недостаточность и др. [4, 7]. Огромной и сложной проблемой остается медико-социальная реабилитация больных с экстрофией мочевого пузыря.
Заключение
Сложности ранней диагностики связаны с невыраженными УЗ-проявлениями достаточно тяжелой патологии. Четкое соблюдение алгоритма скрининговых УЗ-исследований анатомии плода в 11-14 и 20-22 нед беременности позволяет диагностировать экстрофию мочевого пузыря. При выявлении экстрофии мочевого пузыря у плода необходимо проведение медико-генетического консультирования с оформлением пренатального консилиума. Требуется тщательное разъяснение родителям сути выявленной патологии, а также информация о частых послеоперационных отдаленных последствиях и осложнениях как физического, так и психогенного генеза.
Литература
- Лопаткин Н.А., Пугачев А.Г. Пороки развития мочевого пузыря и уретры. В кн. Детская урология. Руководство. М.: Медицина, 1986. С. 207-242.
- Gearhart J.P. Criteria for the prenatal diagnosis of classic bladder exstrophy / J.P. Gearhart, J. Ben-Chaim, R.D. Jeffs // Obstet. Gynecol. 1995. Jun. 1. V. 85. № 6. P. 961-964.
- Михельсон А.И. Оперативное лечение недержания мочи на почве врожденных аномалий мочевой системы. Минск, Госсиздат БССР. 1957.
- Осипов И.Б. Реконструктивно-пластические операции при экстрофии мочевого пузыря у детей: автореф. дисс. докт. мед. наук. СПб, 1996.
- Ахунзянов А.А. Диагностика и лечение врожденной клоаки у детей // Хирургия. 1976. № 9. С. 98-101.
- Захаров Н.Л. Дефекты передней брюшной стенки у новорожденных // Хирургия. 1986. № 6.
- Hollowell J.G., Ransley P.G. Surgical management of Incontinence in bladder exstrophy // Brit. J. Urol. 1991. V. 68. № 5. P. 543-548.
- Kockum C.C., Hansson E.E., Stenberg A.et. al. Bladder exstrophy in Sweden-a long-term follow-up study // Eur. J. Pediatr. Surg. 1996. V. 6. P. 208-211.
- Баиров Г.А., Ахметджанов И.А., Осипов И.Б. Реконструктивно-пластические операции при экстрофии мочевого пузыря у детей // Вестник хирургии. 1986. Т. 136. № 6. С. 105-108.

УЗИ сканер WS80
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Источник
Экстрофия мочевого пузыря (происходит от греческого слова “ekstrophe”, что означает смещение, выворачивание, выворот мочевого пузыря) – это врождённый порок развития мочевого пузыря, при котором мочевой пузырь оказывается не внутри, а снаружи. Передняя стенка мочевого пузыря отсутствует, как и соответствующий ей участок брюшной стенки, которая расщеплена, и таким образом мочевой пузырь оказывается вовне. Моча льётся наружу через отверстия мочеточников. Имеется эписпадия уретры.
За исключением мочеполовой системы дети с экстрофией ничем не отличаются от других детей и развиваются так же, как их сверстники.
Какие аномалии характеризуют экстрофию?
- Эписпадия: у мальчиков мочеиспускательный канал и головка члена расщеплены по дорсальной поверхности, у девочек уретра также не сформирована, а её выход расположен между расщепленным клитором и разведенными малыми половыми губами.
- Кавернозные тела укорочены за счёт разошедшихся в стороны лонных костей.
- Отсутствует шейка мочевого пузыря и сфинктер. Шейка мочевого пузыря представляет собой нижнюю часть мочевого пузыря в форме некой чаши (лейки), которая содержит кольцо из мышц, открывающих и закрывающих выход мочи из пузыря. Именно эта группа мышц (сфинктер) делает возможным контроль над мочеиспусканием.
- Маленький объём мочевого пузыря.
- Неправильное расположение мочеточников (выводных трубок, по которым моча выводится из почек в мочевой пузырь): мочеточники иначе, нежели это нужно, располагаются на входе в мочевой пузырь, что приводит к рефлюксу (обратному забросу мочи из мочеточников в почки).
- Расхождение лонных костей.
- Положение ануса выше, чем обычно: выход прямой кишки расположен ближе к мошонке (влагалищу у девочек), что обычно никак не отражается на функции кишечника.
- Пупок с рождения расположен более низко, часто слабо различим; при необходимости хирурги могут сформировать новый красивый пупочек в «правильном» месте.
Образование
Состояние экстрофии образуется очень рано во время развития эмбриона, примерно на 4-5 неделях его развития. Причины неправильного развития пока не до конца ясны. Именно в это время начинают формироваться органы и ткани организма из разъединяющихся, делящихся и соединяющихся клеток. Одна из теорий предполагает, что именно из-за какого-то неправильного механизма такого деления и соединения клеток, что-то происходит с клоакальной мембраной, что не даёт ей закрыться, и это приводит к тому, что мочевой пузырь оказывается вне брюшной полости. Другая теория предполагает, что на этом этапе развития эмбриона слой клеток над мочевым пузырем очень тонок, он не может удержать мочевой пузырь внутри и расщепляется, опять же мочевой пузырь оказывается снаружи.
Комплекс экстрофия-эписпадия представляет собой спектр врождённых пороков развития, который включает классическую экстрофию мочевого пузыря, эписпадию, клоакальную экстрофию и ещё несколько вариантов. Считается, что каждая из этих аномалий – результат одной и той же по своей природе эмбриональной ошибки (дефекта).
Каудальная миграция мембраны клоаки – перегородки, отделяющей полость задней/каудальной кишки зародыша происходит в первом триместре примерно в то же время, когда созревает передняя брюшная стенка. Мезенхима (зародышевая соединительная ткань) не переходит из одного клеточного кожного слоя нижней брюшной стенки в другой, что приводит к нестабильности клоакальной мембраны.
Преждевременный разрыв мембраны клоаки приводит к этому комплексу «подпупочных» аномалий. При этом разрыв клоакальной мембраны после полного разделения «уретро-половой» части от желудочно-кишечного тракта приводит к классической экстрофии мочевого пузыря, а если повреждение мембраны происходит до того, как спускается эта уро-ректальная перегородка, тогда это приводит к вывороту нижнего уретрального тракта и части желудочно-кишечного тракта (клоакальная экстрофия).
Вероятность
Экстрофия считается довольно редким пороком и в среднем рождается 1 ребёнок с экстрофией на 30 000 новорождённых (частота может колебаться от 10 000 до 50 000). Тем не менее она может повторяться в семье. Так, вероятность рождения ещё одного ребёнка с экстрофией у тех же родителей по данным ABC составляет 1 к 100, а вероятность рождения ребёнка с экстрофией у экстрофика составляет 1 к 70. Кроме того вероятность рождения мальчика с экстрофией в 2-3 раза превышает вероятность рождения девочки с экстрофией.
Экстрофия может встречаться у близнецов, но если они разнояйцевые, неизвестны случаи, чтобы оба ребёнка были затронуты.
Клоакальная экстрофия. Вероятность рождения ребёнка с клоакальной экстрофией составляет 1 к 200 000 живых новорождённых и гораздо меньше среди девочек. Это нарушение гораздо сложнее классической формы экстрофии и требует очень серьёзной оценки ассоциированных пороков развития нервной системы, верхней части мочевыводящей системы и желудочно-кишечного тракта. С большой вероятностью может потребоваться регулярная катетеризация.
Степень экстрофии
Степень экстрофии зависит от того, насколько велика или мала площадка экстрофированного мочевого пузыря. Считают, что экстрофия включает в себя спектр состояний от «простой» эписпадии до клоакальной экстрофии, где-то посередине по степени тяжести находится классическая форма экстрофии. Кроме того экстрофия может быть «частичной» (без эписпадии), может быть два пузыря (один «нормальный», а второй экстрофированный), а иногда с экстрофией у ребёнка могут быть так называемые «сочетанные» патологии.
Лечение экстрофии
Лечение экстрофии хирургическое. План лечения зависит от степени и типа порока. Каждый план лечения очень индивидуален, так как нет двух детей с экстрофией, полностью идентичных. Лечение экстрофии у детей значительно эволюционировало и продолжает совершенствоваться.
Последние 3 десятилетия пластика мочевого пузыря стала довольно распространенным вмешательством, особенно в связи с тем, что все более часто появлялись сообщения об осложнениях операций отведения мочи в кишку. Однако добиться удержания мочи у большинства пациентов с экстрофией мочевого пузыря, остается по-прежнему очень сложной проблемой, решить которую чрезвычайно трудно.
Этапы лечения
В настоящее время лечение может включать серию операций в течение нескольких лет – так называемая «поэтапная реконструкция». Время, вид и характер операций, которые потребуются, зависят от конкретной ситуации и могут различаться в каждом конкретном случае.
Классическими этапами лечения экстрофии являются:
- Первичное закрытие экстрофии. Мочепузырную площадку моделируют таким образом, чтобы сформировать шар (мочевой пузырь), который мог бы держать мочу, его помещают внутрь таза, закрывают переднюю брюшную стенку. Выполняют первичное удлинение кавернозных тел у мальчиков. Может быть выполнено сведение лонных костей (аппроксимация либо остеотомия). В настоящее время считается, что сведение лона не всегда является обязательной процедурой, и может быть выполнено по показаниям при большом диастазе лонных костей.
- Пластика половых органов может быть выполнена в разное время у девочек и у мальчиков. У девочек пластика половых органов и уретры (реконструкция эписпадии) может быть выполнена одновременно с закрытием мочевого пузыря на первом этапе. У мальчиков фалло и уретропластика обычно выполняется между первым и вторым годами жизни, но может быть выполнена и позже. Некоторые хирурги предпочитают выполнять данный этап одновременно с первым.
- Пластика шейки мочевого пузыря позволяет достичь контроля над мочеиспусканием. Обычно выполняется в возрасте не ранее 5-6 лет при достаточном объёме мочевого пузыря (не менее 80-100 мл) . Также во время этой операции проводят пересадку мочеточников для предотвращения пузырномочеточникового рефлюкса.
Аугментация (увеличение) мочевого пузыря кишечным лоскутом и необлэддер
Если очевидно, что качество мочевого пузыря неудовлетворительное, что он не растет и не может выполнять свою прямую функцию, тогда выполняется аугментация. Аугментация подразумевает увеличение мочевого пузыря (или формирование полностью нового пузыря) из ткани кишечника (толстой или тонкой, очень редко желудка или мочеточников). Если мочепузырная площадка слишком мала, то выполняется полностью новый мочевой пузырь из кишечной ткани (необлэддер).
При этом требуется постоянная катетеризация через катеризационный канал (сухая удерживающая стома).
Медицина не стоит на месте и методы проведения аугментации продолжают совершенствоваться с целью достичь наилучшего результата у детей.
Существует несколько вариантов аугментации и их особенности необходимо обсуждать с оперирующим хирургом.
Удерживающая (континентная) стома
Удерживающая стома – это сухая стома, представляющая собой трубчатый орган (канал), соединяющий мочевой пузырь с поверхностью живота.
Она нужна для опорожнения мочевого пузыря в случаях, когда пациент не может опорожнять мочевой пузырь естественным транстуретральным способом. Также она нужна в случаях, если пациент имеет остаточную мочу в больших количествах.
Процедуры чистой первичной катетеризации проводятся несколько раз в день (обычно 5-6), являются безболезненными.
Также требуются регулярные промывания мочевого пузыря через стому для снижения рисков инфекций, образования камней и онкорисков, т.к. аугментация мочевого пузыря и катетеризация являются факторами риска данных состояний.
Первичная пластика мочевого пузыря
Цели первичного закрытия мочевого пузыря следующие:
- Ротация безымянных костей для сведения лонных костей и замыкания диафрагмы таза.
- Закрытие пузыря и смещение его в заднее положение в полость малого таза.
- Обеспечение свободного выделения мочи через уретру.
- Мобилизация кавернозных тел от костей таза для первичного удлинения полового члена.
- Закрытие дефекта передней брюшной стенки.
В случае рождения ребёнка с экстрофией мочевого пузыря, в соответствии с международными стандартами, коррекцию данного порока целесообразно выполнить в ранние сроки (первые 2-3 суток после рождения). Столь ранние операции обусловлены возможностью сведения костей лона у больных с экстрофией мочевого пузыря без остеотомии (пересечения подвздошных костей) – пока кости остаются пластичными. Сведение лонных костей обеспечивает лучший эффект удержания мочи, что является наиболее сложной задачей подобных операций.
Оперативные вмешательства в более поздние сроки, через 1 месяц и далее требуют проведения той же операции в сочетании с остеотомией по типу Хиари, что значительно травматичнее и сопровождается в несколько раз более сложным и продолжительным восстановительным периодом.
Именно поэтому во всем мире больные с экстрофией мочевого пузыря концентрируются в крупных клиниках имеющих большой опыт проведения подобных операций. Данный подход позволяет достигнуть лучших результатов лечения столь тяжёлой патологии[2].
Примечания
Ссылки
- The Association for the Bladder Exstrophy
- Exstrophy of the Bladder and Epispadias - Children’s Hospital Boston
- Сайт об экстрофии мочевого пузыря и эписпадии
- Экстрофия мочевого пузыря
Литература
- Шимкевич В. М.,. Экстрофия мочевого пузыря // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). – СПб., 1890-1907.
Эта страница в последний раз была отредактирована 14 января 2021 в 11:34.
Источник
