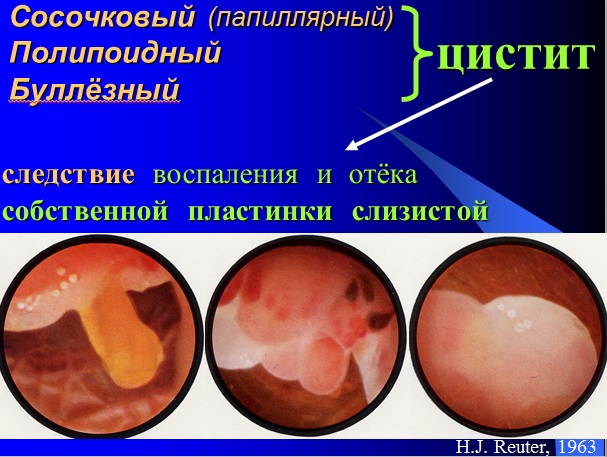
Цистит с гнездами фон брунна
Рак мочевого пузыря классификация, диагностика, принципы лечения
Факторы риска
Производственные вредности (ариламины) – производство красителей, резиновая и текстильная промышленность.
Курение – ариламины в составе табачного дыма (в т.ч. «легких» сигарет).
Риск развития опухолей мочевого пузыря у курильщиков в 2-3 раза выше, чем у некурящих.
Ятрогенные воздействия (цитостатики, радиоиндуцированные опухоли)
РМП – обычно переходноклеточный рак –
рак из уротелия, выстилающего:
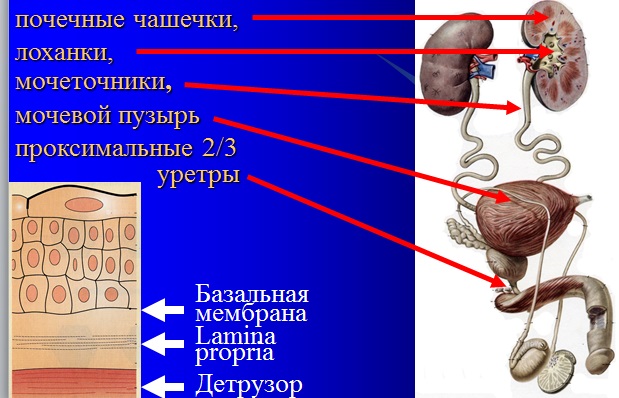
Характерная черта опухолей из переходного эпителия (уротелия) – множественность очагов поражения (мультицентричность).
В процессе диагностики, лечения РМП и диспансерного наблюдения
необходимо представлять состояние выше- и нижележащих отделов
мочевыводящих путей.
Основные морфологические разновидности опухолей МП
- Переходноклеточная (уротелиальная) карцинома > 90%
- Плоскоклеточная карцинома – 5%
- Железистые карциномы < 5%
- Низкодифференцированные карциномы < 5%
- Неэпителиальные опухоли (саркомы, меланомы, лимфомы) < 5%
70 – 80% уротелиальных опухолей диагностируются на неинвазивных стадиях, причем 30-85% поверхностных опухолей рецидивируют после первичного лечения;
10 – 30% поверхностных опухолей прогрессируют в мышечно-инвазивные и метастатические карциномы.
20 – 30 % уротелиальных опухолей уже при выявлении характеризуются инвазивным ростом
Молекулярная патология
Гистологическая классификация опухолей мочевого пузыря, принятая ВОЗ в 1973 году (F.K.Mostofi), наиболее популярна и в наши дни.
Классификация отражает многообразие опухолей, эпителиальных аномалий и опухолеподобных поражений.
Без учета предусмотренных классификацией патологических процессов невозможна дифференциальная диагностика РМП (клиническая и морфологическая).
1.Эпителиальные опухоли
А. Переходноклеточная папиллома
Б. Переходноклеточная папиллома,
инвертированный тип.
В. Плоскоклеточная папиллома
Г. Переходноклеточный рак
Д. Варианты переходноклеточного рака
С плоскоклеточной метаплазией
С железистой метаплазией
С плоскоклеточной и железистой
метаплазией
Е. Плоскоклеточный рак
Ж. Аденокарцинома
З. Недифференцированный рак
- Неэпителиальные опухоли
А. Доброкачественные
Б. Злокачественные
Рабдомиосаркома
Прочие
3. Смешанная группа опухолей
А. Феохромоцитома
Б. Лимфомы
В. Карциносаркома
Г. Меланома
Д. Другие новообразования
- Неопухолевые изменения эпителия
(эпителиальные аномалии)
А. Сосочковый (полипоидный) цистит
Б. Гнёзда фон Брунна
В. Кистозный «цистит»
Г. Железистая метаплазия
Д. «Нефрогенная» аденома
Е. Плоскоклеточная метаплазия
ВОЗ гистологическая классификация опухолей мочевыводящих путей (2004)
Уротелиальные опухоли
- Инфильтрирующая уротелиальная карцинома 8120/3
- С плоскоклеточной дифференцировкой
- С железистой дифференцировкой
- С трофобластической дифференцировкой
- Гнездная
- микрокистозная
- Микропапиллярная 8131/3
- лимфоэпителиомоподобная 8082/3
- Лимфомоподобная
- Плазмоцитоидная
- Саркоматоидная 8122/3
- Гигантоклеточная 8031/3
- Недифференцированная 8020/3
Неинвазивные уротелиальные неоплазии
- Уротелиальная карцинома in situ 8120/2
- Неинвазивная папиллярная уротелиальная карцинома, высокий грейд 8130/23
- Неинвазивная папиллярная уротелиальная карцинома, низкий грейд 8130/21
- Неинвазивная папиллярная уротелиальная неоплазма с низким потенциалом злокачественности 8130/1
- Уротелиальная папиллома 8120/0
- Инвертированная уротелиальная папиллома 8121/0
Плоскоклеточные неоплазмы
- Плоскоклеточная карцинома 8070/3
- Веррукозная карцинома 8051/3
- Плоскоклеточная папиллома 8052/0
- Железистые неоплазмы
- Аденокарцинома 8140/3
- Кишечного типа
- Муцинозная 8480/3
- Перстневидноклеточная 8490/3
- Светлоклеточная 8310/3
- Ворсинчатая аденома 8261/0
Нейроэндокринные опухоли
- Мелкоклеточная карцинома 8041/3
- Карциноид 8240/3
- Параганглиома 8680/1
Меланоцитарные опухоли
- Злокачественная меланома 8720/3
- Невус
Мезенхимальные опухоли
- Рабдомиосаркома 8900/3
- Лейомиосаркома 8890/3
- Ангиосаркома 9120/3
- Остеосаркома 9180/3
- Злокачественная фиброзная гистиоцитома 8830/3
- Лейомиома 8890/0
- Гемангиома 9120/0
- Прочие
Опухоли гемопоэтической и лимфоидной ткани
- Лимфома
- Плазмоцитома 9731/3
Разнообразные опухоли
- Карцинома из желез Skene, Cowper и Littre
- Метастатические опухоли и опухоли, распространяющиеся из других органов
Ни один из аспектов патологии МП не вызывает такого количества разногласий, как отношение к переходноклеточной папилломе.
(D.J. Grignon, 1997)
Вероятно, имеются ДВА процесса, сходных по цистоскопической картине и формальным морфологическим критериям:
- ПЕРЕХОДНОКЛЕТОЧНАЯ ПАПИЛЛОМА
- НЕИНВАЗИВНАЯ ПАПИЛЛЯРНАЯ КАРЦИНОМА
Переходноклеточная папиллома
- не > 2-3% опухолей мочевого пузыря
- обычно одиночная
- тонкая нежная ворсина, покрытая неизменённым переходным эпителием, насчитывающим не > 6 слоёв клеток
Инвертированная папиллома – следствие пролиферации базального слоя клеток уротелия в сторону собственной пластинки слизистой.
- < 1% опухолей МП
- в 6-7 раз чаще у мужчин
- плотный узел, серовато-белый,
с гладкой блестящей поверхностью
- клинически – макрогематурия
- после ТУР обычно не рецидивирует

Гнёзда фон Брунна
- чётко очерченные скопления клеток уротелия в толще собственной пластинки слизистой (lamina propria)
- “эпителиальная аномалия”
- частота выявления (по материалу аутопсий)
достигает 85-95%
- цистоскопически слизистая шероховатая,
неровная – “зернистый” или “гранулярный”
цистит
Железистый цистит (cystitis glandularis)
- следствие железистой метаплазии эпителия гнёзд фон Брунна
- частота выявления (по материалу аутопсий) достигает 70%
- железы выстланы цилиндрическим или кубическим эпителием
Железистый цистит
Железистый цистит с явлениями кишечной метаплазии (бокаловидные клетки) – увеличение риска возникновения злокачественных опухолей МП
- формирование мелких кистозных полостей в результате дегенеративных изменений центрально расположенных клеток гнёзд фон Брунна
- частота выявления достигает 60%
- цистоскопически – полупрозрачные кисты перламутрово-белого или желто-коричневого цвета диаметром не > 5мм
Плоскоклеточная метаплазия уротелия
– мнения об отношении к РМП противоречивы
– вероятно, термин применяется для обозначения различных по этиологии, патогенезу и прогнозу состояний
1. Участки МПЭ без ороговения, выявляемые в стенке МП у практически
здоровых женщин в 36-86%
– вариант нормы, отражающий особенности гормонального фона
– при цистоскопии – бледные серовато- белые островки, иногда окружены зоной гиперемии
– если имеется дизурия (императивные позывы, учащенное мочеиспускание), процесс именуют псевдомембранозным тригонитом
2. Плоскоклеточная метаплазия с выраженным ороговением – лейкоплакия
- защитная реакция на хроническое воспаление или повреждение (конкременты, дренажи и т.п.)
- по классификации ВОЗ-неопухолевый процесс, однако риск развития РМП на фоне лейкоплакии возрастает, особенно при явлениях акантоза и дисплазии уротелия
- лейкоплакия при шистозомиазе предшествует
плоскоклеточному РМП
- цистоскопически – серовато – белые бляшки, возвышающиеся над уровнем слизистой
Плоскоклеточный рак, ассоциированный с шистозоматозом
Основная специфическая черта
переходноклеточной
карциномы МП –
– зависимость клинического течения, прогноза и лечебной тактики от
инвазии
опухоли в мышечный слой
– макрогематурия
– дизурия
– боли (над лобком, в промежности,
в области крестца)
-уретеропиелоэктазия гидронефроз
пиелонефрит
почечная недостаточность
может быть абсолютно нормальной,
либо выявлять участки
«мшистой», «гранулярной»
или «бархатистой» слизистой
Цитологическое исследование
осадка мочи
Антиген опухолей МП (ВТА) 74 73
Протеин ядерного
матрикса (NMP-22) 53 60
Продукты деградации
фибриногена (FDP) 52 91
Уровень теломеразы 70 99
Цитокератин (СК20) 86 96
Метод флюоресцентной
in situ гибридизации (FISH) 81 96
Ультразвуковая томография
(трансабдоминальная, трансректальная,
трансвагинальная, трансуретральная)
-Та – неинвазивная папиллярная
– Тis – интраэпителиальный рак,
«плоская опухоль»
-Т1 – инфильтрация ограничена
субэпителиальной
соединительной тканью
Как правило, поверхностные опухоли
– характеризуются более
благоприятным прогнозом
– требуют менее обширных
хирургических вмешательств
Уретерокутанеостомия
(выведение мочеточников на кожу)
Традиционное мнение:
Не обеспечивает приемлемого
качества жизни
Необходимость постоянных
интубационных дренажей
Камнеобразование
Прогрессирование пиелонефрита
Уретеросигмостомия
(имплантация мочеточников в сигмовидную кишку)
Осложнения:
Гиперхлоремический и
гипокалиемический ацидоз
Восходящая инфекция
Стриктуры мочеточников
Почечная недостаточность
Операция Брикера
(илеальный кондуит)
Мочевой резервуар из илеоцекального отдела кишечника
Робот блога считает, что это может быть вам интересно
- Диагностика синдрома слабости у онкологических пациентов
- ОСНОВНЫЕ ПРИНЦИПЫ ХИМИОТЕРАПИИ
- Микробиологические основы химиотерапии инфекционных заболеваний
- Химиотерапия при раке. Химиотерапия злокачественных опухолей.
- Хирургическое лечение амелобластом нижней челюсти
- Онкология, рак спинного мозга
- Онкология, заболевания рака у детей лечение, симптомы, диагностика
- МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ ПОЧЕК И МОЧЕТОЧНИКОВ
- Рост раковой опухоли. ХАРАКТЕРИСТИКА ОПУХОЛЕВОГО РОСТА.
- Рак желудка диагностика и причины.
- Причины возникновения рака: стресс, Химические канцерогены, вирусы и другое
- РАК МОЛОЧНОЙ ЖЕЛЕЗЫ- РМЖ диагностика, лечение, причины и последствия
- РАК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
- Методы лечения рака и онкологии. Современные способы лечения.
- Принципы лечения злокачественных опухолей. Лечение рака и онкологии.
- Диагностики злокачественных опухолей и рака. Принципы установки диагноза.
- Метастаза опухоли. Карциноиды
- Классификация рака (опухолей).
- Синдромы рака. Течение рака. Доклинический период рака.
- Онкогенез. Атрофия. Метаплазия.
Источник
Что же следует относить к фоновым и что к предопухолевым состояниям мочевого пузыря?
С морфологической точки зрения фон нельзя расценивать в качестве непосредственного предшественника опухоли, он только способствующий ее развитию момент.
Следует отметить, что в условиях клиники оценка предопухолевых состояний часто затруднена, поскольку трудно провести границу между фоновым заболеванием и предраком, тем более, что до сих пор нет единого мнения о том, что нужно относить к предраку.
Морфологическая схема предрака
В 1947 году Л.М. Шабад создал конкретную морфологическую схему предрака, включающую в себя 4 фазы:
• неравномерная диффузная гиперплазия,
• очаговая пролиферация,
• доброкачественная опухоль (этой фазы может и не быть),
• злокачественная опухоль.
Первые две фазы объединены понятием пренеоплазии, т.е. предопухолевого состояния, третья и четвертая – неоплазии, вторая и третья – предрак.
Предрак характеризуется появлением диффузной, а затем очаговой множественной пролиферации незрелого эпителия, в котором со временем нарастают явления структурной и клеточной атипии, т.е. дисплазии эпителия. Морфологические изменения, соответствующие предраку мочевого пузыря, описаны Б.М. Никитиным в 1962 году.
Использование электронной микроскопии и электронно-гистохимического анализа нарушений интерцеллюлярного матрикса позволили А.М. Романенко определить наиболее ранние ультраструктурные особенности клеточной атипии уроэпителия, к которым относится утолщение надмембранного слоя гликокаликса до 40-60 нм, исчезновение асимметричной единой мембраны поверхностных клеток, расширение межклеточных промежутков.
Дальше идет прбдинвазивный рак – cancer in situ, – являющийся пограничным этапом малигнизации. Весь эпителиальный слой состоит из полиморфных клеток с утратой комплексности расположения, базальная мембрана сохранена. По сути, эпителий превращен в неопластическую мембрану.
Следует отметить, что большие трудности возникают при дифференциальной диагностике дисплазии от cancer in situ. Хотя это понятие означает прединвазивный рак, относящийся к ранней онкологической патологии, отношение к нему онкоурологов свидетельствует о возможности очень быстрого инвазивного роста.
Так, G. Chisholm считает, что если этот диагноз поставлен верно, показана химиотерапия, после которой через 3 месяца в случае дальнейшего прогрессирования процесса, должно быть предпринято лечение в объеме, применяемом для инвазивного рака. В.И. Шипилов отмечает, что если при опухоли Т, избирательная биопсия слизистой оболочки, макроскопически не измененной, выявляет карциному in situ, показана цистэктомия, поскольку, как пишет L. Englander, нет пути для предсказания, когда рак in situ станет инвазивным.
Далее идет ранний инвазивный рак, в котором выделяется микроинвазивный – после прорыва клетками опухоли базальной мембраны и малый инвазивный рак, соответствующий опухолевому очагу диаметром в 1 см. такая опухоль может быть обнаружена эндоскопически.
Но прохождение всех этапов бластомогенеза для появления злокачественной опухоли необязательно. Морфологически предопухолевые изменения должны в отличие от фона иметь локальный характер и непосредственно трансформироваться в рак К таким изменениям относят очаги метаплазии и дисплазии в тканях.
Рядом отечественных и зарубежных авторов хронический воспалительный процесс в мочевом пузыре рассматривается как фоновая патология в развитии рака. И.Т. Райхлин с соавт. основывает такой взгляд на сходстве гистохимической характеристики переходного эпителия мочевого пузыря в норме и при пролиферативных процессах, а также при переходноклеточной папилломе.
Проведя гистологическое исследование слизистой оболочки 100 нормальных мочевых пузырей, полученных при аутопсии, D. Wiener et al. в 93,0% нашли пролиферативные изменения – гнезда фон Брунна, кистозный цистит, плоскоклеточную метаплазию, что позволило считать выявленные изменения вариантами нормы и отрицать их предраковый характер.
Аналогичное исследование Н.М. Аничкова 100 трупов лиц, умерших от неурологических заболеваний, показало, что у 65,0% имеется гиперплазия уроэпителия с формированием гнезд Брунна, у 12,0% – кистозные и “начальные” железистые структуры и у 10,0% – “начальные” плоскоклеточные образования.
Корреляции частоты этих находок с возрастом, полом, предшествующими заболеваниями и причинами смерти найдено не было. Не было и прижизненной клинической симптоматики, сопровождавшей эти гиперпластические и даже метапластические изменения.
Мы уже упоминали о факте латентного воспаления мочевых путей у лиц, чувствующих себя практически здоровыми, при инфицировании мочевой системы кишечной палочкой, стафилококком, протеем, трихомонадами и другими патогенными, условно патогенными и сапрофитными микроорганизмами. В работах R. Hicks et al. и J. Radomsky et al. говорится об образовании в моче сильного канцерогена, – диметилнитрозамина при инфицировании протеем и кишечной палочкой.
Факт, что гипер- и метапластические изменения уроэпителия при воспалении могут становиться источником рака, подтвержден результатами повторной многократной цистоскопии больных, у которых прослежена опухолевая трансформация воспалительных элементов.
Множественные биопсии макроскопически неизмененной слизистой оболочки больных переходноклеточным раком мочевого пузыря выявляют в разной степени выраженную дисплазию или пролиферативный процесс, которые расцениваются как плохой прогностический признак.
Исследовав 100 биоптатов от 25 больных переходноклеточным раком мочевого пузыря, Н. Ozen et al. в 40,5% нашли дисплазию в 17,4 – гиперплазию, в 9,9 плоскоклеточную метаплазию и в 4,1 – рак. Частое возникновение очагов пролиферативных изменений и лейкоплакии в мочевом пузыре при его опухолевом поражении, можно, конечно, рассматривать как развивающийся на фоне опухоли хронический воспалительный процесс, который стимулирует переходный эпителий к метапластическим превращениям, но анализ экспериментального материала свидетельствует о предраковой роли гиперпластических изменений переходного эпителия.
Так, автор показал, что воздействие канцерогенных веществ в течение 2-10 недель приводит к диффузной гиперплазии уроэпителия у грызунов. Но через 6-8 недель после прекращения действия канцерогена она исчезает.
В противном случае возникает очаговая гиперплазия, подразделяющаяся на полипоидный, солидный и папиллярный типы. Последний называют переходнокпеточной папилломой. Иногда в этот же период появляются изолированные погружные эпителиальные комплексы типа гнезд Брунна.
Очаги гиперплазии построены из диплоидных клеток, намного увеличиваются размеры и количество микроворсинок, отделенных от полости мочевого пузыря тонкой и однородной поверхностной мембраной, в которой R. Hicks et al. обнаружили гликокаликс – чрезвычайно мелкие нежноворсинчатые образования с бисерной структурой.
Сходные образования они находили в переходноклеточном раке у человека и сочли гликокаликс качественным признаком опухолевой трансформации, возможно связанным с изменением строения клеточных антигенов поверхностных мембран.
Очаговая гиперплазия нередко сопровождается плоскоклеточной, цилиндроклеточной метаплазией уроэпителия. На 15-20 неделе канцерогенеза в мочевом пузыре животных возникают папиллярные высокодифференцированные раки, через 30-50 недель – инвазивные.
Все вышеизложенное свидетельствует о том. что нельзя безапелляционно отрицать роль воспалительной гиперплазии как предопухолевого состояния, поскольку невозможно предсказать направление развития предопухолевых изменений ткани или органа.
Таким образом, когда мы говорим о фоновом процессе, то имеем в виду комплекс патологических неопухолевых изменений, распространяющихся в органе диффузно и не являющихся непосредственным предшественником опухоли.
Облигатный предрак
Но когда на таком фоне появились очаги дисплазии и метаплазии, можно говорить о предопухолевом состоянии, т е. о факультативном предраке. Относительно мочевого пузыря большинство авторов считают хронический цистит с гнездами фон Брунна, кистозный и железистый – фоновыми заболеваниями, а лейкоплакию, дисплазию эпителия, особенно 2-3 степени и микропапилломатоз с полиферацией эпителия – факультативным предраком.
Что касается облигатного предрака, то папиллома мочевого пузыря в этом смысле общепризнана. Считается доказанным, что при рецидивах папиллом увеличивается их плеоморфизм и склонность к инвазивному росту Однако появилось мнение, что папиллярные опухоли лишь указывают на то. что в уроэпителии существуют другие непапиллярные зоны, где атипическая гиперплазия и рак in situ являются предшественниками инвазивного рака мочевого пузыря.
Автор подтверждает это тем, что из 104 больных инвазивным раком только у 20 были сведения о предшествующих папиллярных опухолях, у 22 при выполнении цистоскопии за несколько месяцев или лет до появления инвазии папиллярной опухоли не было установлено. Поэтому сделан вывод о целесообразности выявления других, менее видимых поражений мочевого пузыря, которые могут оказаться истинными предшественниками инвазивного рака.
С мнением Р. Brawn трудно согласиться, поскольку непрерывность процесса превращения папилломы в злокачественную опухоль инвазивного характера показана морфологически и подтверждена многочисленными клиническими наблюдениями отечественных и зарубежных авторов.
Пряничникова М.Б.
Опубликовал Константин Моканов
Источник
