Цистит при раке матки
Лучевой цистит – это специфическое поражение мочевого пузыря, возникающее в ответ на воздействие ионизирующего излучения на область малого таза.
Лучевая терапия является одним из основных методов лечения рака органов малого таза. При отсутствии регионарных метастазов она позволяет добиться полной или частичной регрессии опухоли более чем у 70% пациентов. При этом продолжительность жизни таких больных остается достаточно высокой.
Однако радиация действует не только на злокачественные клетки. В зону риска попадают ткани с высокой пролиферативной активностью, в частности, мочевой пузырь. Его слизистая отличается высокой чувствительностью к действию ионизирующего излучения, в результате чего возникает нарушение его тканевой структуры, кровоснабжения и иннервации, и, как следствие, развивается воспаление, кровотечения и изъязвления. Основные механизмы, лежащие в основе развития лучевого цистита следующие:
- Некротизирующие повреждения эпителия.
- Воспалительные реакции.
- Повреждение кровеносных сосудов, нарушение трофики и развитие ишемии.
- Присоединение бактериальной инфекции.
Чаще всего лучевые повреждения возникают при дистанционной терапии, когда невозможно защитить нецелевые органы. При брахитерапии такие осложнения возникают редко.
Классификация лучевых циститов
В зависимости от сроков возникновения симптоматики, выделяют следующие виды лучевого цистита:
- Острый лучевой цистит – развивается либо во время проведения ЛТ, либо в ближайшее время после ее окончания (до 100 дней).
- Хронический лучевой цистит. При нем симптомы возникают более, чем через 3 месяца после окончания лучевой терапии. У некоторых пациентов заболевание может обнаружиться даже через десятки лет после окончания лечения.
В зависимости от морфологических изменений выделяют:
- Телеангиоэктазии мочевого пузыря. При этом виде лучевого цистита возникают повреждения кровеносных сосудов. Они расширяются, сливаются между собой и образуют кровоточащие конгломераты.
- Катаральный цистит – при нем превалируют воспалительные процессы. Стенка мочевого пузыря отечна, гиперемирована, могут присутствовать единичные язвы и телеангиоэктазии.
- Лучевые язвы. Основным патологическим процессом является образование язв в стенке мочевого пузыря. Они имеют расширенные кровеносные сосуды, часть их поверхности может быть инкрустирована солями мочевой кислоты, фибрином или конкрементами.
- Инкрустирующий цистит – клинически и морфологически сходен с язвенным.
- Псевдорак – на месте лучевых повреждений образуется новообразование на широком основании. Его поверхность может быть покрыта фибринозным налетом или кристаллами солей. Необходима биопсия для дифдиагностики злокачественных процессов.
Симптомы лучевого цистита
- Учащенное мочеиспускание, в ряде случаев может доходить до 40 раз в сутки.
- Наличие примесей крови в моче. В ряде случаев это макрогематурия с появлением кровяных сгустков.
- Наличие патологических примесей в моче: «песок», соли, хлопья, слизь.
- Боли и рези во время мочеиспускания.
- Боли и рези внизу живота, в области лона.
Диагностика лучевого цистита
Диагностика лучевого цистита должна быть комплексной и включать следующие элементы:
- Цистоскопия – эндоскопическое исследование мочевого пузыря. Оно позволяет рассмотреть стенку мочевого пузыря и дифференцировать вид лучевого поражения и оценить его степень.
- Уродинамические исследования позволяют оценить функцию мочевого пузыря и сфинктера уретры. С этой целью проводят урофлуориметрию, цистометрию наполнения, электромиографию и другие тесты.
- Биопсия. Исследование фрагмента ткани стенки мочевого пузыря позволит провести дифференциальную диагностику лучевого цистита. Особенно это актуально при псевдораке.
Методы лечения лучевого цистита
Лечение лучевых повреждений мочевого пузыря требует комплексного подхода и включает следующие мероприятия.
Медикаментозная терапия
Назначаются обезболивающие и противовоспалительные препараты. Для предотвращения развития бактериальных осложнений применяются антибиотики. При длительных кровотечениях может развиться декомпенсация системы гемостаза (кровесвертывающей системы). Чтобы это предотвратить, назначают гемостатики – аминокапроновую кислоту, викасол и др. При развитии анемии применяют препараты железа.
Инстилляции
Инстилляция – это введение лекарственных препаратов непосредственно в полость органа, в нашем случае в мочевой пузырь. При лучевых циститах проводят инстилляции антисептиков, протеолитических и противовоспалительных препаратов, а также лекарственных средств, которые стимулируют регенерацию тканей.
Хирургическое лечение
Хирургическое лечение проводится при осложненных формах лучевых циститов. С помощью эндоскопической хирургии производят коагуляцию кровоточащих сосудов и телеангиоэктазий, также возможно удаление патологических сращений, инкрустраций и камней. Также хирургическое вмешательство требуется при образовании свищей.
Хронический лучевой цистит
Хронические лучевые циститы возникают не ранее, чем через 3 месяца после окончания лучевой терапии. Они сложнее поддаются лечению, склонны к упорным рецидивам и могут приводить к уменьшению емкости мочевого пузыря. Для борьбы с этой проблемой применяются лечебно-диагностическую процедуру под названием гидродистензия. Ее суть заключается в заполнении мочевого пузыря большим объемом жидкости под контролем давления. Это позволит увеличить
объем органа и устранить императивные позывы на мочеиспускание.
Профилактика
Самым действенным методом профилактики лучевого цистита является тщательное планирование полей облучения, таким образом, чтобы нецелевые ткани в них не попадали. Наилучшие результаты в этом плане показывает брахитерапия, которая позволяет подвести максимальную дозу непосредственно к опухоли.
Прогноз
Прогноз лучевого цистита зависит не только от тяжести симптомов, но и от сроков их развития. Наиболее благоприятно протекают острые лучевые реакции, которые развиваются в ближайшие 3 месяца после окончания радиолечения. При хронических постлучевых циститах могут развиться стойкие нарушения, требующие хирургического вмешательства.
Цены на лечение лучевых циститов определяются тяжестью патологии. При легких формах достаточно медикаментозной терапии и инстилляций. При тяжелых процессах может понадобиться эндоскопическое вмешательство и даже проведение хирургических операций.
У врачей Европейской клиники имеется большой опыт лечения рака мочевого пузыря, в том числе такого осложнения, как лучевой цистит. Это позволяет в каждом конкретном случае достигать максимально возможных результатов.
Источник
Геморрагический цистит – это стерильный цистит, характеризующийся грубой гематурией. Он чаще всего встречается у пациентов, получающих ифосфамид и высокие дозы циклофосфамида в условиях саркомы костей, мягких тканей и трансплантации гемопоэтических клеток, а также в качестве поздней токсичности тазовой лучевой терапии (ЛТ), когда мочевой пузырь находится в зоне облучения.
Причины геморрагического цистита у онкологических пациентов
Могут вызывать либо негеморрагический, либо геморрагический цистит (ГЦ) различные химиотерапевтические средства, включая:
- ифосфамид;
- циклофосфамид;
- бусульфан;
- доксорубицин;
- дакарбазин;
- флударабин;
- кабазитаксел.
ГЦ наиболее часто описан у пациентов, получающих оксазафосфориновые алкилирующие агенты ифосфамид и циклофосфамид.
Таблица 1. Химиотерапевтические препараты, вызывающие геморрагический цистит
| Препараты | Эффект | Примечания |
| Циклофосфамид, Ифосфамид | геморрагический цистит | в качестве профилактики проводится уропротекция с помощью МЕСНА, физиологического раствора и непрерывного орошения мочевого пузыря |
| Бусульфан | геморрагический цистит | наблюдается при длительной системной терапии; длительная задержка начала заболевания |
| Тиотепа | раздражение и редко геморрагический цистит | при внутрипузырном введении |
| Доксорубицин | обратимый геморрагический цистит через 20-30 лет | при внутрипузырном введении |
| Митомицин | цистит через 15 лет | при внутрипузырном введении |
| Флударабин | редкий геморрагический цистит | |
| Хлорамбуцил | редкие случаи стерильного цистита | |
| Кабазитаксел | геморрагический цистит – у 17% больных; тяжелый (3-я или 4-я степень) – у 2-3% пациентов | |
| Дакарбазин, темозоломид | редкий геморрагический цистит |
Ифосфамид и циклофосфамид одобрены для применения при различных злокачественных новообразованиях у детей и у взрослых.
Циклофосфамид также используется в качестве компонента перед трансплантацией гемопоэтических клеток и в качестве иммунодепрессанта при различных ревматологических (например, аутоиммунные заболевания, васкулит), нефрологических (например, нефротический синдром с минимальными изменениями), дерматологических (например, рефрактерная пузырчатка) и неврологических (например, рецидивирующий/ремиттирующий рассеянный склероз) состояниях.
![]()
Механизм развития ГЦ у онкологических больных при приеме химиотерапевтических препаратов
У пациентов, получающих препараты циклофосфамид, ифосфамид, геморрагический цистит представляет собой сложную воспалительную реакцию, индуцируемую токсическим метаболитом (акролеином) с последующей активацией иммунокомпетентных клеток и высвобождением многих провоспалительных агентов.
При метаболизме в печени как циклофосфамида, так и ифосфамида образуется акролеин, который фильтруется почками и концентрируется в мочевом пузыре.
Акролеин – это реакционноспособный ненасыщенный альдегид, который вызывает гибель клеток путем усиления регуляции активных форм кислорода и активирует синтазу оксида азота, приводя к образованию оксида азота. Как активные формы кислорода, так и оксид азота продуцируют пероксинитрит, который атакует клеточные макромолекулы (липиды и белки) и вызывает разрывы нитей ДНК. Это вызывает гиперактивность ферментов репарации ДНК.
Активные формы кислорода также позволяют ядерному фактору каппа в (NF-kB) проникать в ядро и включать транскрипцию генов, кодирующих провоспалительные цитокины – фактор некроза опухоли (TNF)-альфа и интерлейкин 11 (IL-11). Конечный результат процесса – прекращение производства белка и повреждение целостности уротелия с морфологическими и гистологическими признаками отека, кровотечения и изъязвления слизистой оболочки мочевого пузыря.
Механизм развития геморрагического цистита при лучевой терапии
Лучевой цистит – позднее осложнение тазовой лучевой терапии, возникающее в период от нескольких месяцев до нескольких лет после ее проведения.
После такого лечения, включающего мочевой пузырь, слизистая оболочка мочевого пузыря изначально отечна и рыхлая. В дальнейшем наблюдается прогрессирующий эндартериит, приводящий к облитерации подслизистой сосудистой оболочки с последующей ишемией и реперфузионным повреждением.
Затем происходит фиброз слизистой оболочки и подслизистой оболочки, с развитием дилатированных, хрупких телеангиэктатических сосудов, имеющих тенденцию к кровоизлиянию.
![]() Лучевой цистит
Лучевой цистит
Заболеваемость и факторы риска развития геморрагического цистита у больных раком
Эти параметры нужно рассматривать в отдельности по каждому варианту лечения:
Ифосфамид. Ифосфамид в качестве фактора риска геморрагического цистита, идентифицирован и признан в клинических испытаниях. Токсический эффект препарата зависит от дозировки. Ранние исследования показывали, что большие разовые дозы ифосфамида вызывали грубую гематурию у 100% пациентов. Затем, при использовании ифосфамида в дозировке 5-7 г/м2, разделенной на 4-6 доз, в течение 2-3 дней без специфической уропротекции, частота ГЦ составила 18% против 6% с дозировкой от 1 до 1,2 г/м2.
В других исследованиях сообщалось, что общая частота ГЦ среди пациентов, получавших фракционированную дозировку ифосфамида без уротелиальной защиты, колеблется от 18 до 40%. При введении ифосфамида вместе с уропротектором МЕСНА грубая гематурия встречается редко – менее чем в 5 % случаев, а микроскопическая гематурия встречается только в 5-18%. Вот почему важны профилактические мероприятия.
Циклофосфамид. Геморрагического цистит, возникающий в результате приема этого препарата, был описан вскоре после введения циклофосфамида в клиническое применение в 1958 году. Осложнение наблюдалось у 10-40% пациентов. Иногда симптомы ослабевали после отмены препарата.
Частота ГЦ выше у лиц, получающих более высокие индивидуальные дозы, например, при трансплантации гемопоэтических клеток, и большие кумулятивные дозы циклофосфамида, например, при длительной пероральной терапии ревматологических состояний. Однако описаны случаи начала цистита после однократного внутривенного введения циклофосфамида в дозах от 500 до 600 мг/м2.
Заболеваемость и факторы риска развития геморрагического цистита у пациентов, перенесших трансплантацию гемопоэтических клеток (HCT или ТГК)
Пациенты, получающие циклофосфамид перед ТГК, подвергаются риску развития геморрагического цистита В некоторых сообщениях кумулятивная заболеваемость составляет 8-17%. Геморрагический цистит возникает как после аутологичной, так и после аллогенной трансплантации. Медиана продолжительности ГЦ в одном из исследований составила 27 дней.
Помимо использования циклофосфамида, другие потенциальные факторы, способствующие развитию ГЦ у онкологических пациентов, включают:
- вирусную инфекцию полиомавирусом BK/JC;
- заражение аденовирусом или цитомегаловирусом;
- более высокие дозы бусульфана.
Ранний посттрансплантационный ГЦ, возникающий в течение 72 часов после введения препарата, часто ассоциируется с применением высоких доз циклофосфамида. Более поздний ГЦ чаще возникает в результате вирусных инфекций, таких как вирус ВК и аденовирус типа 11.
Генетические факторы, влияющие на риск при приеме химиопрепаратов
Среди пациентов, получающих циклофосфамид, на риск развития ГЦ влияют генетические полиморфизмы в генах, участвующих в метаболизме циклофосфамида. Например, гетерозиготность по аллелю ALDH3A1*2, который опосредует деградацию активированных метаболитов циклофосфамида, связана с почти 12-кратным увеличением риска развития ГЦ по сравнению с вариантом ALDH3A1 обычного типа.
Другие исследования обнаружили, что полиморфизмы в метаболизирующих лекарственных средствах – ферментах глутатион S-трансферазе (GST) и цитохроме Р450 2С9 (CYP2C9) ассоциированы с риском развития цистита у детей, перенесших трансплантацию стволовых клеток (после применения бусульфана и циклофосфамида).
Опубликованных данных о генетических факторах, влияющих на риск развития ГЦ при приеме ифосфамида нет. Несмотря на эти данные, генетическое обследование всех пациентов для профилактики ГЦ не проводится и не рекомендуется.
Лучевая терапия и риск развития геморрагического цистита
Острый цистит, связанный с лучевой терапией, распространен хотя частота его возникновения сильно варьирует. Он связан с симптомами раздражительного опорожнения, например, дизурией, частотой, срочностью и никтурией, и спазмами мочевого пузыря, но обычно не гематурией.
Гематурия и ГЦ – поздние осложнения у 6,5-9% пациентов, получавших полную дозу стандартной фракционированного облучения по поводу рака предстательной железы или гинекологии, но менее чем у 5% больных состояние является тяжелым.
Вероятность развития геморрагического цистита связана с общей дозой облучения, дозой на фракцию и объемом облученного мочевого пузыря. К другим факторам риска относятся применение андрогенной депривационной терапии и наличие в анамнезе трансуретральной резекции предстательной железы (ТУР).
Продолжение статьи
- Часть 1. Типы цистита – характеристика заболевания.
- Часть 2. Эозинофильный цистит – предрасполагающие факторы, сопутствующие патологии.
- Часть 3. Диагностика и лечение эозинофильного цистита.
- Часть 4. Интерстициальный цистит: причины, симптомы, диагностика.
- Часть 5. Лечение интерстициального цистита.
- Часть 6. Геморрагический цистит – характеристика, причины.
- Часть 7. Лекарственный геморрагический цистит – препараты, вызывающие заболевание, диагностика, лечение.
- Часть 8. Диагностика и лечение геморрагического цистита.
- Часть 9. Системные методы лечения геморрагического цистита.
- Часть 10. Геморрагический цистит у онкологических больных: риски, механизмы развития.
- Часть 11. Диагностика и лечение геморрагического цистита у больных с раком.
- Часть 12. Фолликулярный цистит.
Источник
Качество жизни при раке матки. Осложнения
Обструкция мочеточников при раке шейки матки поздних стадий. Больные с двусторонним сдавленней мочеточников и уремией вследствие прогрессирования рака шейки матки (РШМ) и рака эндометрия (РЭ) представляют серьезную проблему для врачей. Этих женщин желательно разделить на две группы:
1) не получавших ранее ЛТ;
2) с рецидивом заболевания после тазовой ЛТ.
Отличие сдавления мочеточников, вызванного РЭ, от их обструкции при РШМ заключается в том, что в первом случае причина чаще всего связана с распространением процесса за пределами таза, что создает более трудные условия для лечения. Кроме того, при использовании стандартной брахитерапии необходимые дозы облучения сложнее подвести к телу матки, чем к шейке. Этим обусловлен более низкий эффект лечения больных РЭ с помощью ЛТ.
Двустороннее сдавление мочеточников вследствие нелеченного злокачественного новообразования или рецидива рака после хирургического лечения считают серьезным показанием для отвода мочи с последующей адекватной ЛТ. Процент успешных исходов в этой ситуации низкий. Поэтому, несмотря на то что поддерживающая терапия не может остановить прогрессирование уремии и летального исхода, она должна рассматриваться как альтернатива более агрессивному лечению.
Если от поддерживающей терапии в качестве единственного метода воздержались и выбрали активную тактику ведения больной, первым делом следует попытаться установить ретроградные мочеточниковые стенты во время цистоскопии. Если эта попытка не удалась, выполняют чрескожную нефростомию, а затем стент устанавливают антеградно. Третий вариант хирургического отведения мочи заключается в формировании мочевого проводника из петли подвздошной кишки, в которую имплантируют мочеточники, а дистальный конец выводят на кожу (операция Бриккера), либо в создании мочевого резервуара из сегмента кишечника.
Как правило, отведение мочи выполняют до начала ЛТ, что позволяет во время лапаротомии оценить распространенность заболевания. Если обнаруживают метастазы за пределами таза, тактику изменяют, т. к. шансы на выздоровление значительно снижены.
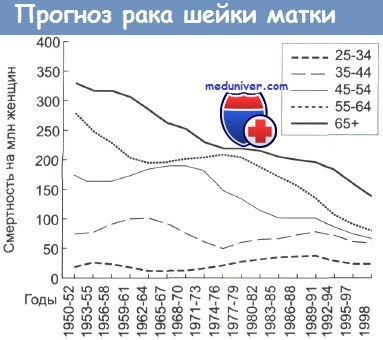 Смертность от цервикального рака в зависимости от возраста женщин.
Смертность от цервикального рака в зависимости от возраста женщин.
Больные с двусторонней обструкцией мочеточников после полного курса тазовой ЛТ представляют еще более сложную проблему. Менее чем у 5 % из них сдавление мочеточников вызвано радиационным фиброзом; эту группу больных очень сложно выявить. Для того чтобы исключить рецидив заболевания, выполняют обследование под наркозом: цистоскопию, ректороманоскопию и множественные биопсии.
Если рецидив опухоли не обнаружен, отведение мочи спасает жизнь больной. Поэтому всех больных с двусторонним сдавленней мочеточников после курса облучения необходимо тщательно обследовать с целью дифференциальной диагностики лучевого фиброза и рецидива злокачественного новообразования.
Если доказано, что причина двусторонней обструкции мочеточников обусловлена рецидивом заболевания, решение о дальнейшем лечении – трудная и, в какой-то степени, умозрительная задача. Многочисленные исследования указывают на то, что отведение мочи не обеспечивает приемлемое качество жизни этой группе больных. Brin и соавт. сообщили о 47 больных (5 из них с диагнозом РШМ), которым в связи с обструкцией мочеточников вследствие распространенных злокачественных опухолей, локализованных в тазу, выполнено отведение мочи.
Результаты неутешительны: медиана выживаемости составила 5,3 мес; 50 % больных прожили 3 мес. и только 20 % – 6 мес; после отвода мочи 63,8 % времени оставшейся жизни приходилось па стационар. Delgado сообщил о незначительном увеличении выживаемости больных с выявленными рецидивными опухолями в тазу и почечной недостаточностью, которым проведено отведение мочи. Автор полагает, что не следует прибегать к этой операции, т. к. она исключает более легкую смерть от уремии.
Очевидно, решение об операции следует принимать вместе с семьей и даже, по возможности, с больной. После отведения мочи наблюдается усиление других симптомов рецидива заболевания, вызывающих страдания: мучительной боли в тазу, повторных инфекций и кровотечений. Боль и прогрессирующая кахексия тяготят и больную, и врача. Массивные тазовые кровотечения поднимают непростую в этих ситуациях проблему переливания крови. Неизбежно увеличивается время пребывания в стационаре, а следовательно, финансовые затраты семьи больной достигают огромного размера.

Свищи при раке шейки матки поздних стадий
Свищи ободочной кишки и мочевых путей – типичные осложнения прогрессирующего рака шейки матки (РШМ) и рака эндометрия (РЭ), которые значительно ухудшают качество жизни. Лечение всегда начинают с отведения мочи или кала, что уменьшает соответствующую симптоматику. Постоянная катетеризация мочевого пузыря устраняет недержание мочи, обусловленное наличием свища, что отменяет необходимость хирургического вмешательства. Ушивание свища мочеточника с чрескожной нефростомией – второй вариант лечения.
Однако для эффективного отведения мочи требуется сформировать мочевой резервуар или выполнить другие хирургические вмешательства. Существующие методы хирургической коррекции свищей мочевых путей, возникших вследствие рецидива рака или облучения, редко дают удовлетворительные результаты.
Паллиативное лечение влагалищно-толстокишечного свища сводится к наложению колостомы. Согласно мнению одних хирургов, петлевая колостома обеспечивает адекватное опорожнение кишечника и препятствует выделению кала через свищ. Другие отдают предпочтение одноствольной колостоме, утверждая, что ушивание культи кишки, как при операции Хартманна, полностью блокирует попадание кала во влагалище. При любой ситуации требуется мини-лапаротомия, во время которой и определяют объем операции.
Сексуальная дисфункция при раке шейки матки поздних стадий
Лечение женщин со злокачественными новообразованиями половых органов может осложниться патологическими изменениями влагалища, вызывающими сексуальные расстройства. Чаще они развиваются после лечения рака вульвы, влагалища и РШМ по сравнению с РЭ и РЯ. Это объясняется более частым применением комбинированного лечения (радикальных хирургических операций и ЛТ) при лечении первых трех локализаций опухолей. Согласно публикациям, частота сексуальных расстройств после хирургического лечения, ЛТ или комбинации обоих методов колеблется в широких пределах.
На сухость и укорочение влагалища после радикальной гистерэктомии жалуется 17-58 и 4-100 % женщин соответственно. До настоящего времени точные данные о частоте уменьшения эластичности влагалища и притока крови к наружным половым органам во время полового возбуждения у перенесших эту операцию отсутствовали. В 1999 г. в Швеции выполнено ретроспективное исследование у 256 больных РШМ, закончивших лечение, в сравнении с 350 женщинами группы контроля; результаты опубликованы в журнале «New England Journal of Medicine». Обнаружено статистически значимое снижение эластичности влагалища у 23 % женщин, получивших лечение по поводу начального РШМ, по сравнению с контрольной группой (4 %).
Кроме того, зафиксировано укорочение влагалища после лечения и снижение увлажнения во время полового акта. Женщины жаловались, что эти изменения отрицательно влияют на половую жизнь и вызывают глубокие переживания. Тем не менее частота оргазмов была одинаковой в обеих группах, но диспареуния наблюдалась чаще у женщин, перенесших РШМ. Наконец, данное ретроспективное исследование не выявило статистически значимых различий в количестве сексуальных расстройств между женщинами, перенесшими радикальную операцию и ЛТ. В других же аналогичных исследованиях обнаружено существенное превалирование сексуальных дисфункций у женщин, получивших ЛТ, по сравнению с теми, кто перенес хирургическое лечение РШМ.
Важно учитывать и сравнивать не только результаты лечения рака шейки матки (РШМ), полученные с помощью лучевого или хирургического метода, но и показатели качества жизни и половой функции. Рекомендуют регулярно проводить бужирование влагалища после ЛТ с целью сохранить его длину и эластичность. Заметим, что эффективность этого вмешательства в проспективных исследованиях не изучена. Грамотное назначение ЗГТ и мазей улучшает качество половой жизни у этих женщин.
Следует выявлять и лечить диспареунию, возникающую после лечения злокачественных опухолей женских половых органов, т. к. она ведет к снижению либидо, а это ухудшает отношения между женщиной и ее партнером. Потеря полового влечения женщинами, перенесшими онкологическое заболевание, – типичное явление, представляющее сложную проблему. Спустя длительное время после улучшения общего состояния женщины жалуются на снижение полового влечения или его отсутствие. Психологическая помощь и участие в группах поддержки могут быть полезными в решении этой омрачающей жизнь проблемы.
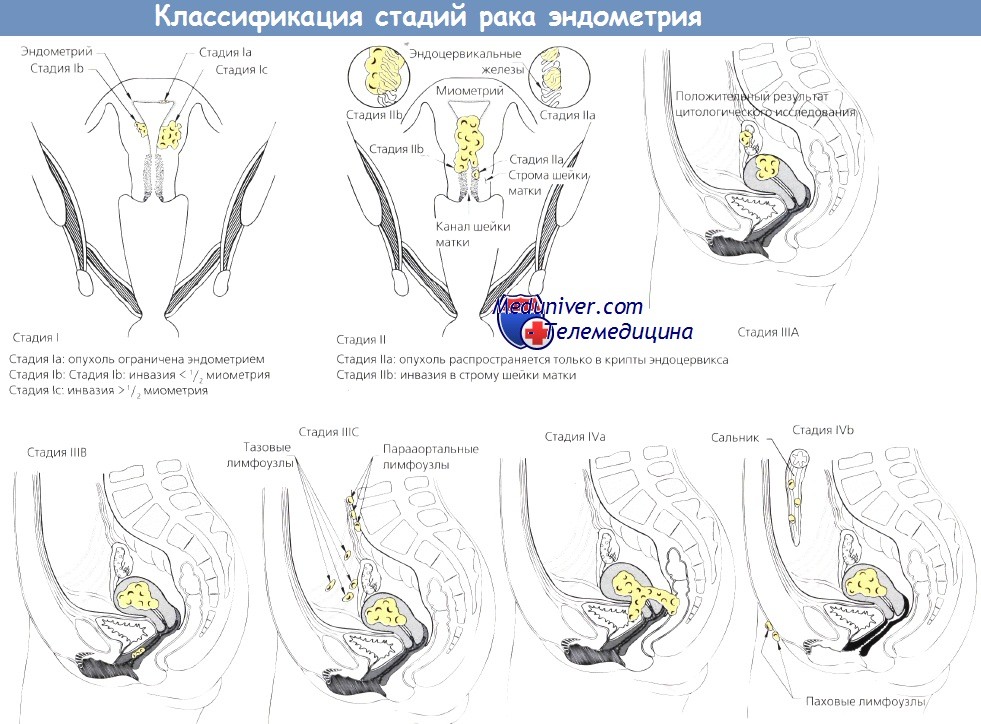
Классификация стадий рака эндометрия

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
– Также рекомендуем “Принятие решения по лечению онкологического больного в США в конце жизни”
Оглавление темы “Симптоматическое лечение рака”:
- Помощь при тошноте и рвоте у онкологического больного
- Помощь при поносе и запоре у онкологического больного
- Правила сообщения пациенту об онкологическом заболевании
- Психосоциальные проблемы больных раком
- Качество жизни при раке яичников поздних стадий. Осложнения
- Качество жизни при раке матки. Осложнения
- Принятие решения по лечению онкологического больного в США в конце жизни
- Принятие решения о бесполезности лечения рака
- Хосписы для онкологических больных – условия, требования
Источник
