Цистит после операции аппендицита
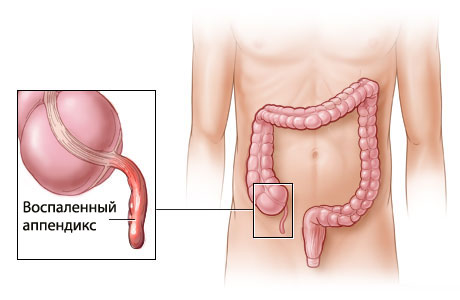
- Из-за чего происходит аппендицит?
- Как не допустить осложнений после аппендицита?
- Лечение аппендицита
- Швы после аппендицита
- Что зависит от профессионализма врача?
- Какие мероприятия рекомендованы после аппендицита?
- Диета после аппендицита
- Физическая активность после аппендицита
- Последствия удаления аппендикса для организма
Аппендицит – достаточно распространенное заболевание. Выявленное вовремя оно быстро излечивается, однако устраняется исключительно хирургическим путем. Вместе с тем операция по удалению аппендицита оценивается хирургами как наибольшей легкости. Развитие аппендицита обосновано определенными факторами, на ровном месте не возникает.
 | Профилактика аппендицита занимает не последнее место в формировании здорового образа жизни. Когда же заболевания избежать не удалось, имеет смысл откорректировать свой рацион питания и режим дня. Реабилитация после аппендицита не требует множества ограничений, однако для отменного самочувствия необходимо прислушиваться к рекомендациям врача. |
Из-за чего происходит аппендицит?
Аппендицитом называется воспаление червеобразного отростка слепой кишки, аппендикса. Функция аппендикса в организме до конца не установлена. Это скорее рудиментарный орган. Предполагается, что в ходе эволюции человека он утратил свою основную пищеварительную функцию и на сегодняшний день играет второстепенную роль:
- содержит большое количество лимфоидных образований, а значит, отчасти обеспечивает иммунитет;
- продуцирует амилазу и липазу, а значит, выполняет секреторную функцию;
- продуцирует обеспечивающие перистальтику гормоны, а значит, сродни гормональным железам.
Причины возникновения аппендицита описывают несколько теорий:
- механическая утверждает, что поводом к развитию аппендицита оказывается обтурация просвета отростка каловыми камнями или лимфоидными фолликулами на фоне активации кишечной флоры; как следствие в просвете скапливается слизь, размножаются микроорганизмы, воспаляется слизистая оболочка аппендикса, затем происходит тромбоз сосудов и некроз непосредственно стенок отростка;
- инфекционная теория отталкивается от того, что к воспалению аппендикса ведет агрессивное воздействие на отросток инфекционных агентов, локализирующихся здесь; обычно это брюшной тиф, иерсиниоз, туберкулёз, паразитарные инфекции, амёбиаз, однако до сих пор не выявлено специфической флоры;
- сосудистая теория объясняет развитие аппендицита расстройством кровоснабжения этого участка пищеварительного тракта, что возможно, например, на фоне системных васкулитов;
- эндокринная в основу возникновения аппендицита кладет воздействие серотонина, гормона, вырабатывающегося множественными расположенными в аппендиксе клетками диффузной эндокринной системы и выступающего медиатором воспаления.
Аппендицит нередко развивается на фоне других нарушений в работе желудочно-кишечного тракта. Высоко риск аппендицита оценивается для тех лиц, которым диагностированы:
- хронические формы:
- колита,
- холецистита,
- энтерита,
- аднексита
- перитифлит;
- спаечная болезнь брюшной полости;
- запоры и синдром “ленивого желудка”;
- гельминтоз.
Аппендицит чаще развивается в возрасте 20-40 лет; чаще болеют им женщины, нежели мужчины. Аппендицит занимает первое место среди хирургических заболеваний органов брюшной полости.
Профилактика аппендицита заключается в исключении негативных факторов, лечении хронических заболеваний органов брюшной полости, исключении запоров и в соблюдении здорового образа жизни. Рацион питания должен включать достаточное количество растительной клетчатки, поскольку именно она возбуждает перистальтику кишечника, оказывает слабительное действие и сокращает время пассажа кишечного содержимого.
Как не допустить осложнений после аппендицита?
Воспаление аппендикса вовремя не диагностированное и не устраненное способно обернуться серьезными патологиями. К числу последних относятся:
- аппендикулярный инфильтрат – развивающийся на 2-4 день после острого аппендицита конгломерат спаянных между собой воспаленных тканей аппендикса и прилегающих к нему органов (сальника, тонкой кишки, слепой кишки);
- абсцесс брюшной полости и периаппендикулярный абсцесс – могут развиваться и вокруг аппендикса, и в других местах брюшной полости вследствие оседания инфицированного выпота, внутрибрюшных гематом или некачественных швов культи аппендикса;
- перитонит (воспаление брюшины);
- флегмона забрюшинного пространства – острый процесс гнойно-воспалительного характера, развивающийся в ретроперитонеальной клетчатке, не отграничивающийся от здоровых тканей;
- тромбофлебит вен малого таза и пилефлебит (септический тромбофлебит воротной вены и ее ветвей, развивающийся обычно после аппендэктомии);
- сепсис (заражение крови).
Причина осложнений после аппендицита кроется в непрофессионально выполненном лечении либо слишком позднем обращении к врачу. Симптомы острого аппендицита ни в коем случае нельзя игнорировать и рассчитывать на то, что все само собой пройдет. Ощутимый дискомфорт в нижнем правом боку, сочетающийся с нарушениями стула, рвотой и температурой, должен быть поводом для незамедлительного обращения к профессиональному медику.
 Категорически воспрещается при развитии аппендицита принимать слабительное и обезболивающее, применять тепло на болезненную область. В догоспитальный период больному требуется покой и постельный режим, прикладывать к боку можно, наоборот, холод. Подтверждение подозрений на аппендицит является показанием для оперативного вмешательства, консервативные методики лечения не демонстрируют успеха.
Категорически воспрещается при развитии аппендицита принимать слабительное и обезболивающее, применять тепло на болезненную область. В догоспитальный период больному требуется покой и постельный режим, прикладывать к боку можно, наоборот, холод. Подтверждение подозрений на аппендицит является показанием для оперативного вмешательства, консервативные методики лечения не демонстрируют успеха.
Оперативное вмешательство, произведенное в первые сутки развития аппендицита, отличается простотой выполнения, осложнения маловероятны. Прогноз оценивается благоприятно. Обычно пациент уже на вторые сутки после операции может переворачиваться на койке, присаживаться, а вставать и ходить на 3-4-е сутки.
В последующие несколько недель пациент должен придерживаться щадящего режима, сниженных физических активностей, в противном случае возрастает риск неправильного зарастания шва после аппендицита, развития спаечной болезни, паховой грыжи. Вероятность таковых объясняется неравномерным срастанием мышечной ткани, когда сквозь не заращенные участки может выступать брыжейка или петли кишечника, а это будет препятствует окончательному сращению мышц. Это происходит обычно на фоне:
- неправильного питания больного в послеоперационный период;
- игнорирования необходимого ношения бандажа;
- слабости мышечного каркаса передней брюшной стенки;
- недопустимых физических нагрузок и поднятия тяжестей;
- воспалительных внутренних процессов.
Лечение аппендицита
На сегодняшний день медицина не предлагает никаких других методов лечения аппендицита, кроме как экстренное хирургическое вмешательство. Вопреки тому, что у многих пациентов сам факт операции может вызывать серьезную обеспокоенность, в такой стратегии лечения минимум опасностей. Если провести операцию качественно и незамедлительно, то уже на вторые сутки больной начинает прогрессивно восстанавливаться.
Доступ к аппендиксу осуществляется по методике Мак-Бурнея (или, как его называют в отечественной литературе, Волковича-Дьяконова), удаление аппендикса может быть типичным или ретроградным:
- типичный применяется, когда существует возможность вывести аппендикс в операционное рассечение, – брыжейка перевязывается, а затем отсекается, культя размещается в куполе слепой кишки;
- ретроградный уместен при невозможности провести отросток через операционную рану, например при наличии спаек или атипичном расположении аппендикса, – сначала отсекается отросток от купола слепой кишки, затем культя помещается в купол и лишь после этого проводится выделение отростка, перевязка брыжейки.
Вследствие произведения доступа к аппендиксу по методу Мак-Бурнея остается небольшой ровный шрам, для многих пациентов весьма нежелательный. Достижения современной медицины предлагают малоинвазивные операционные вмешательства для устранения аппендицита. Прежде всего, это лапароскопический метод – через небольшие проколы брюшной стенки (обычно три) специальными инструментами. Еще одним малоинвазивным прогрессивным методом удаления аппендикса является транслюминальный – гибкими инструментами, вводимыми в просвет полового органа и через разрез в стенке внутреннего органа (в стенке желудка или влагалища). Транслюминальное вмешательство характеризуется полным отсутствием визуально заметных дефектов и сокращением сроков постоперационной реабилитации.
Швы после аппендицита
При классическом варианте хирургического вмешательства в нижнем боку живота остается небольшой (в среднем трехсантиметровый) шов. Наложение и рассасывание швов после аппендицита требует профессионализма от врача и ответственности в выполнении его рекомендаций от пациента.
При отсутствии осложнений после аппендицита внешние швы снимаются на 10-12 день, а внутренние рассасываются в течение двух месяцев (выполняются кетгутовыми нитями). Таковы необходимые сроки для восстановления крепкого мышечного каркаса, кожные же покровы регенерируются еще быстрее. В среднем около 6 недель (не менее) пациенту будет рекомендован особый щадящий режим.
Что зависит от профессионализма врача?
Сотрудничество с квалифицированным медиком актуально еще на этапе диагностики аппендицита. В этом случае важно досконально изучить анамнез заболевания, оценить имеющеюся симптоматику и не проигнорировать, не оставить без внимания признаки, указывающие на остроту процесса.
Оперативное вмешательство при подтвержденном диагнозе проводится едва ли не в тот же день. Рецидивов аппендицит не дает, повторным он быть не может, но коварность его заключается в вероятности спаечной болезни. Она развивается при инфицировании брюшной полости, несоизмеримых физических нагрузках и чрезмерной подвижности в послеоперационный период, на фоне процессов брожения из-за несоблюдения диеты.
Вероятно и нагноение швов. Оно происходит из-за халатности медперсонала и недостаточной санитарной обработки инструментов. Еще одним поводом для нагноения швов оказывается неправильная обработка раневой поверхности и внутрибольничная инфекция. От безалаберности пациента зависит риск перенапряжения брюшной стенки, что нередко усугубляется еще и слабой иммунной защитой.
Распространенность последоперационных осложнений при аппендиците в последнее время имеет тенденцию к снижению в связи с тем, что больные обращаются к врачам на ранней стадии аппендицита, а современные достижения медицины делают возможными малоинвазивные вмешательства.
Какие мероприятия рекомендованы после аппендицита?
После аппендицита в течение 1-2 месяцев пациент должен придерживаться относительно простых и выполнимых ограничений. В выполнении они достаточно просты тем более, если учесть, что их игнорирование чревато достаточно неприятными и нежелательными последствиями.
Диета после аппендицита
После аппендицита самостоятельное потребление пищи разрешается с третьих суток от операции, но еда в этот период должна быть перетертой, кашеобразной. Разрешаются молоко и молочные кисели, жидкие каши (лучше на воде), куриный и овощной бульон, овощные пюре. Диетическое питание начинается с шестого дня. Некоторые особенности питания прописываются пациенту в первые 2-3 месяца после операции. Рацион питания влияет на состав микрофлоры кишечника и на активность его функций. Необходимо следовать таким принципам:
- дробное и частое питание, противопоказано одномоментное употребление крупных порций еды;
- пища не должна быть горячей или холодной, а лишь немного подогретой;
- полноценное питание, обеспечивающее организм всем спектром питательных веществ, витаминов и минералов, поскольку в восстановительном периоде требуется стимуляция и укрепление иммунитета;
- исключение продуктов, способствующих брожению и газообразованию в пищеварительном тракте; рацион питания не должен содержать бобовых, тяжелых животных жиров, любых сортов капусты, копченостей, маринадов и солений, не рекомендуется употребление алкогольных и газированных напитков.
При том что питание должно быть полноценным, с достаточным содержанием белков и исключением лишь тяжелых жиров, после аппендицита пациенту настоятельно рекомендуется следить за своим весом. Поскольку физическая активность в послеоперационный период существенно минимизируется, легко набрать лишний вес, что крайне нежелательно.
Для восстановления нормальной микрофлоры организму полезны молочные и кисломолочные продукты, обильный питьевой режим. Мясо и рыба в первые недели после аппендицита употребляться не должны, однако допустимы бульоны и перетерты мясные/рыбные фарши пюре. Если употребление клетчатки служит отличной профилактикой аппендицита, то в первую неделю после операции она наоборот нежелательна. Лучше отказаться от хлеба и хлебобулочных изделий, отличной их альтернативой могут быть хлебцы, где есть минимум клетчатки и углеводов. Благоприятно организмом воспринимаются овощи (морковь, свекла), бананы, от цитрусовых фруктов лучше отказаться. В тоже время для иммунизации организму необходим витамин С, который можно черпать из других продуктов питания или потреблять в таблетированном виде, равно как и другие витамины и витаминно-минеральные комплексы.
Окончание диеты после аппендицита не должно быть резким. Рекомендуется постепенно расширять рацион. Ни в коем случае не стоит резко срываться на ранее исключенные из рациона продукты. В целом послеоперационная диета не строга, а потому полезно будет следовать уже привычным за несколько месяцев правилам и в последующем. Это пойдет лишь на пользу организму.
Физическая активность после аппендицита
Минимальная физическая подвижность разрешается пациенту на следующий день после операции, но вставать с кровати рекомендуется лишь на третьи сутки.
В последующие 6 недель происходит сращение мышц, на фоне чего остается риск образования спаек и даже грыж. Категорически запрещается поднимание тяжестей и активные физические нагрузки. В то же время отмечается, что ежедневная ходьба небыстрым шагом по 2-3 километра в послеобеденное время способствует предотвращению спаек. Прописывается лечебная гимнастика. Примечательно, что наилучшее восстановление мышечной ткани происходит у тех лиц, кто до развития аппендицита вел активный образ жизни и поддерживал свое тело в тонусе.
Равно как и с диетой, наращивание физической активности после аппендицита не должны быть резким. Спустя несколько месяцев можно возвращаться к умеренным нагрузкам, постепенно дополняя лечебную гимнастику общими упражнениями.
Последствия удаления аппендикса для организма
Как уже отмечалось, аппендикс считается атавизмом. Для современного человека это рудиментарный орган, отсутствие которого существенным образом не отражается на функционировании организма и пищеварительной системы в частности. В то же время аппендиксом вырабатываются некоторые секреты и гормоны, здесь расположены лимфоидные образования.
Удаление аппендикса означает временное ослабление иммунитета и по причине устранения лимфоидных клеток, и по причине внешнего вмешательства, риска проникновения инфекции внутрь организма. Преодолеть данный риск можно посредством искусственной стимуляции иммунитета, полноценного питания, минимизации стрессов и активных физических нагрузок, создания в целом благоприятных условий для реабилитации.
Источник
Современные научные достижения хирургии, травматологии и анестезиологии позволяют значительно расширить объем оперативных вмешательств у лиц пожилого и старческого возраста. Однако сама операционная травма, кровопотеря, анестезиологическое пособие и особенности послеоперационного периода, в первую очередь связанные с длительной иммобилизацией после таких операций, чреваты возникновением ряда осложнений, одним из которых является острая задержка мочеиспускания (ОЗМ). Послеоперационную острую задержку мочеиспускания (ПЗМ) можно охарактеризовать как внезапно возникшую невозможность самостоятельного мочеиспускания при наличии позывов к нему и наполненном мочевом пузыре в течение 6-10 ч после операции [16].
Данное осложнение встречается, по данным ряда авторов, от 2 до 60% после хирургических вмешательств [13-15, 17, 18, 20]. На развитие ОЗМ оказывают влияние многие факторы, препятствующие нормальному оттоку мочи, такие как: механическая обструкция (стриктура уретры, доброкачественная гиперплазия предстательной железы – ДГПЖ); динамическая обструкция (вследствие повышенного мышечного тонуса), нарушение иннервации стенки мочевого пузыря (возможно и как результат лекарственной терапии) и др. [12]. Нередко ОЗМ возникает после оперативных вмешательств, причем не только у больных, страдающих ДГПЖ. Механизм ПЗМ связывают со снижением внутрипузырного давления на 20-40% в горизонтальном положении; с выключением из акта мочеиспускания мышц передней брюшной стенки; с рефлекторным воздействием перенесенной операции на сократительную способность мочевого пузыря; с отрицательным влиянием общей, эпидуральной, спинно-мозговой анестезии и лекарственных препаратов (миорелаксантов, наркотических анальгетиков). Особенно часто ОЗМ наблюдается после проктологических операций. Причинами этого являются денервация мочевого пузыря во время мобилизации прямой кишки, нарушение нормального анатомического расположения мочевого пузыря с его смещением кзади, кровоизлияния в стенку мочевого пузыря. В. И. Кныш и соавторы провели исследование частоты и причин развития атонии мочевого пузыря после радикальных операций по поводу рака прямой кишки. По мнению авторов, причиной атонии мочевого пузыря после подобных операций служит его прогрессирующая дисфункция в результате нарушения парасимпатической иннервации и развития посттравматического перицистита. Частота возникновения послеоперационной ОЗМ у подобных пациентов зависит от объема оперативного вмешательства и является достоверно более высокой после наиболее травматичной операции – брюшно-промежностной экстирпации прямой кишки [7].
По данным W. E. Varger [19], после операций по поводу рака прямой кишки ишурия возникает в 13-32% наблюдений. З. С. Вайнберг [3, 11] наблюдал ОЗМ у 44,5% больных после операций по поводу геморроя, полипов и трещин прямой кишки.
Больные с повреждениями опорно-двигательного аппарата занимают одно из ведущих мест по численности среди поступивших в стационар в экстренном порядке. Длительная иммобилизация у таких больных ведет к венозному застою в органах малого таза и отеку предстательной железы. С учетом того, что оперативные вмешательства на нижних конечностях производятся преимущественно под эпидуральной или спинальной анестезией, риск развития ОЗМ в раннем послеоперационном периоде крайне высок, что обусловлено блокадой афферентных и эфферентных парасимпатических сигналов, проходящих по корешкам спинного мозга и приводящих к динамической обструкции нижних мочевых путей. Также возникают нарушения в сердечно-сосудистой и дыхательной системах, выражающиеся в повышении артериального давления, нарушениях ритма сердца, ограничении экскурсий диафрагмы и снижении глубины дыхания. Переполнение мочевого пузыря способствует нарушению функции поджелудочной железы и печени, развитию пареза кишечника [4].
Основным лечебным мероприятием, применяющимся для разрешения ПЗМ, считается катетеризация мочевого пузыря – быстрый и эффективный способ эвакуации мочи из мочевого пузыря. Интермиттирующая катетеризация позволяет ликвидировать ПЗМ без выполнения оперативного вмешательства у 23% больных с ДГПЖ. Эффективность катетеризации ниже у больных старше 75 лет, при емкости мочевого пузыря свыше 1000 мл и при внутрипузырном давлении менее 35 см вод. ст. [12].
Однако даже однократная катетеризация мочевого пузыря, а тем более длительное дренирование катетером приводит к инфицированию мочевыводящих путей, проявляющемуся от ассимптоматической бактериурии до уросепсиса с высокой степенью летальности [5]. При ишурии нарушается опорожнение не только нижних, но и верхних мочевыводящих путей, что грозит развитием острого гнойно-воспалительного процесса. Часто ишурии сопутствует пузырно-мочеточниковый рефлюкс (17%), и это повышает опасность возникновения острого пиелонефрита. Снижаются почечный кровоток, клубочковая фильтрация и диурез [10]. В результате у пациентов с острой задержкой мочеиспускания может возникнуть почечная недостаточность [1, 2, 6, 8].
Одним из основных подходов в профилактике послеоперационной задержки мочеиспускания у данной категории пациентов является назначение α-адреноблокаторов, которые блокируют действие катехоламинов на α1-адренорецепторы нижних отделов мочевыводящих путей, приводят к расслаблению гладких мышц шейки мочевого пузыря, простатического отдела уретры, стромальной части простаты, тем самым улучшая максимальную скорость потока мочи и уменьшая остаточный объем мочи. Кроме того, α1-адреноблокаторы воздействуют и на детрузор, улучшая кровоток в его стенке и снижая явления гипоксии [9].
Профилактический прием α1-адреноблокаторов в пред- и послеоперационный период приводит к снижению частоты развития ПЗМ, ускорению восстановления адекватного мочеиспускания и предупреждению инфекционно-воспалительных осложнений со стороны мочеполовой системы. Кроме того, под воздействием боли и стресса, которые пациент испытывает при операции, повышается стимуляция симпатического отдела вегетативной нервной системы, что приводит к инфравезикальной обструкции. Последней способствует подавление рефлекса мочеиспускания после спинномозговой анестезии. Антагонисты α1-адренорецепторов могут предотвратить развитие инфравезикальной обструкции, связанной с повышением активности симпатической нервной системы, и, таким образом, уменьшить риск развития острой задержки мочеиспускания. Препарат теразозин (Сетегис) является производным хиназолина, селективным и конкурентным антагонистом α1-адренорецепторов, отвечающих за сокращение гладкой мускулатуры предстательной железы, ее капсулы, проксимального отдела уретры и основания мочевого пузыря. Данный эффект приводит к уменьшению симптомов инфравезикальной обструкции. Кроме того, отличительной особенностью теразозина является его гипотензивный эффект в дозе 5 мг, вследствие снижения периферического сопротивления за счет блокады α1-адренорецепторов.
В урологической клинике РУДН на базе ГКБ № 29 г. Москвы в течение 2004-2006 гг. проведено исследование по оценке эффективности применения α1-адреноблокатора теразозина (Сетегиса) в дозировке 5 мг в качестве средства профилактики нарушений мочеиспускания в раннем послеоперационном периоде у больных с повреждениями опорно-двигательного аппарата и у больных с патологией прямой и толстой кишки и сопутствующей ДГПЖ.
Открытое сравнительное исследование проведено на 86 пациентах, поступивших в травматологическое отделение больницы по поводу травм опорно-двигательного аппарата и 66 пациентах колопроктологического отделения с соответствующей патологией и сопутствующей ДГПЖ, которым планировалось оперативное лечение. Из группы исследования исключены пациенты, которым производились операции на мочевом пузыре, простате, уретре, принимавшие α1-адреноблокаторы в анамнезе, а также пациенты с инфекцией мочевыводящих путей.
По возрасту распределение пациентов было следующим: в основной группе количество пациентов от 50 до 59 лет составило 22 человека (27%), от 60 до 69 лет – 36 (44%), от 70 до 79 лет – 24 человека (29%). В контрольной группе распределение по возрасту было следующим – от 50 до 59 лет – 24 больных (34%), от 60 до 69 лет – 27 человек (39%) и от 70 до 79 лет 19 (27%) человек.
Диагноз ДГПЖ устанавливался на основании жалоб, пальцевого ректального исследования, шкалы IPSS, УЗИ почек и мочевого пузыря с определением количества остаточной мочи, ТРУЗИ с определением объема предстательной железы и данных урофлоуметрии. По результатам ТРУЗИ распределение пациентов по объему предстательной железы в основной и контрольной группах было следующим (табл. 1).
У 61 пациента основной (74 %) и 51 пациента (73%) контрольной группы имела место гипертоническая болезнь с уровнем артериального давления от 140/90 до 180/100 мм рт. ст., получавших до поступления в стационар гипотензивную терапию.
Оперативному лечению, проводившемуся под спинальной или эпидуральной анестезией, были подвергнуты все 152 пациента.
Пациенты с травматологической патологией были распределены следующим образом. Основную группу составили 47 пациентов, из которых 22 (47 %) имели перелом шейки бедра (из них у 15 (32%) произведен остеосинтез шейки бедренной кости, у 7 (15%) – эндопротезирование шейки бедренной кости), у 14 (30%) – перелом костей голени с последующим проведением остеосинтеза костей голени, у 11 (23%) – перелом бедра (с проведением остеосинтеза бедренной кости). Всем пациентам проводилось скелетное вытяжение или иммобилизация в предоперационном периоде. Все пациенты этой группы в течение 5 сут перед и 10 сут после операции принимали препарат теразозин (Сетегис) в дозе 5 мг однократно на ночь.
Контрольную группу составили 39 пациентов: у 13 (33%) произведен остеосинтез шейки бедренной кости, у 6 (15%) – эндопротезирование шейки бедренной кости, у 11 (28%) – остеосинтез лодыжки, у 9 (24%) – остеосинтез бедренной кости.
Результаты обследования пациентов показали, что в группе больных, получавших в течение 5 сут перед операцией и 10 сут после операции препарат Сетегис в дозе 5 мг не отмечалось нарушений акта мочеиспускания в раннем послеоперационном периоде. У одного пациента, страдающего ДГПЖ, развилась задержка мочеиспускания, которая разрешилась однократной катетеризацией мочевого пузыря. В то же время из 39 пациентов контрольной группы, не получавших препарат Сетегис в пред- и послеоперационном периодах, у 6 (15%) пациентов ранний послеоперационный период осложнился ОЗМ, что потребовало дренирования мочевого пузыря уретральным катетером в течение 5 сут на фоне приема Сетегиса и антибактериальной терапии, после чего у них восстановилось самостоятельное мочеиспускание. Двум пациентам (5%) произведена троакарная цистостомия в связи с отсутствием самостоятельного мочеиспускания после удаления катетера. Результаты исследования показали, что при контрольном измерении объема остаточной мочи у больных основной группы отмечалось его достоверное снижение после окончания приема Сетегиса, по сравнению с контрольной (табл. 2).
Результаты оценки состояния больного с ДГПЖ по международной шкале симптомов (IPSS) до начала исследования показали, что средний балл у обследуемых пациентов составил 22,1. Через 2 нед приема препарата теразозин (Сетегис) у пациентов основной группы он снизился до 16,3, тогда как в контрольной группе составлял 21,6.
Пациенты с колопроктологической патологией были распределены следующим образом. Основную группу составили 35 пациентов, контрольную группу – 31 пациент (табл. 3). Возраст пациентов в среднем составил 65 лет.
Результаты обследования 79 пациентов с колопроктологическими заболеваниями и сопутствующей ДГПЖ представлены в табл. 4.
Оперативному лечению были подвергнуты все 66 пациентов. 21 пациенту (32%) была произведена геморроидэктомия, 16 (24%) – иссечение трещины и дозированная задняя сфинктеротомия, 4 (6%) – брюшно-промежностная экстирпация прямой кишки с сигмостомией, 6 (9%) – брюшно-анальная резекция прямой кишки, 5 (8%) – электрорезекция опухоли прямой кишки, 8 (12%) – передняя резекция сигмовидной кишки, 6 (9%) – резекция сигмы и анастомоз. Операции по поводу геморроя и анальных трещин осуществлялись под внутривенной анестезией, операции на прямой и сигмовидной кишке – под комбинированным обезболиванием – эпидуральной и внутривенной анестезией.
Результаты обследования пациентов показали, что в группе, получавших в течение 5 сут перед операцией и 10 сут после операции Сетегис в дозе 5 мг, не отмечалось нарушений акта мочеиспускания в раннем послеоперационном периоде. В то же время из 31 пациента контрольной группы, не получавших препарат в пред- и послеоперационном периодах и перенесших операции на прямой и сигмовидной кишке, у 4 (13%) в раннем послеоперационном периоде отмечалась острая задержка мочеиспускания, которая потребовала катетеризации мочевого пузыря в течение 4 сут. При этом 1 пациенту, в связи с невосстановившимся самостоятельным мочеиспусканием, была произведена троакарная цистостомия.
Назначение препарата Сетегис привело к снижению суммарной оценки IPSS на 29% к уменьшению количества остаточной мочи на 41% и к увеличению максимальной скорости потока мочи на 57%.
При анализе динамики артериального давления у всех исследуемых пациентов нами отмечено, что у пациентов основной группы страдающих гипертонией, на фоне приема препарата Сетегис в дозе 5 мг отмечалось минимальное, статистически значимое снижение систалического/диастолического давления, в среднем на 5,4/3,3 мм рт. рт., тогда как у пациентов контрольной группы, страдающих гипертонией, достоверного снижения артериального давления отмечено не было. Частота сердечных сокращений не менялась в обеих группах.
Заключение
Назначение препарата Сетегис 5 мг пациентам с повреждениями опорно-двигательного аппарата и патологией прямой и толстой кишки в течение 5 сут перед и 10 сут после операции в дозировке 5 мг однократно является не только эффективным и обоснованным, так как на фоне приема препарата достоверно уменьшаются динамические и ирритативные симпотомы заболевания предстательной железы, но и экономически целесообразным.
Профилактический прием α1-адреноблокаторов в пред- и послеоперационном периоде больными с повреждениями опорно-двигательного аппарата и патологией прямой и толстой кишки предотвращает развитие нарушений мочеиспускания вплоть до развития острой задержки мочеиспускания в раннем послеоперационном периоде, в связи с чем не требуется катетеризация мочевого пузыря и, как следствие, предотвращается инфицирование мочевых путей, а следовательно, сокращаются сроки пребывания в стационаре.
Кроме того, препарат теразозин (Сетегис) является препаратом выбора среди α1-адреноблокаторов при лечении больных ДГПЖ с сопутствующей гипертонической болезнью, так как обладает небольшим гипотензивным эффектом у этой категории пациентов.
Учитывая полученные нами результаты при обследовании пациентов с повреждениями опорно-двигательного аппарата и паталогиями прямой и толстой кишки в пред- и послеоперационном периоде, можно предположить, что аналогичный эффект будет получен у больных, страдающих ДГПЖ, в пред- и послеоперационном периоде с другой хирургической паталогией.
По вопросам литературы обращайтесь в редакцию.
В. П. Авдошин, доктор медицинских наук, профессор
М. И. Андрюхин, кандидат медицинских наук, доцент
С. А. Пульбере
РУДН, Москва
Источник
