Брахитерапия при раке мочевого пузыря что это такое
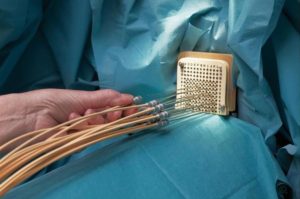
 Брахитерапия (с греч. Brachytherapy, означает короткое расстояние) – это современная технология лечения злокачественных новообразований. Один из самых эффективных способов лечения рака, особенно на ранних стадиях, а также остановке роста и распространения опухолей. Применяется при лечении рака предстательной железы, опухолей шейки матки, прямой кишки, пищевода, бронхов и других органов.
Брахитерапия (с греч. Brachytherapy, означает короткое расстояние) – это современная технология лечения злокачественных новообразований. Один из самых эффективных способов лечения рака, особенно на ранних стадиях, а также остановке роста и распространения опухолей. Применяется при лечении рака предстательной железы, опухолей шейки матки, прямой кишки, пищевода, бронхов и других органов.
Благодаря брахитерапии, возможно применение более высокой дозы радиации без ущерба на весь организм. Радиоэлемент действует только на поражённые клетки, не затрагивая при этом здоровые.
Брахитерапия заключается во внедрении в пораженный орган больного радиоактивных частиц, которые в контакте с ними, вызывают гибель злокачественных новообразований. Процедура проводится вручную или специальным аппаратом. Брахитерапия позволяет больным отказаться от радикального метода — удаления больного органа, что особенно актуально для молодых пациентов при лечении рака глаз, простаты, матки.
Противопоказания
Процедура противопоказана больным с ожидаемой продолжительностью жизни менее 5-ти лет, с наличием метастаз в организме, с индексом Глисона более 6 баллов. Если опухоль большая, брахитерапию практикуют только в комбинировании с другими методами лечения рака.
Ведущие клиники в Израиле
Виды и методы
Брахитерапия подразделяется по методу:
- внутриполостная брахитерапия практикуется на органах, имеющих полость – бронх, желудок, матка и другие. Радионуклид вводится в специальный имплантат и помещается в полость опухоли.
- внутритканевая (интерстициальная) брахитерапия применяется при лечении органов, не имеющих полости, — это простата, молочные железы, почки. В опухоль вводится радиоактивные частицы, представляющие собой иглу или зерно.
- внутрисосудистое облучение дает хороший результат при лечении рака сосудов. В стенку сосуда вводится источник излучений с помощью сосудистого зонда. Больше используется в кардиохирургии, чем в онкологии.
- поверхностная применяется, когда опухоль растёт на поверхности кожи или слизистых оболочек. Накладывается радиоактивная аппликация на пораженный раком участок кожи или слизистой оболочки.
- офтальмологическая — радиоактивные офтальмоапликаторы фиксируется на склере над опухолью. Применяется при меланоме глаза и ретинобластоме.
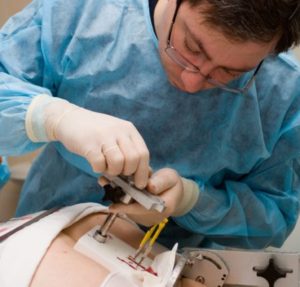 Радиоэлемент может имплантироваться на определенный срок (временная) или на всю жизнь (постоянная). Особенность временной брахитерапии заключается в введении более сильного радиоактивного элемента, на короткое время, примерно 15-20 минут, после воздействия на организм элементы извлекают. При постоянной брахитерапии внедренное низкодозное вещество действует определенное время и капсулы остаются в организме на всю жизнь. Доза радиоактивного элемента рассчитывается индивидуально, в зависимости от переносимости организма.
Радиоэлемент может имплантироваться на определенный срок (временная) или на всю жизнь (постоянная). Особенность временной брахитерапии заключается в введении более сильного радиоактивного элемента, на короткое время, примерно 15-20 минут, после воздействия на организм элементы извлекают. При постоянной брахитерапии внедренное низкодозное вещество действует определенное время и капсулы остаются в организме на всю жизнь. Доза радиоактивного элемента рассчитывается индивидуально, в зависимости от переносимости организма.
К плюсам относятся:
- короткий срок реабилитации;
- меньшее количество осложнений;
- короткий срок пребывания в стационаре, больного выписывают на следующий день после процедуры;
- минимальная кровопотеря;
- сокращается количество побочных явлений;
- сокращение количества рецидивов;
При лечении рака брахитерапией практикуются такие радиоактивные элементы как: иридий, палладий, йод, цезий. Все они отличается периодом полураспада, силой воздействия на организм, вследствие того, это влияет на область применения. В течение 7-8 недель, пациенту не рекомендуется контактировать с детьми, беременными женщинами, животными, дабы не подвергнуть их вредному излучению.
Видео по теме:
Этапы проведения
1 этап. После обследования больного, которое включается в себя УЗИ, МРТ, КТ, ЭКГ, врач-онколог хирург, радиолог подбирают подходящий метод, рассчитывают количество радиоактивного вещества. Каждые капсулы создаются индивидуально для каждого пациента. Также необходимо соблюдать диету, исключающую продукты, которые вызывают метеоризм. Желательно очистить кишечник клизмой.
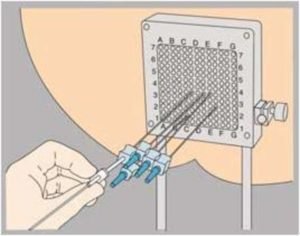 2 этап. Процедура проводится под анестезией около 1 часа. Капсулы тонкими иглами вручную или с помощью автоматического аппарата вживаются в пораженный участок. Капсулы располагаются в зависимости от формы опухоли и окружающих здоровых клеток. Весь процесс проецируется на экран.
2 этап. Процедура проводится под анестезией около 1 часа. Капсулы тонкими иглами вручную или с помощью автоматического аппарата вживаются в пораженный участок. Капсулы располагаются в зависимости от формы опухоли и окружающих здоровых клеток. Весь процесс проецируется на экран.
3 этап. В зависимости от вида брахитерапии зерна вынимают или оставляют в организме. Пациентом они никак не ощущаются, и не мешают обычной жизни.
Перед выпиской пациент от клиники получает справку о наличии в организме радиоактивных элементов, чтобы не создать сложности при досмотре в аэропортах, железнодорожных вокзалах или в других учреждениях, где проводится осмотр металлоискателем.
Осложнения
Несмотря на вышеизложенные плюсы, в данном методе есть и свои возможные осложнения:
- нарушение мочеиспускания.
- раздражение слизистой.
- эректильная дисфункция.
- нарушение работы кишечника.
- отслойка сетчатки, Повышенное внутриглазное давление (При брахитерапии глаз).
- отек, Кровянистые выделения (При брахитерапии в гинекологии).
Хотите узнать стоимость лечения рака за рубежом?
* Получив данные о заболевании пациента, представитель клиники сможет рассчитать точную цену на лечение.
Рекомендации после операции
Наши статьи — Восстановление после химиотерапии и питание после химиотерапии, брахитерапия рака предстательной железы
После процедуры, пациент обязан соблюдать определенные правила:
-
 не поднимать тяжести весом более 4 кг.
не поднимать тяжести весом более 4 кг. - выполнять резкие движения и наклоны.
- не сидеть непрерывно более 2 часов.
- отказаться от жирной и жареной пищи.
- освобождать кишечник не менее одного раза в сутки, мочевой пузырь – не реже одного раза каждые 3 часа.
- при выделении радиоактивной капсулы наружу не стоит ее брать руками. Надо взять его пинцетом, поместить в емкость и отнести в клинику для утилизации.
- пациент обязан проводить обследование у врача-онколога несколько раз в первые месяцы, и далее 2-3 раза в год. Обязательным считается анализ ПСА и УЗИ.
Стоимость
Брахитерапия – сложная технология, проводимая в специализированных центрах, которая требует специального оборудования и высококвалифицированного персонала. В Москве цены на процедуру начинаются от 300 тысяч рублей, и может достигать 500 тысяч рублей.
В Российской Федерации предусмотрено получение квот на бесплатную брахитерапию.
Процедура проводится в Обнинске, в Центре брахитерапии, а так же в клиниках Москве, Санкт-Петербурге, Новосибирске и в других регионах. Процедура проводится за счет федеральных бюджетных средств. Для этого надо подготовить необходимые документы, страховой полис и актуальные результаты обследований.
Видео — показания и противопоказания процедуры:
Источник
Брахитерапия является разновидностью лучевой терапии, основной особенностью которой является непосредственный контакт источника ионизирующего излучения с опухолевой тканью. Брахитерапия может быть как самостоятельным методом лучевой терапии, так и применяться, как часть сочетанного лучевого лечения после проведения дистанционного этапа.
Впервые брахитерапия была проведена в 1901 году доктором по фамилии Данло, который прикладывал к поверхности опухоли соли радия, содержащиеся в запаянных стеклянных трубочках, а уже в 1903 году Аббе начал проводить внутритканевую терапию путём внедрения трубочек с радием непосредственно в ткань опухоли. Несомненно, за прошедшее столетие методика проведения брахитерапии неоднократно совершенствовалась, но принцип остался исходным — максимально близкий контакт источника с опухолевой тканью для максимального её облучения и щажения окружающих здоровых тканей.
Виды брахитерапии
Выделяют низкомощностную брахитерапию, при которой выполняется имплантация микроисточников низкой мощности дозы (изотопы I-125, Pd-103, Cs-131) на постоянной основе, и высокомощностную брахитерапию, при которой облучение обеспечивается временным контактом с источниками высокой мощности дозы (изотопы Ir-192, Co-60, Cs-137), брахитерапию. Кроме того, существует так называемая pulse-dose rate, или импульсная, брахитерапия, при которой облучение идёт короткими импульсами со значительными, до часа, перерывами. Низкомощностная брахитерапия обычно применяется при планируемой дозе 2 Гр в час и менее, высокомощностная — при дозе 12 Гр в час и более. В зависимости от степени автоматизации процесса введения радиоактивных изотопов выделяют методику manual loading, при которой установка производится вручную, и remote afterloading, при которой установка производится автоматически согласно разработанному плану лечения.
Выделяют несколько видов брахитерапии в зависимости от локализации опухолевого процесса:
- Внутриполостная. Применяется для лечения злокачественных новообразований полых органов — влагалища, шейки и тела матки, анального канала, пищевода. Источники ионизирующего излучения крепятся в специальном эндостате, который и устанавливается в просвете поражённого опухолью органа.
- Интерстициальная. Другое название — внутритканевая, название котороей отражает суть метода: радиоактивный источник в виде микрокапсул («зёрен») или игл погружается непосредственно в опухолевую ткань. Преимущественно применяется при лечении рака предстательной железы.
- Внутрисосудистая. Является эффективным методом лечения повторного сужения просвета коронарных сосудов после стентирования. Сразу после выполнения баллонной ангиопластики по тому же катетеру к атересклеротической бляшке подводятся зерна, содержащие радиоактивные изотопы, на 15-20 минут.
- Поверхностная. Другое название — аппликационная; применяется при наружных локализациях опухоли, в первую очередь при раке кожи. Аппликаторы для данного метода брахитерапии должны обладать достаточной пластичностью для тесного контакта с опухолью на всём её протяжении. Применяется обычно изотоп Ir-192.
- Офтальмологическая. Проводится с помощью специальных аппликаторов с радиоизотопами Ru-106 и Sr-90 с целью лечения опухолевых поражений в области глаза — сосудистой оболочки (меланома, метастаз рака молочной железы), сетчатки (ретинобластома). Аппликатор устанавливается в условиях операционной под комбинированным наркозом (внутривенным и местным обезболиванием) — напрямую подшивается к поверхности глазного яблока в проекции опухоли. В течение нескольких дней, пока проходит лечение, пациент находится в стационаре. После достижения требуемой суммарной дозы лучевого воздействия на опухоль аппликатор снимают, также оперативным путём.
- Интраоперационная. Проводится, как ясно из названия, в ходе оперативного вмешательства на ложе удалённой опухоли. Применяется при раке молочной железы и может стать альтернативой послеоперационной дистанционной лучевой терапии, что особенно важно при лечении рецидивной опухоли, когда ранее уже проводилась дистанционная лучевая терапия, а также при саркомах мягких тканей — в случаях, когда функционально невозможно достичь «чистых» краёв резекции.
Заболевания, при которых проводится брахитерапия
В отдельных клинических ситуациях брахитерапию рассматривают как адекватную альтернативу дистанционной лучевой терапии, в других же — как обязательный компонент комплексного лечения.
Основными злокачественными опухолями, по поводу которых проводится брахитерапия, являются:
- Рак предстательной железы. Основными критериями, по которым отбираются больные, которым возможно провести брахитерапию, являются следующие: клиническая стадия Т1—Т2аN0M0, общее значение баллов по шкале Глисона ≤6 (3+3) либо 7 (3+4), ПСА ≤10 нг/мл, объем предстательной железы ≤50 cм 3 — то есть пациенты, относящиеся к благоприятной прогностической группе. Следует отметить, что в рекомендациях Американской ассоциации брахитерапии показания для проведения интерстициальной брахитерапии значительно шире и предполагают возможность проведения такого лечения и пациентам с Т2с-Т3 стадиями, суммой баллов по шкале Глисона до 10 и уровнем ПСА до 50 нг/мл. Однако для больных с неблагоприятным и промежуточным прогнозом брахитерапия рекомендуется как часть комбинированного лечения — в сочетании с дистанционной лучевой терапией иили гормонотерапией.
- Рак шейки матки. Брахитерапия проводится всем пациенткам, которым не планируется проведение хирургического лечения, а также как послеоперационное лечение в случае значительного риска рецидива во влагалище или параметрии после завершения дистанционного этапа.
- Рак тела матки. Возможно проведение брахитерапии как в послеоперационном, так и в послеоперационном варианте. Так, при II стадии заболевания достаточно проведения одной только брахитерапии при низком риске рецидива и при адекватном объёме удаленных лимфоузлов, а при высоких группах риска и в отсутствие лимфодиссекции брахитерапия дополняется дистанционным облучением.
- Базальноклеточный рак кожи. Так как данная опухоль часто располагается в области лица, проведение хирургического лечения может привести к появлению значимого косметического дефекта. С другой стороны, базалиома может быть излечена только лучевым методом, поэтому проведение аппликационной брахитерапии может быть методом выбора у достаточно широкого круга пациентов.
- Опухоли головы и шеи. В настоящее время брахитерапия не является стандартной опцией для лечения опухолей данной локализации, но эта возможность активно исследуется для опухолей наружной локализации (например, в полости рта) на ранних стадиях.
- Рак пищевода. Брахитерапия может быть проведена в рамках комплексного лечения местнораспространённой опухоли как дополнительный по отношению к дистанционной лучевой терапии метод.
- Саркомы мягких тканей. Проведение брахитерапии позволит локально — на собственно опухолевый узел или на край операционной раны, в котором выявлены опухолевые клетки, — подвести большую дозу и тем самым не только улучшить результаты лечения, но и избежать как возможной калечащей операции, так и серьёзных осложнений (атрофия мышц, контрактура суставов). Особое значение брахитерапия сарком имеет у пациентов детского возраста, так как позволяет снизить дозную нагрузку на зоны роста.
Подготовка к брахитерапии
Как и перед любым другим этапом противоопухолевого лечения, требуется тщательная диагностика для оценки текущего состояния пациента и степени прогрессирования его заболевания. Планирование брахитерапии происходит в специализированной компьютерной программе, аналогичной таковой для планирования дистанционной лучевой терапии. Оконтуривание объёмов, которые необходимо подвергнуть лучевому воздействию, и здоровые структуры определяются на основании данных топометрической компьютерной томографии; более современной методикой является планирование на основании данных магнитно-резонансной томографии. Возможно совмещение изображений, полученных во время КТ, МРТ и ПЭТ, для большей точности определения облучаемых объёмов. Следует отметить, что внедрение эндостатов осуществляется до топометрической предлучевой подготовки. В случае проведения внутритканевой брахитерапии зерна или иглы, несущие изотоп, имплантируются после расчёта плана облучения. Установка как эндостатов, как и зёрен и игл, проводится под местной анестезией; при лечении рака предстательной железы выполняется эпидуральная анестезия.
В случае проведения низкомощностной внутриполостной брахитерапии пациент остаётся в изолированном помещении до удаления источника из его тела (как правило, от 12 до 24 часов), поэтому для проведения такого вида лечения требуется госпитализация. Напротив, при проведении высокомощностной брахитерапии процедура длится значительно более короткий период времени (около получаса), и поэтому может быть проведена амбулаторно.
Разовая и суммарная дозы излучения, равно и количество фракций, назначаются индивидуально в зависимости от локализации опухолевого процесса, стадии заболевания и проведённого ранее лечения. Так, для базальноклеточного рака кожи требуемая суммарная доза составляет 24-36 Гр, разовая доза составляет 3-5 Гр; при раке тела матки разовые дозы составляют 7 Гр по 3 фракции или 6 Гр по 5 фракций при радикальном курсе, 5 Гр по 4 фракции при послеоперационном курсе в сочетании с дистанционной лучевой терапией.
Побочные эффекты
Несмотря на то, что брахитерапия значительно минимизирует дозную нагрузку на прилежащие здоровые ткани, полностью исключить её невозможно. Побочные эффекты при брахитерапии аналогичны таковым при дистанционной лучевой терапии и зависят от локализации опухолевого процесса. Так, при лечении по поводу рака кожи возможно появление эритемы, при лечении органов малого таза — реакции со стороны мочевого пузыря и кишечника. Для их купирования врачом назначается соответствующая сопроводительная терапия.
Помимо рекомендаций по предупреждению и лечению реакций, связанных непосредственно с проведением брахитерапии, существует и ряд общих рекомендаций после выполнения внутритканевой брахитерапии:
- Ограничение физических нагрузок,
- Соблюдение диеты, исключающей острую, жареную и жирную пищу,
- Не сажать на колени маленьких детей первые два месяца после операции и не находиться вблизи беременных женщин. Это связано с тем, что во время полураспада введённых изотопов существует риск лучевого воздействия, хоть и незначительного, на окружающих.
- В случае назначения лечения по поводу другого заболевания, особенно физиотерапевтических процедур, необходима предварительная консультация онколога до начала их выполнения.
Наконец, важно помнить о динамическом наблюдении. Дата визита к онкологу назначается, исходя из локализации опухолевого процесса, по поводу которого проводилось лечение. Так, в случае офтальмологической патологии контрольный визит назначается обычно спустя 3-4 месяца после завершения брахитерапии, при раке предстательной железы — спустя 2-3 месяца.
Список литературы:
- Рак шейки матки. Клинические рекомендации Ассоциации Онкологов России. 2020.
- Рак тела матки и саркомы матки. Клинические рекомендации Ассоциации Онкологов России. 2020.
- Рак предстательной железы. Клинические рекомендации Ассоциации Онкологов России. 2020.
- Каприн А.Д. и соавт. Внутритканевая лучевая терапия (брахитерапия) рака предстательной железы. Собственный опыт работы Национального медицинского исследовательского радиологического центра Минздрава России. Русский медицинский журнал. 2017, № 27. С.2011-2014.
- Винокурова А.С. и соавт. Аппликационная брахитерапия в лечении местнораспространённого базальноклеточного рака кожи. Академический журнал Западной Сибири. 2017. Том 13, № 3 (70), с. 31-33.
- Белоусов А.В., Лыкова Е.Н. Введение в брахитерапию. Москва, 2019.
- Жуманкулов А.М. и соавт. Брахитерапия злокачественных опухолей полости рта и ротоглотки. Опухоли головы и шеи. 2015. № 4, том 5. С. 41-46.
- Литвинов Р.П. и соавт. Брахитерапия местнораспространённого рака пищевода как компонент радикального лечения: преимущества и риски. Злокачественные опухоли. 2016. № 4.
Источник
