Больные раком мочевого пузыря

Рак мочевого пузыря – это злокачественная опухоль слизистой оболочки или стенки мочевого пузыря. Проявлениями патологии служат гематурия, дизурия, боли над лобком. Диагностика требует проведения цитологического исследования мочи, ТУР-биопсии, цистографии, УЗИ мочевого пузыря, томографии. Программа лечения заболевания может включать хирургический подход (ТУР мочевого пузыря, цистэктомию, лазерную en-bloc резекцию) или консервативную тактику (системную химиотерапию, лучевую терапию). С целью профилактики рецидивов используется внутрипузырная химиотерапия и БЦЖ-терапия.
Общие сведения
Рак мочевого пузыря встречается в 70% случаев всех новообразований мочевыводящих органов, с которыми сталкиваются специалисты в сфере клинической онкоурологии. В структуре общей онкопатологии доля неоплазий данного органа составляет 2-4%. Среди злокачественных опухолей различных локализаций по частоте развития рак мочевого пузыря занимает 11-е место у женщин и 5-е у мужчин. Патология чаще встречается у жителей индустриально развитых стран; возраст заболевших преимущественно старше 65-70 лет.
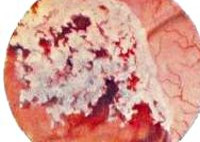
Рак мочевого пузыря
Причины
Общепризнанной гипотезы в отношении этиологии рака мочевого пузыря не существует. Однако известны отдельные факторы риска, которые в значительной степени способствуют развитию злокачественной опухоли:
- Редкое мочеиспускание. Ряд исследований указывает на повышенную вероятность возникновения неоплазии при длительном стазе мочи в мочевом пузыре. Различные метаболиты, содержащиеся в моче в высоких концентрациях, обладают опухолегенным действием и вызывают злокачественную трансформацию уротелия.
- Заболевания мочеполовой сферы. Длительной задержке мочи в мочевом пузыре может способствовать различная урогенитальная патология: простатит, аденома и рак простаты, дивертикулы мочевого пузыря, уролитиаз, хронический цистит, стриктуры уретры и др.
- Инфекции. Вопрос о роли папилломавирусной инфекции в этиологии новообразования остается дискуссионным. Паразитарная инфекция – мочеполовой шистосомоз в значительной мере способствует канцерогенезу.
- Профвредности. Доказана корреляция между частотой случаев рака мочевого пузыря и профессиональными вредностями, в частности, длительным контактом с ароматическими аминами, фенолами, фталатами, противоопухолевыми препаратами. В группе находятся риска водители, маляры, дизайнеры, художники, работники кожевенной, текстильной, химической, лакокрасочной, нефтеперерабатывающей промышленности, медработники.
- Прочие канцерогены. Высоким канцерогенным потенциалом обладает курение табака: курильщики страдают от оухолей мочевого пузыря в 2-3 раза чаще, чем некурящие. Неблагоприятное воздействие на уротелий оказывает употребление хлорированной питьевой воды, увеличивающее вероятность возникновения новообразований в 1,6-1,8 раз.
- Наследственность. В некоторых случаях неоплазия может быть детерминирована генетически и связана с семейной предрасположенностью.
Классификация
Рак мочевого пузыря различается по гистологическому типу, степени дифференцировки клеток, характеру роста, склонности к метастазированию. Учет этих характеристик чрезвычайно важен при планировании лечебной тактики. По морфологическим признакам наиболее часто встречаются переходно-клеточные (80-90%) и плоскоклеточные опухоли (3%), аденокарцинома (3%), папиллома (1%), саркома (3%). По степени анаплазии клеточных элементов различают низко-, умеренно- и высокодифференцированные неоплазии.
Практическое значение имеет степень вовлеченности в опухолевый процесс различных слоев стенки органа, в связи с чем говорят о поверхностном раке низкой стадии или высокостадийном инвазивном раке. Новообразование может иметь папиллярный, инфильтративный, плоский, узелковый, внутриэпителиальный, смешанный характер роста. Согласно международной системе ТNМ различают следующие стадии неоплазии:
- Та – неинвазивная папиллярная карцинома
- Tis – плоская карцинома in situ
- Т1 – опухолевая инвазия затрагивает субэпителиальную ткань
- Т2 – рак распространяется на мышечный слой (Т2а – поверхностный, Т2b – глубокий)
- Т3 – в процесс вовлекается паравезикальная клетчатка
- Т4 – инвазия затрагивает прилежащие органы (влагалище, матку, предстательную железу, брюшную стенку)
- N1-3 – выявляется метастазирование в одном (N1) или многих (N2) регионарных лимфоузлах либо в общих подвздошных лимфатических узлах (N3).
- М1 – обнаруживается метастазирование в отдаленные органы
Симптомы
Ранним проявлением рака мочевого пузыря служит выделение крови с мочой – микрогематурия или макрогематурия. Незначительная гематурия приводит к окрашиванию мочи в розоватый цвет, может быть эпизодической и не повторяться длительное время. В других случаях сразу же развивается тотальная гематурия: при этом моча становится кровавого цвета, могут выделяться сгустки крови. Длительная или массивная гематурия иногда вызывает развитие тампонады мочевого пузыря и острой задержки мочи, происходит прогрессирующее снижение гемоглобина и анемизация пациента.
По мере разрастания опухоли больных начинают беспокоить дизурические симптомы и боли. Мочеиспускание, как правило, становится болезненным и учащенным, с императивными позывами, иногда – затрудненным. Отмечаются боли в области лона, в паху, в крестце. Вначале болевые ощущения возникают только на фоне наполненного мочевого пузыря, затем, при прорастании мышечной стенки и прилежащих органов, становятся постоянными.
Многие симптомы рака мочевого пузыря не являются специфичными и могут встречаться при других урологических заболеваниях: цистите, простатите, мочекаменной болезни, туберкулезе, аденоме простаты, склерозе шейки мочевого пузыря и т. д. Поэтому зачастую пациенты на ранних стадиях длительно и неэффективно лечатся консервативно. В свою очередь, это затягивает своевременную диагностику и начало лечения, ухудшая прогноз.
Осложнения
Сдавление устья мочеточника вызывает нарушение оттока мочи из соответствующей почки. Развивается гидронефроз, острый болевой приступ по типу почечной колики. При сдавливании обоих устьев нарастает почечная недостаточность, которая может закончиться уремией. Некоторые виды рака с инфильтрирующим ростом склонны к распаду и изъязвлению пузырной стенки. На этом фоне легко возникают мочевые инфекции (цистит, пиелонефрит), моча приобретает гнойный характер и зловонный запах. Прорастание неоплазии в прямую кишку или во влагалище приводит к образованию пузырно-прямокишечных и пузырно-влагалищных свищей, сопровождающихся соответствующей симптоматикой.
Диагностика
Для выявления рака и определения стадии онкопроцесса требуется проведение комплексного клинико-лабораторного и инструментального обследования. Стандарт лабораторной диагностики включает проведение общего анализа мочи для определения гематурии, цитологического исследования осадка для обнаружения атипичных клеток, бактериологического посева мочи для исключения инфекции, теста на специфический антиген ВТА. Исследование крови обычно подтверждает анемию различной степени, указывающую на кровотечение.
- УЗИ мочевого пузыря. Выявляет опухолевые образования диаметром более 0,5 см, расположенные преимущественно в области боковых пузырных стенок. Для обнаружения неоплазии в зоне шейки наиболее информативно трансректальное сканирование. Иногда используется трансуретральная эндолюминальная эхография, проводимая с помощью датчика, введенного в полость мочевого пузыря.
- Томографическая диагностика. Наиболее ценные и информативные методы – КТ и МРТ мочевого пузыря. Позволяют оценить глубину распространения опухолевого процесса, выявить опухоли незначительных размеров, которые не доступны эхографической визуализации.
- Эндоскопия мочевого пузыря. Обязательным визуализирующим методом диагностики служит цистоскопия, при которой производится уточнение локализации, размеров, внешнего вида опухоли, состояния устьев мочеточников. Эндоскопическое исследование может дополняться биопсией, позволяющей провести морфологическую верификацию новообразования.
- Рентгенодиагностика. Из методов лучевой диагностики при раке мочевого пузыря проводится цистография, выявляющие дефект наполнения и деформацию контуров пузырной стенки и позволяющие судить о характере роста опухоли. Тазовую венографию и лимфангиоаденографию проводят для выявления вовлеченности тазовых вен и лимфатического аппарата.
Для выявления местных и отдаленных метастазов рака мочевого пузыря прибегают к проведению УЗИ органов брюшной полости, рентгенографии грудной клетки, УЗИ малого таза, сцинтиграфии костей скелета.

МРТ таза (Т1 и DWI). Опухоль стенки мочевого пузыря справа, с ограничением диффузии
Лечение рака мочевого пузыря
Радикальное лечение может быть выполнено только хирургическими способами. При этом способ и вид операции коррелирует со стадией онкопроцесса. Виды оперативных вмешательств при раке мочевого пузыря:
- ТУР мочевого пузыря. При мышечно неинвазивном раке выполняется эндоскопическая операция – трансуретральная резекция стенки мочевого пузыря с опухолью. В ходе ТУР опухоль удаляется с помощью резектоскопа через мочеиспускательный канал.
- Лазерная en-bloc резекция. Наиболее современный метод – лазерная тулиевая en-bloc резекция. Данный метод позволяет убрать опухоль единым блоком вместе с мышечным слоем, что очень важно при гистологическом исследовании для оценки степени инвазии.
- Цистэктомия. К резекции мочевого пузыря (открытой, лапароскопической, робот-ассистированной) в последние годы прибегают все реже ввиду высокого процента рецидивов, осложнений и низкой выживаемости. В большинстве случаев при инвазивном раке мочевого пузыря показана радикальная цистэктомия. При проведении данной операции мочевой пузырь удаляют единым блоком с предстательной железой и семенными пузырьками у мужчин; придатками и маткой у женщин. Одновременно производится удаление части или всей уретры, тазовых лимфоузлов.
Для замещения удаленного органа используются следующие способы:
- имплантация мочеточников в кожу – уретерокутанеостомия
- отведение мочи в сигмовидную кишку – способ деривации мочи по Брикеру
- формирование кишечного резервуара по Штудеру (ортотопического мочевого пузыря) из тканей тонкой кишки, желудка, толстой кишки. Радикальная цистэктомия с кишечной пластикой является оптимальной, поскольку позволяет сохранить возможность удержания мочи и мочеиспускания.
Хирургическое лечение может дополняться дистанционной или контактной лучевой терапией, системной или внутрипузырной иммунотерапией.
Прогноз и профилактика
При неинвазивном раке показатель 5-летней выживаемости составляет около 85%. Гораздо менее благоприятен прогноз для инвазивно растущих и рецидивирующих опухолей, а также рака мочевого пузыря, дающего отдаленные метастазы. Снизить вероятность развития опухоли поможет отказ от курения, исключение профессиональных вредностей, употребление очищенной питьевой воды, ликвидация уростаза. Необходимо проведение профилактического УЗИ, исследования мочи, своевременного обследования и лечения у врача-уролога при симптомах дисфункции мочевых путей.
Источник
Рак мочевого пузыря входит в десятку наиболее распространенных в мире онкологических заболеваний, да и по частоте возникновения рецидивов – в 70-75% случаев – злокачественные новообразования этой локализации превосходят почти все прочие разновидности. Каждый год в России от этой болезни умирают более 8 тысяч онкоурологических пациентов. Vademecum разбирался, почему рак мочевого пузыря, уверенно диагностировать который клиницисты давно научились, по-прежнему остается фатальным для пациентов и дорогим для системы здравоохранения заболеванием.
По данным European Association of Urology, в мире насчитывается 2,7 млн человек, страдающих раком мочевого пузыря. Ежегодно онкологи и урологи впервые диагностируют около 430 тысяч новых случаев этого заболевания, каждый год рак мочевого пузыря уносит 165 тысяч жизней. В России в 2016 году было зарегистрировано 15 924 новых случая болезни (подробнее – в инфографике «Сфера внимания»), в общей сложности на учете по итогам прошлого года состояли 104 401 человек. «В структуре всех злокачественных новообразований рак мочевого пузыря занимает девятое место, он встречается чаще меланомы и рака печени, – замечает замдиректора по науке Национального медицинского исследовательского радиологического центра Борис Алексеев. – Но эта очень мучительная патология оказалась, если можно так выразиться, «на обочине» онкологии».
Низкую осведомленность о самом факте существования рака мочевого пузыря иллюстрирует резюме соцопроса, проведенного в январе 2017 года The European Cancer Patient Coalition в партнерстве с фармкомпанией Roche. В исследовании приняли участие 9 629 респондентов из шести стран. Результаты оказались плачевными: каждый десятый опрошенный в принципе не знал о существовании этого онкозаболевания, 62% респондентов не имели представления о признаках или симптомах заболевания. При этом 10% опрошенных сталкивались с наличием крови в моче; 20%, по их признанию, ощущали в течение трех или более месяцев абдоминальные боли; еще 25% на протяжении трех или более месяцев испытывали учащенные позывы к мочеиспусканию; 33% опрошенных в течение того же временного отрезка беспокоили боли в нижней части спины. Таким образом, у 88% участников опроса были зафиксированы симптомы, характерные в том числе и для рака мочевого пузыря. Но более половины респондентов (52%)при этом не обратились к врачу, поскольку «решили посмотреть, пройдут ли эти проявления сами по себе». В мае 2017‑го Roche опросила 466 российских онкологов и урологов, также подтвердивших низкую осведомленность граждан об этом заболевании: около 34% россиян с установленным диагнозом «рак мочевого пузыря» впервые обратились к врачу по прошествии более чем полугода с момента появления первых симптомов.
Нажмите, чтобы увеличить
КАНЦЕРОГЕНДЕРНЫЕ РАЗЛИЧИЯ
Онкозаболевания этой локализации в три раза чаще встречаются у мужчин, чем у женщин, рост заболеваемости в популяции начинается в среднем с 50 лет, но именно эта аудитория, по оценкам клиницистов, уделяет своему здоровью преступно незначительное внимание. «Основной симптом – наличие крови в моче, и, к счастью, он бывает и в самом начале – когда опухоль может быть поверхностной, излечиваемой. Любая примесь крови в моче – абсолютное показание к тщательному обследованию, проведению цистоскопии, если исключаются другие причины гематурии, например, мочекаменная болезнь, – объясняет Борис Алексеев. – Но мужчины не всегда настороженно относятся к этому симптому – могут мочиться кровью месяц, три и не ходить к урологу. Существенную роль играют психологические причины – люди просто стесняются обратиться к врачу».
Гематурия может быть симптомом цистита или аденомы простаты, но дифференцировать диагноз урологи способны очень быстро. «Уровень подготовки врачей первого звена определяет, насколько быстро будет поставлен диагноз. Часто путают рак мочевого пузыря с циститом – частые позывы к мочеиспусканию, рези. Но для профильных специалистов это не составляет труда, – считает заведующий урологическим отделением НМИЦ онкологии им. Н.Н. Блохина Всеволод Матвеев. – Самый быстрый, неинвазивный и относительно дешевый метод – УЗИ, после необходимо сделать цитологическое исследование мочи. Самый надежный метод, если он выполняется опытным урологом, – цистоскопия, но, поскольку процедура не очень приятная и инвазивная, начинают, как правило, с УЗИ». Впрочем, к услугам врачей – и возможности КТ, МРТ, последняя, по сути, позволяет поставить диагноз до гистологии и биопсии. «Самый точный метод – эндоскопический, плюс взятие биопсии с мышечным слоем, что дает правильную стадию заболевания, – подтверждает заведующий урологическим отделением ГКБ им. Д.Д. Плетнева, завкафедрой урологии и андрологии ИППОФМБЦ им. Бурназяна ФМБА Алексей Мартов. – С помощью эндоскопического же вмешательства, через уретру, лечатся и все поверхностные формы рака мочевого пузыря, кроме наивысшей степени злокачественности».
У этой коварной во многих смыслах болезни есть характерная особенность: онкологи и урологи, с которыми беседовал Vademecum, говоря о раке мочевого пузыря, замечают, что речь, по сути, идет о двух различных заболеваниях – поверхностном и инвазивном. Разница – в тактике лечения.
При поверхностных опухолях стандартом считается резекция опухоли и в дальнейшем, как правило, внутрипузырная химио- или иммунотерапия. «При поверхностном раке, когда поражается слизистая и максимум подслизистая, основной метод лечения – трансуретральная резекция стенки мочевого пузыря и введение каких‑либо лекарств непосредственно в мочевой пузырь», – поясняет главный уролог Минздрава РФ, руководитель Клиники урологии МГМСУ Дмитрий Пушкарь. Впрочем, по поводу основного метода лечения – резекции – идут дискуссии. «Я сторонник того, чтобы людям молодым, не отягощенным сопутствующей выраженной патологией, проводить открытые резекции, на Западе называемые парциальными цистэктомиями. Поскольку это уменьшает количество рецидивов, что доказано мировой статистикой, – говорит заведующий урологическим отделением МГОБ №62 Валерий Широкорад. – Почему? Потому что, когда мы делаем трансуретральную резекцию, мы дробно срезаем опухоль, получая в итоге «фарш», изучив который, морфологи должны сказать, есть или нет прорастание в мышечный слой. Даже при трансуретральных резекциях en block при средних и крупных размерах опухоли удалить ее через уретру без дробления невозможно. Но у меня всегда возникает вопрос: а можно ли в таком случае адекватно оценить наличие этого мышечного слоя и глубину инвазии опухоли в него? При открытых же резекциях мы удаляем все единым комплексом, на всю толщину стенки, и морфолог сам вырезает себе материал».
И тут есть нюансы, разделяющие клиницистов на два противоборствующих лагеря. После трансуретральной резекции больные находятся в отделении куда меньше, да и само вмешательство – эндоскопическое, несравнимое с открытым по степени травматичности. При открытой резекции пациенту на протяжении 8-10 дней приходится ходить с катетером, пока срастается место разреза мочевого пузыря. «Да, трансуретральные резекции, безусловно, нужны, особенно при рецидивных опухолях. Но и на Западе все чаще говорят, что при первичной опухоли правильнее делать открытые резекции и отходить от принятых ранее стандартов», – добавляет Широкорад.
Другая особенность болезни – анатомическая. Поскольку слизистая мочевого пузыря практически не имеет сосудов, всасываемость препаратов настолько низкая, что их дозировки, по определению самих врачей, «бешеные». «Если для внутривенных введений доза Митомицина‑С не превышает 12 мг, то для внутрипузырного введения мы используем дозу 40-50 мг. То же самое для вакцины БЦЖ: при реакции Манту вводится 2 мг полуживой вакцины, а в мочевой пузырь – шесть введений 150 мг, а затем – восемь введений 120 мг», – описывает медикаментозные схемы Валерий Широкорад. К счастью, химиотерапия рака мочевого пузыря – тот случай, когда препараты относительно недороги.
Но и здесь не обходится без проблем, если не финансовых, то административных. Туберкулезная вакцина применяется в терапии рака мочевого пузыря с конца 70‑х годов, но документального разрешения от санитарно‑эпидемиологической службы на ее использование фактически нет. «В Европе разрешено сливать в унитаз и смывать полуживую вакцину туберкулеза – там доказанным фактом считается, что канализационные системы, водоканалы и очистные сооружения совершенно спокойно с этим справляются. В России это официально не разрешено, но во многих центрах делается. Когда используется такая вакцина, в медучреждении должны применяться специальные емкости для противотуберкулезной обработки, куда больные должны мочиться, все эти склянки нужно обрабатывать и так далее, – поясняет на условиях анонимности интригу один из интервьюируемых Vademecum онкологов. – Лет семь назад немецкая компания Medac [производитель препарата для внутрипузырной БЦЖ‑терапии. – Vademecum] пыталась продавить этот вопрос в России, но с нашим тогда главным санитарным врачом господином Онищенко у них ничего не получилось».
Еще одна характерная черта рака мочевого пузыря – «привычка возвращаться»: до 70-75% больных сталкиваются с болезнью повторно. «Наверное, ни одна злокачественная опухоль в мире не имеет такого количества местных рецидивов, – рассказывает Валерий Широкорад из МГОБ №62. – Опухоль располагается на какой‑то стенке мочевого пузыря, когда человек мочится, пузырь сокращается – и все стенки «обнимают» эту опухоль. И так происходит пять – семь раз в день. То есть опухоль контактирует практически со всей слизистой и дает отсевы на любую другую стенку».
ТРУДОВЫЕ РЕЗЕРВУАРЫ
Если смотреть онкологическую статистику, то данные по злокачественным новообразованиям мочевого пузыря в сравнении с другими локализациями, на первый взгляд, выглядят очень даже неплохо. На больных с опухолевым процессом I‑II стадий пришлось 74% от общего числа впервые установленных в 2016 году диагнозов. Доля пациентов с заболеванием I стадии достигла почти 47%. Но у остальных пациентов, говорят онкоурологи, будут инвазивные раки, распространившиеся в мышечный слой и требующие иного – комбинированного, сочетающего внутривенную терапию с хирургией, – лечения. «Когда рак представлен инвазивной опухолью, речь идет не о трансуретральной резекции, а, к сожалению, об удалении мочевого пузыря. Пациент будет жить с выведенными в кожу мочеточниками или с искусственным мочевым пузырем. Эта ситуация более сложная, но и эти пациенты тоже имеют достойное качество жизни», – считает Дмитрий Пушкарь. После органоуносящего вмешательства таким больным формируют искусственные резервуары, сделанные из части тонкого кишечника, а затем системы отведения мочи – адаптация организма ко всем этим изменениям весьма продолжительна и мучительна. Кроме этого, у большинства пациентов после выполненной кишечной пластики начинаются проблемы с водно‑электролитным балансом. «Я уже не говорю об объеме и тяжести операции, о сложностях послеоперационного периода, но у пациентов начинается повышение шлаков в крови и пиелонефриты. Кишка же как вырабатывала свой сок, так и вырабатывает, а сок – это раздражитель, он все равно забрасывается в мочеточники, в лоханку, – объясняет Валерий Широкорад. – Основная причина смерти больных в течение первого года после удаления мочевого пузыря и формирования кишечных резервуаров – это не прогрессирование рака, а нарушения и воспалительные осложнения со стороны верхних мочевыводящих путей – мочеточников, лоханки, почек». По оценкам онкологов, на адаптацию пациента уходит от шести до 12 месяцев. В течение этого периода больным необходимы реабилитационные мероприятия – от инфузионной терапии и обучения использованию вновь сформированного мочевого резервуара до тщательных регулярных обследований, цель которых – удостовериться, что заболевание не прогрессировало и пациент не нуждается в химиотерапии. Очень долгое время пациенты с распространенным раком мочевого пузыря были лишены возможности получать комбинированную терапию. «Лет 30 в области лечения этой патологии фактически был застой – не было новых методов. Пятилетняя выживаемость при распространенном раке мочевого пузыря не превышала 6% случаев, – рассказывает Борис Алексеев. – Химиотерапия традиционно проводится на основе препаратов платины, а они очень токсичны в отношении почек. И половину больных – 48,4% – мы фактически ничем не могли лечить из‑за того, что у них почечная недостаточность, электролитные нарушения. Поэтому появление иммунотерапевтических препаратов стало определенным окном возможностей для этой группы больных». С тезисом о перспективе для пациентов, у которых невозможно проведение химиотерапии или переставших на нее отвечать, соглашается и Всеволод Матвеев из НМИЦ онкологии: «Это не универсальное лечение. Мы не знаем, сколько нужно проводить иммунотерапию и когда ее прекращать, подобных вопросов очень много, но очевидно, что это лечение – прорыв». Беда в том, что в России препараты для иммунотерапии рака мочевого пузыря пока не зарегистрированы, впрочем, и в США иммунотерапия для лечения этого онкозаболевания была одобрена FDA лишь в 2016 году.
Другая проблема, связанная с комбинированным лечением онкобольных, – междисциплинарная, состоящая в нарушении так называемой онкологической преемственности. Пациенты с онкоурологическими патологиями лечатся как в общих урологических отделениях, так и в онкоурологических. И такая схема частью профсообщества оценивается резко негативно. «Онкологических больных сейчас оперируют практически все, не имея при этом в штате ни химиотерапевтов, ни лучевых терапевтов. Но мочевой пузырь – одна из тех локализаций, при которых практически всегда, рано или поздно, мы применяем комбинированное лечение. Когда больных оперируют в урологических стационарах, им делают трансуретральные резекции и «пинают» -а теперь идите к онкологам по месту жительства, -описывает традиционную для страны практику Валерий Широкорад. – Но у поликлиник нет возможности делать какие‑то функциональные исследования, измерять давление в резервуаре, смотреть МРТ, КТ, цистоскопии, тем более прокапывать. Поэтому если вы прооперировали, то, пожалуйста, ведите этого больного до конца, выполняйте обследования с определенной регулярностью – проводите диспансерное наблюдение и адекватную реабилитацию». Еще один пример приводит Борис Алексеев: «Больных могут долго лечить эндоскопическими методами, невзирая на то, что им необходима радикальная цистэктомия. Это разные подходы – урологов и онкологов. Урологам важнее сохранить больному мочевой пузырь, и иногда они запускают пациентов, онкоурологи же подходят к делу более агрессивно, поэтому результаты лечения в специализированных онкоцентрах существенно лучше». Но контраргументы – как программные, таки лежащие исключительно в практической плоскости, – находятся и у второй стороны. «Споров здесь быть не может. Неважно, куда попадает пациент – большинство урологических отделений сегодня занимаются онкологией», – настаивает Дмитрий Пушкарь. Единственное, что тревожит в этом смысле урологов, так это нехватка в их клиниках онкологических коек. В возглавляемом Алексеем Мартовым урологическом отделении ГКБ им. Д.Д. Плетнева ежегодно проводится порядка 2 500 операций, около 25% из них – по онкопрофилю. «И слава богу, что сейчас больные могут попадать в общие урологические отделения, потому что если бы они не были распределены таким образом по больницам – все бы задохнулись, – убежден Мартов. – Должен быть системный подход, кто возражает? Онкозаболевания действительно требуют лучевой и химиотерапии. Но если госпитализация связана с экстренной ситуацией или «случайной находкой», то возможность для пациента получать адекватное лечение в урологических отделениях, имеющих высокие эндоскопические технологии и соответствующую компетенцию врачей, будет только в плюс. Мы применяем все это на потоке, а после операции оформляем больного в онкодиспансер, как и положено. Конечно, мы должны, кроме прочего, иметь сертификат онкологов». В пользу «урологической» схемы маршрутизации больных раком мочевого пузыря говорит тот факт, что онкоурологические подразделения (несмотря на то, что на онкоурологию приходится 15-20%всех злокачественных новообразований) организованы далеко не во всех диспансерах или крупных профильных больницах. «В Новосибирске, городе‑миллионнике, онкоурологии нет вообще. В Нижнем Новгороде только в прошлом году стали планировать открытие такого отделения на базе онкодиспансера, да и то – после войны и скандалов», – утверждает один из собеседников Vademecum.
УПАЛ-СЖАЛСЯ
Мерящиеся компетенциями урологи и онкологи мгновенно забывают о распрях, как только речь заходит о тарифах на терапию пациента с раком мочевого пузыря. Это заболевание, уступая по распространенности опухолям других локализаций, находится в группе лидеров по затратам на профильную помощь. «Это одно из самых дорогих заболеваний как в диагностике, так и в лечении, – говорит Алексей Мартов. – В первый год пациент должен быть обследован с помощью эндоскопии четыре раза: по меньшей мере это амбулаторный прием, а правильнее – стационар и наркоз. Во второй год – тоже не менее четырех раз. И если не будет рецидива, то затем раз в полгода на протяжении трех лет, затем – пожизненно раз в год. Все это – эндоскопические осмотры, что дорого, а у мужчин требует еще и наркоза, плюс химиотерапия и иммунотерапия». По оценкам клиницистов, открытая операция при неосложненном течении заболевания обходится как минимум в 350 тысяч рублей, к этой сумме нужно прибавить затраты на проведение исследований, количество которых переваливает за два десятка. Если говорить о лапароскопических операциях, то к цене прибавляются затраты на закупку используемых расходников и амортизацию оборудования. Действующие тарифы, даже на высокотехнологичную медпомощь вне базовой программы ОМС, и близко не покрывают расходы на операции – ни по профилю «Онкология», ни по профилю «Урология» (подробнее – в таблице «Ложные позывы»).«У онкологов, если метод идет с низкоинтенсивным лазерным облучением, которое у нас тоже есть, это еще как‑то оплачивается, а в обычных урологических отделениях за все эти продвинутые способы диагностики как за ВМП не платят, хотя это реально высокие технологии, – сокрушается Алексей Мартов. – У нас вообще перверсия с тарифами ВМП. Банальнейшая операция по установке петли при недержании мочи у женщин, которую у меня проводит ординатор второго года, включена в перечень, а тяжелейшее вмешательство по удалению коралловидных камней, когда нельзя сделать эндоскопическую операцию, а нужно делать открытую, – не входит. А чтобы сделать такую операцию, хирургу нужно учиться 20 лет».
Но тарифы – болезнь административно‑финансовая и, в общем‑то, излечимая. Тогда как рак мочевого пузыря остается единственным в мире онкоурологическим заболеванием, которое медицине пока не удается победить. Несмотря на всевозможные сложности, выявленный на ранней стадии рак мочевого пузыря имеет благоприятный прогноз: по данным американского National Cancer Institute, 96% пациентов после грамотной терапии живут дольше пяти лет. «Вопрос – что нужно сделать, чтобы диагностировать опухоль на ранних стадиях, – рассуждает главный уролог Минздрава Дмитрий Пушкарь. – Пойдет ли речь где-либо в мире о скрининге рака мочевого пузыря – например, специальном анализе мочи, ДНК‑анализе?» Однако пока пилотные проекты не запущены ни в одной стране, и даже самые авторитетные специалисты пока лишь осторожно обсуждают возможность такого начинания.
Источник
